饥饿对拟穴青蟹大眼幼体和Ⅰ期仔蟹蜕皮和生长的影响
2022-02-23胡伟胜马春艳马凌波张凤英刘志强
胡伟胜,马春艳,马凌波,张凤英,刘志强,赵 明,王 伟
(1.上海海洋大学水产与生命学院,水产科学国家级实验教学示范中心,上海 201306;2.中国水产科学研究院东海水产研究所遗传育种与生物技术实验室,上海 200090)
拟穴青蟹(Scyllaparamamosain),简称青蟹,隶属于节肢动物门,甲壳动物纲,十足目,梭子蟹科,青蟹属,主要分布于太平洋、印度洋的热带、亚热带和温带沿岸,是我国重要的海水养殖蟹类。2018年,我国青蟹养殖面积突破2.3万hm2,养殖产量高达15万t[1]。近年来青蟹的养殖产量虽然一直持稳定增长的趋势,但青蟹苗种的来源依旧以海捕苗种为主[2]。导致这一状况的主要原因是青蟹苗种规模化培育的相关技术尚不成熟。
在自然海域中,饥饿是十足目甲壳动物生长发育过程中时常遭受的生理胁迫之一。饥饿胁迫下,甲壳动物的消化酶活性[3-4]、组织结构[5-6]和物质组成[7-8]都会发生适应性变化。长时间的饥饿极易导致甲壳动物存活率和蜕皮率降低,蜕皮延缓[9-12]。然而,当满足一定的摄食需求后,即使此后处于持续饥饿的状态下,甲壳动物依然可以顺利完成蜕皮过程[9-10]。饵料投喂作为青蟹苗种培育过程中的关键技术之一,过多的投喂虽然可以满足苗种的营养需求,但极易败坏水质,从而引起苗种的大量死亡[13-14]。此外,轮虫和卤虫作为青蟹苗种阶段的主要生物饵料,质量小和适口性差的轮虫和卤虫极易导致短时间的饥饿胁迫。
此前,为衡量十足目甲壳动物对饥饿的耐受能力,ANGER等[15]提出以“营养储存饱和点”(PRS)和“不可恢复点”(PNR)作为评价饥饿对十足目甲壳动物负面影响的重要指标。PRS是指初始投喂时间阈值,此时间节点后,十足目甲壳动物即使持续饥饿也可以蜕皮至下一发育时期;PNR是指初始饥饿时间阈值,此时间节点后,十足目甲壳动物即使恢复投喂也不可能完成蜕皮过程。大眼幼体和Ⅰ期仔蟹作为拟穴青蟹苗种培育的关键时期,本研究确定两者的PRS50和PNR50值,阐明两者的摄食需求,以期以此为根据建立合理的饵料投喂策略,为生产中提高拟穴青蟹苗种产量提供参考。
1 材料与方法
1.1 实验动物的准备和饲养
实验选用的拟穴青蟹大眼幼体来源于东海水产研究所浙江宁海研究中心,Ⅰ期仔蟹来源于福建省霞浦县忠盛水产养殖专业合作社。相同时期的实验幼体均来源于同一亲本。实验将即将蜕皮的Ⅴ期溞状幼体和大眼幼体从育苗池转移至高0.8 m、底面半径0.5 m的圆柱形桶中培育,待幼体蜕皮后捞取新蜕皮的大眼幼体和Ⅰ期仔蟹用以开展后续实验。实验选用的大眼幼体[头胸甲长(2.32±0.05)mm]和Ⅰ期仔蟹[甲长(3.10±0.11)mm、甲宽(3.91±0.12)mm]个体健壮、活力极佳。
实验使用长方体塑料盒(长×宽×高=0.5 m×0.25 m×0.4 m)养殖大眼幼体,塑料盒内置细网片,养殖水温27.5~30.0℃,养殖盐度24~26,pH 8.0~8.4,饵料是当天孵化的丰年虫无节幼体,饵料密度是6~8个·mL-1。Ⅰ期仔蟹使用1 L的烧杯养殖,烧杯底部铺细沙,养殖水温28.0~30.5℃,养殖盐度33,pH 8.0~8.4,饵料是体长6~8 mm的冰鲜仔虾和仔鱼。实验用水均经砂滤和消毒处理。实验期间,每天8∶00和15∶00各投喂一次饵料,每天11∶00和18∶00各换水一次,每次换水1/3。
1.2 实验设计
1.2.1 大眼幼体的PRS和PNR实验
实验采用投喂-饥饿和饥饿-投喂的处理方式分别开展PRS和PNR实验。PRS实验共设3个处理组和2个对照组,处理组分别是投喂2 d-饥饿组(F2S)、投喂4 d-饥饿组(F4S)和投喂6 d-饥饿组(F6S),对照组分别是连续饥饿组(S)和连续投喂组(F)(图1-a);PNR实验同样共设3个处理组和2个对照组,处理组分别是饥饿2 d-投喂组(S2F)、饥饿4d-投喂组(S4F)和饥饿6 d-投喂组(S6F),对照组同样是连续饥饿组(S)和连续投喂组(F)(图1-b)。各组均设3个平行,每个平行25个大眼幼体。每次饲喂结束2 h后观察大眼幼体的摄食情况,确保摄食的正常。大眼幼体的实验周期是16 d。每天详细记录各组大眼幼体的死亡和蜕皮情况,测量记录大眼幼体蜕皮后Ⅰ期仔蟹的甲长、甲宽和体质量。
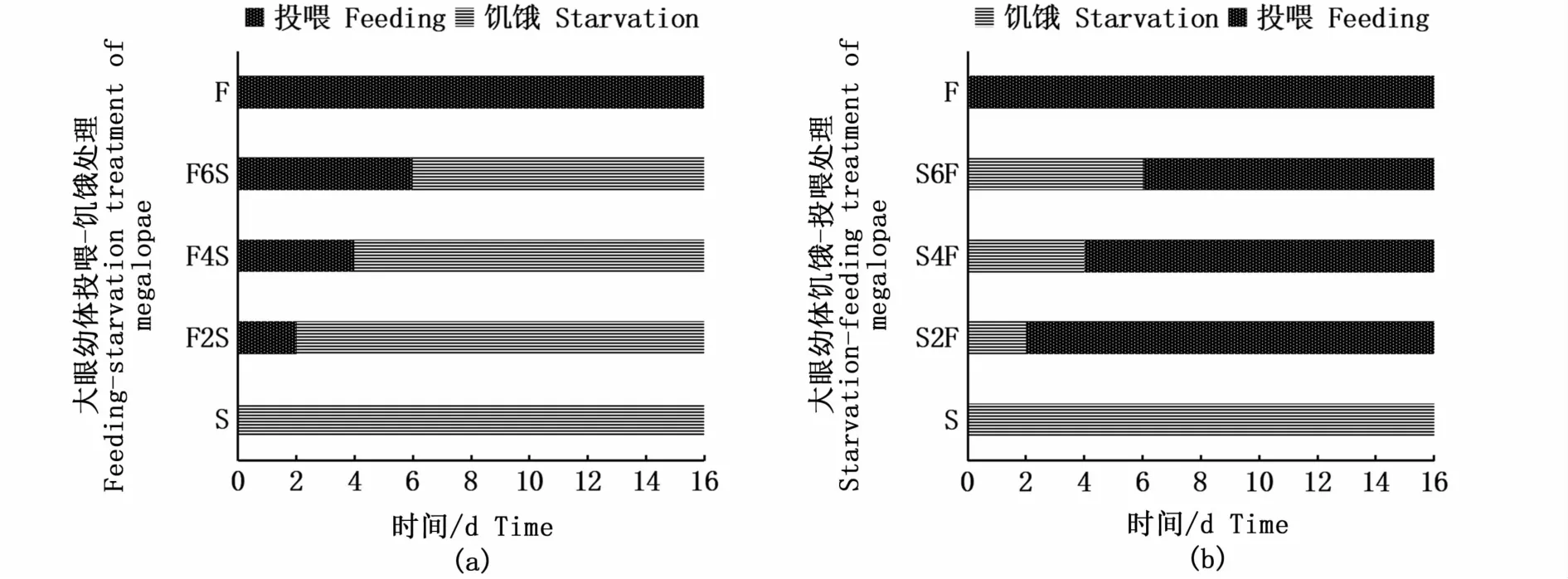
图1 大眼幼体的PRS(a)和PNR(b)实验设计Fig.1 PRS(a)and PNR(b)experimental design of megalopae
1.2.2 Ⅰ期仔蟹的PRS和PNR实验
实验同样采用投喂-饥饿和饥饿-投喂的处理方式分别开展PRS和PNR实验。PRS实验共设3个处理组和2个对照组,处理组分别是投喂1 d-饥饿组(F1S)、投喂2 d-饥饿组(F2S)和投喂3 d-饥饿组(F3S),对照组分别是连续饥饿组(S)和连续投喂组(F)(图2-a);PNR实验同样共设3个处理组和2个对照组,处理组分别是饥饿1 d-投喂组(S1F)、饥饿2 d-投喂组(S2F)和饥饿3 d-投喂组(S3F)。对照组同样是连续饥饿组(S)和连续投喂组(F)(图2-b)。各组均设3个平行,每个平行16个Ⅰ期仔蟹。每次投喂结束2 h后观察Ⅰ期仔蟹的摄食情况,确保摄食的正常。Ⅰ期仔蟹的实验周期是8 d。每天详细记录各组Ⅰ期仔蟹的死亡和蜕皮情况,测量记录Ⅰ期仔蟹蜕皮后Ⅱ期仔蟹的甲长、甲宽和体质量。
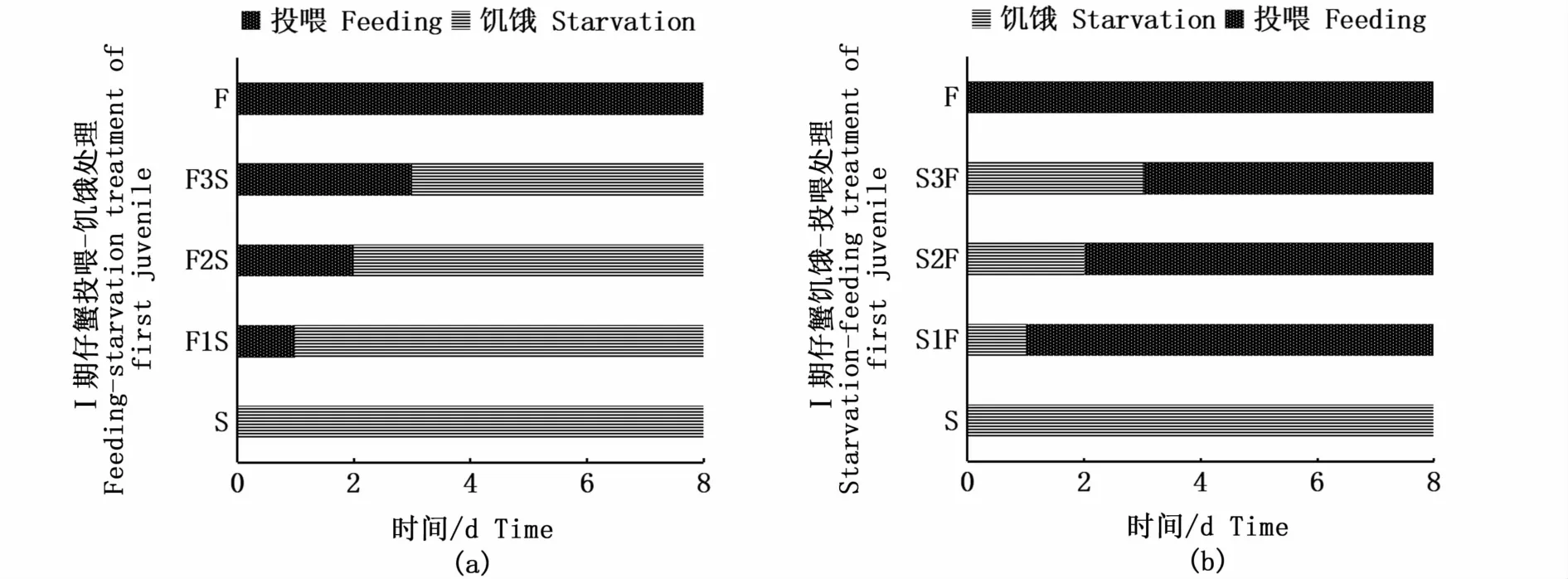
图2 Ⅰ期仔蟹的PRS(a)和PNR(b)实验设计Fig.2 PRS(a)and PNR(b)experimental design of first juvenile
1.3 数据分析
各指标计算公式如下:

式中,N0为实验开始时大眼幼体或Ⅰ期仔蟹的个体数,Nt为实验结束时大眼幼体或Ⅰ期仔蟹顺利蜕皮的个体数;W0为大眼幼体或Ⅰ期仔蟹的初始平均体质量,Wt为大眼幼体或Ⅰ期仔蟹蜕皮后Ⅰ期仔蟹或Ⅱ期仔蟹的平均体质量。
甲长甲宽的测量方式参照林琪等[16]的测量标准。
实验的蜕皮率数据根据方程y=a/[1+e(b-x)/c](Boltzmann模型)计算,使用绘图软件origin拟合S型曲线用以确定PRS50和PNR50值[17]。Boltzmann模型中y为大眼幼体或Ⅰ期仔蟹的蜕皮率,x为投喂或饥饿时间,a为大眼幼体或Ⅰ期仔蟹的最高蜕皮率,b为PRS50和PNR50的预估值,c为曲线的斜率。PRS50指“投喂-饥饿”处理,50%大眼幼体或Ⅰ期仔蟹顺利蜕皮的时间点;PNR50是指“饥饿-投喂”处理,50%大眼幼体或Ⅰ期仔蟹顺利蜕皮的时间点。
营养脆弱性指数(NVI)=PRS50/PNR50
实验数据均以平均值±标准误(mean±SE)表示,利用SPSS 26.0软件采用单因素方差分析(one-way ANOVA)对数据进行统计学检验,P<0.05代表差异显著。
2 结果与分析
2.1 大眼幼体的PRS实验结果
大眼幼体PRS的拟合曲线方程是y=95.16/[1+e(3.55-x)/0.20](R2=0.998),PRS50值是3.57 d(图3)。如图4-A所示,S组和F2S组大眼幼体的蜕皮率均为0,而F4S组、F6S组和F组3组大眼幼体的蜕皮率无显著性差异。F4S组大眼幼体蜕皮后Ⅰ期仔蟹的增重率显著低于F6S组和F组(P<0.05)(图4-B)。F4S组大眼幼体蜕皮后Ⅰ期仔蟹的甲长、甲宽显著低于F6S组和F组(P<0.05)(图4-C,D)。F4S组、F6S组和F组3组大眼幼体的发育时间无显著性差异(表1)。

表1 投喂-饥饿处理对大眼幼体发育时间的影响Tab.1 Effects of feeding-starvation treatment on development time of megalopae
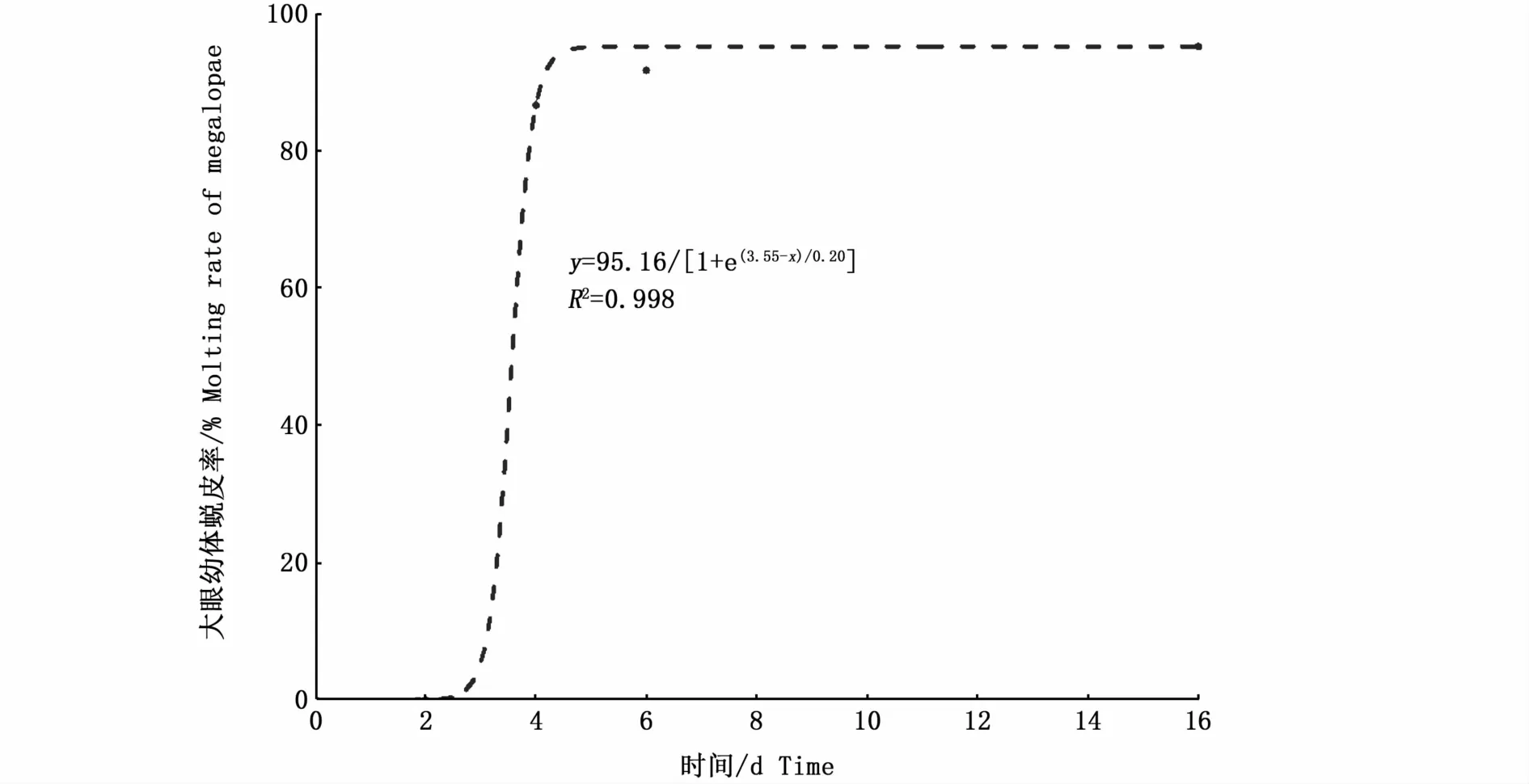
图3 大眼幼体的PRS拟合曲线Fig.3 PRS fitting curve of megalopae
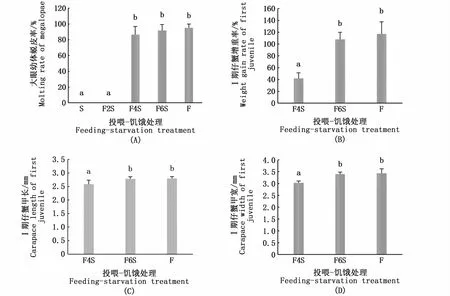
图4 投喂-饥饿处理对大眼幼体的蜕皮率和新蜕皮的Ⅰ期仔蟹增重率、个体大小的影响Fig.4 Effects of feeding-starvation treatment on molting rate of megalopae and weight gain rate and body size of newly molted first juvenile
2.2 大眼幼体的PNR实验结果
初步统计,饥饿1 d时大眼幼体的存活率为(68.33±5.00)%;饥饿2 d时大眼幼体的存活率仅为(30.00±13.23)%。实验观察到大眼幼体初始饥饿状态下,相残行为十分严重,很大一部分大眼幼体摄食了同类。因此,本文未对大眼幼体的PNR实验数据做更深入地统计分析。
2.3 Ⅰ期仔蟹的PRS实验结果
Ⅰ期仔蟹PRS的拟合曲线方程是y=100/[1+e(0.90-x)/0.18](R2=0.999),PRS50值是0.90 d(图5)。如图6-A所示,S组Ⅰ期仔蟹的蜕皮率为0,F2S组、F3S组和F组3组Ⅰ期仔蟹的蜕皮率均显著性差异。投喂时间越长,Ⅰ期仔蟹蜕皮后Ⅱ期仔蟹的增重率越高(图6-B)。F1S组和F2S组Ⅰ期仔蟹蜕皮后Ⅱ期仔蟹的甲长、甲宽显著低于F3S组和F组(P<0.05)(图6-C,D)。此外,F1S组Ⅰ期仔蟹的发育时间相比于其他处理组显著延长(P<0.05)(表2)。

表2 投喂-饥饿处理对Ⅰ期仔蟹发育时间的影响Tab.2 Effects of feeding-starvation treatment on development time of first juvenile

图5 Ⅰ期仔蟹的PRS拟合曲线Fig.5 PRS fitting curve of first juvenile

图6 投喂-饥饿处理对Ⅰ期仔蟹的蜕皮率和新蜕皮的Ⅱ期仔蟹的增重率、个体大小的影响Fig.6 Effects of feeding-starvation treatment on molting rate of first juvenile and weight gain rate and body size of newly molted second juvenile
2.4 Ⅰ期仔蟹的PNR实验结果
Ⅰ期仔蟹PNR的拟合曲线方程是y=97.92/[1+e(2.02-x)/-0.32](R2=0.999),PNR50值是2.01 d(图7)。如图8-A所示,S2F组和S3F组Ⅰ期仔蟹的蜕皮率显著低于S1F组和F组(P<0.05)。Ⅰ期仔蟹蜕皮后Ⅱ期仔蟹的增重率随饥饿时间的延长逐步降低(图8-B)。Ⅰ期仔蟹蜕皮后Ⅱ期仔蟹的甲长、甲宽显著高于其他处理组(P<0.05)(图8-C,D)。随着饥饿时间的增加,Ⅰ期仔蟹的发育时间逐渐延长,各饥饿-投喂组Ⅰ期仔蟹的发育时间差异显著(P<0.05)(表3)。

表3 饥饿-投喂处理对Ⅰ期仔蟹发育时间的影响Tab.3 Effects of starvation-feeding treatment on development time of first juvenile

图7 Ⅰ期仔蟹的PNR拟合曲线Fig.7 PNR fitting curve of first juvenile
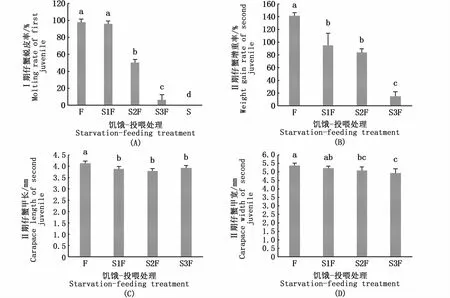
图8 饥饿-投喂处理对Ⅰ期仔蟹的蜕皮率和新蜕皮的Ⅱ期仔蟹的增重率、个体大小的影响Fig.8 Effects of starvation-feeding treatment on molting rate of first juvenile and weight gain rate and body size of newly molted second juvenile
2.5 Ⅰ期仔蟹的NVI值
Ⅰ期仔蟹的PRS50和PNR50的值分别是0.90 d和2.01 d,NVI=0.45。
3 讨论
3.1 饥饿对拟穴青蟹大眼幼体和Ⅰ期仔蟹蜕皮的影响
蜕皮过程作为十足目甲壳动物最重要的生理过程,其顺利与否直接关乎十足目甲壳动物的生死存亡。本研究结果表明,长时间的饥饿明显降低拟穴青蟹大眼幼体和Ⅰ期仔蟹的蜕皮率,但短时间的饥饿对Ⅰ期仔蟹的蜕皮率基本无影响。相似的实验结果同样见于相手蟹(Sesarma rectum)[17]和红树林蟹[9]的大眼幼体以及中华绒螯蟹(Eriocheirsinensis)[18]和 火 焰虾(Lysmata debelius)[19]的Ⅰ期溞状幼体。但同样的规律并不适用于鞭藻虾(Lysmataboggessi)[19]的Ⅰ期溞状幼体以及岩虾(Palaemonelegans)[20]和长臂虾(Palaemonserratus)[20]的 十 足 幼 体。据 报道[19-20],鞭藻虾Ⅰ期溞状幼体以及岩虾和长臂虾十足幼体的蜕皮率并不因饥饿时间的长短而发生变化,它们的蜕皮率均为100%。此外,即使是同一物种,不同的发育时期,饥饿对蜕皮率的影响也是迥然不同。研究表明[19],鞭藻虾Ⅱ期溞状幼体的变态率与饥饿时间呈负相关,这与Ⅰ期溞状幼体的结果截然不同。相似的现象同样见于岩虾和长臂虾[20]。显然,饥饿对甲壳动物蜕皮率的影响是与物种和发育时期密切相关的。
拟穴青蟹苗种培育过程中苗种的发育时间是判断苗种是否处于健康状态的重要指标。拟穴青蟹大眼幼体的PRS实验结果表明,投喂时间≥4 d时,大眼幼体的发育时间无显著性变化,但长时间饥饿明显延迟Ⅰ期仔蟹的发育时间。研究表明[12,17,19],饥饿是否对发育时间产生显著性影响主要取决于物种和物种所处的发育时期以及饥饿处理方式。据报道,相手蟹(Sesarma curacaoense)大眼幼体的PRS实验中饥饿显著缩短大眼幼体的发育时间,而PNR实验中各组大眼幼体的发育时间却无显著性差异[17]。与相手蟹大眼幼体截然不同的是豆蟹(Fabiasubquadrata)大眼幼体的PRS实验中各组大眼幼体的发育时间无显著性差异,但PNR实验中饥饿显著延长大眼幼体的发育时间[12]。显然,物种的不同和处理方式的差异是造成相手蟹和豆蟹实验结果差异的主要原因。但是,即使是同一物种、同一种饥饿处理方式,发育时期不同,饥饿对发育时间的影响也是大相径庭的。以鞭藻虾为例,饥饿-投喂处理,Ⅰ期溞状幼体的发育时间无显著性变化,但Ⅱ期溞状幼体的发育时间却明显延长[19]。同样发育时期的不同很可能也是本文大眼幼体发育时间的变化趋势与Ⅰ期仔蟹不同的主要原因。
3.2 饥饿对拟穴青蟹大眼幼体和Ⅰ期仔蟹蜕皮后生长的影响
饥饿迫使甲壳动物必须利用自身储存的能量物质以维持自身的生理代谢。据报道,三疣梭子蟹(Portunustrituberculatus)[21]和锯缘青蟹[22]Ⅰ期溞状幼体处于饥饿状态下时,体内蛋白质和脂类的含量持续下降。十足目甲壳动物能量物质的减少直接导致体质量的降低。本文研究结果表明,饥饿明显降低拟穴青蟹大眼幼体和Ⅰ期仔蟹蜕皮后Ⅰ期仔蟹和Ⅱ期仔蟹的体质量。据报道,远海梭子蟹[23]Ⅰ期溞状幼体和凡纳滨对虾(Litopenaeusvannamei)[24]仔虾的干重随饥饿时间的延长逐步降低。此外,黑爪蟹大眼幼体的PRS实验中,F组大眼幼体蜕皮后Ⅰ期仔蟹的干重显著高于S组、F3S组和F6S组,但与F9S组和F12S组却无显著性差异[12],本文拟穴青蟹大眼幼体变化趋势与其一致。形态学数据表明,饥饿导致拟穴青蟹大眼幼体和Ⅰ期仔蟹蜕皮后Ⅰ期仔蟹和Ⅱ期仔蟹的甲长、甲宽明显缩短。相应的,三疣梭子蟹Ⅰ期溞状幼体蜕皮后Ⅱ期溞状幼体的头胸甲长与饥饿时间呈负相关[25],而宝石蟹大眼幼体蜕皮后Ⅰ期仔蟹的甲长、甲宽也随饥饿时间的延长而逐步缩小[11]。显然,饥饿与十足目甲壳动物的形态学变化紧密相关。
3.3 拟穴青蟹大眼幼体和Ⅰ期仔蟹的耐饥饿能力
拟穴青蟹大眼幼体的PRS50值是3.57 d,而心型仿招潮蟹和红树林招潮蟹大眼幼体的PRS50值分别是2.09 d和2.4 d[9-10]。三者比较而言,拟穴青蟹大眼幼体的耐饥饿能力相对较低。此外,初始饥饿2 d时,拟穴青蟹大眼幼体的存活率仅为(30.00±13.23)%,这提示对于新蜕壳的拟穴青蟹大眼幼体必须给予充足的饵料以确保高的存活率,此措施对于提高苗种产量至关重要。
营养脆弱性指数(NVI)是衡量甲壳动物饥饿耐受性的重要指标,NVI≤0.5时表示甲壳动物对外源食物依赖性低;0.5<NVI<1.0时表示甲壳动物对外源食物中度依赖;NVI≥1.0时表示甲壳动物对外源食物高度依赖[9-10,17,26]。十足目甲壳动物的NVI值与个体大小和发育时期密切相关。据报道,蜘蛛蟹(Stenorhynchusseticornis)Ⅰ期溞状幼 体 的NVI值 为2.2[26]。两 种 相 手 蟹(Sesarmacuracaoense、Sesarmarectum)[17]和心型仿招潮蟹[10]大眼幼体的NVI值分别是0.2、0.13和0.33。本研究中拟穴青蟹Ⅰ期仔蟹的NVI值为0.45(<0.5),这表明拟穴青蟹Ⅰ期仔蟹对外源食物依赖性低。
本文分析了不同饥饿处理对拟穴青蟹大眼幼体和Ⅰ期仔蟹蜕皮率、蜕皮后的个体大小以及发育时间的影响。实验结果分析可知,新蜕皮的拟穴青蟹大眼幼体必须给予充足的饵料才可确保高的存活率,大眼幼体投喂的第6天可以适当减少饵料的投喂量。Ⅰ期仔蟹的耐饥饿能力明显强于大眼幼体。此外,Ⅰ期仔蟹作为拟穴青蟹苗种出售的主要阶段,运输途中短时间的饥饿不可避免,而本文证实短时间的饥饿对Ⅰ期仔蟹的蜕壳和生长影响相对较小,这为生产上以Ⅰ期仔蟹、而非以大眼幼体作为主要出售阶段提供了理论依据。
