饲料中糊精替代鱼油对大菱鲆幼鱼代谢及免疫反应的影响*
2016-05-12苗淑彦韩冬冬苗惠君张文兵麦康森
苗淑彦, 韩冬冬, 聂 琴, 苗惠君, 张文兵**, 麦康森
(1.中国海洋大学水产动物营养与饲料农业部重点实验室,海水养殖教育部重点实验室,山东 青岛 266003;
2.扬州大学动物科学与技术学院,江苏 扬州 225009)
饲料中糊精替代鱼油对大菱鲆幼鱼代谢及免疫反应的影响*
苗淑彦1,2, 韩冬冬1, 聂琴1, 苗惠君1, 张文兵1**, 麦康森1
(1.中国海洋大学水产动物营养与饲料农业部重点实验室,海水养殖教育部重点实验室,山东 青岛 266003;
2.扬州大学动物科学与技术学院,江苏 扬州 225009)
摘要:为研究饲料中糊精替代鱼油对大菱鲆(Scophthalmus maximus)幼鱼代谢及免疫反应的影响,在饲料中蛋白质含量为45%的基础上,配制4组等氮等能的饲料(D1、D2、D3和D4),饲料中可溶性糖含量分别为1.93%、5.80%、15.98%和28.27%,脂肪含量分别为16.48%、12.82%、10.78%和6.64%,其中糊精为糖源,鱼油和大豆卵磷脂为脂肪源。在室内流水系统中养殖大菱鲆幼鱼((8.32 ± 0.06)g),检测大菱鲆幼鱼的血液和肝脏中糖、脂肪和蛋白质代谢及抗氧化指标,试验周期为9周。研究表明:随着饲料中糊精替代鱼油水平的升高,大菱鲆的血糖含量、血浆胰岛素含量、血浆谷草转氨酶(AST)和谷丙转氨酶(ALT)活性(P<0.05)显著升高。其中,D4组AST活性显著高于其余3组(P<0.05),D1组ALT活性显著高于其余3组(P<0.05)。饲料中糊精替代鱼油水平的升高对血浆中总氨基酸、总胆固醇(CL)和甘油三酯(TGs)的含量无显著影响(P>0.05)。随着饲料中糊精含量的不断上升,血浆中溶菌酶、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)活性和总抗氧化能力(T-AOC)呈下降趋势。肝脏中碱性磷酸酶(AKP)和CAT活性以及T-AOC也有一定程度下降(P<0.05),但肝脏溶菌酶活性显著上升(P<0.05)。当饲料可溶性糖含量为15.98%时,肝脏SOD活性最高(P<0.05)。结果表明:饲料中,糊精替代鱼油既影响大菱鲆幼鱼的糖和脂类代谢,又影响其免疫力。在实际生产中,除了关注饲料中糖对鱼体生长的影响,还应关注糖对鱼体代谢及免疫的影响。
关键词:大菱鲆; 糖; 糊精; 鱼油; 代谢; 免疫
引用格式:苗淑彦,韩冬冬,聂琴,等. 饲料中糊精替代鱼油对大菱鲆幼鱼代谢及免疫反应的影响[J].中国海洋大学学报(自然科学版), 2016, 46(4): 21-27.
MIAO Shu-Yan, Han Dong-Dong, NIE Qin, et al. Influence of replacement of dietary fish oil by dextrin on metabolism and immune response of juvenile turbot (Scophthalmusmaximus) [J].Periodical of Ocean University of China, 2016, 46(4): 21-27.
蛋白质和脂肪是水产动物配合饲料中主要的能量来源,但研究表明,鱼类也能够利用饲料中适量的糖类物质[1],从而降低配合饲料中蛋白质和脂肪的含量,进而缓解鱼类饲料对鱼粉和鱼油的依赖,降低饲料成本。对脂肪的研究表明:饲料中脂肪含量过多可能会抑制鱼类的生长,并引起脂肪在鱼体内的蓄积[2-4]。脂肪缺乏会导致鱼类生长停滞及其它一系列生理学疾病[3,5]。与脂肪相比,糖类物质具有成本低、来源稳定且不易引起鱼类脂肪肝等优点。由于鱼类的代谢及免疫状态与营养供给状况密切相关[6-10],因此,在研究鱼类对糖类利用效率时,除生长指标外,代谢及免疫反应也是受关注的重要方面。研究发现,饲料中糖的含量应保持在适宜范围内,过量的糖会对鱼体产生代谢负荷,危害鱼体健康[8,11]。
大菱鲆(Scophthalmusmaximus)因其价格较高、肉质鲜美、生长快而成为欧洲和亚洲地区重要的养殖品种[12]。苗淑彦等利用剂量-效应生长实验,以糊精为饲料糖源,以特定生长率为指标,确定大菱鲆对饲料糖的需求量为15%,并比较了不同饲料糖源对大菱鲆代谢反应的影响[13]。但饲料糖水平对大菱鲆机体代谢的影响尚不清楚。本研究以饲料可溶性糖含量为1.93%、脂肪含量为16.48%为基准,按照等氮等能设计,分别设置不同糊精替代鱼油水平的饲料,探讨其对大菱鲆代谢和免疫反应的影响,为完善鱼类糖代谢理论和科学指导配合饲料中糖类物质的使用提供基础数据。
1材料与方法
1.1 实验饲料配方和制作
饲料配方及组成见表1。对照组饲料中未添加可溶性糖,包含44.12%蛋白质和16.48%脂肪。在对照组饲料的基础上,每组饲料分别添加不同含量的糊精(济南鑫奎化工有限公司,食品级),添加水平分别为5%、15%和28%,同时调节饲料脂肪水平以保持与对照组饲料能量相当。4组等氮等能的实验饲料分别命名为D1、D2、D3和D4。配制饲料前,所有原料过80目筛,混匀,然后添加鱼油和大豆卵磷脂充分混合,加水混匀后在螺杆挤压机中制成1.5mm×3.0mm的颗粒,50℃烘箱内干燥后置-20℃冰箱保存。
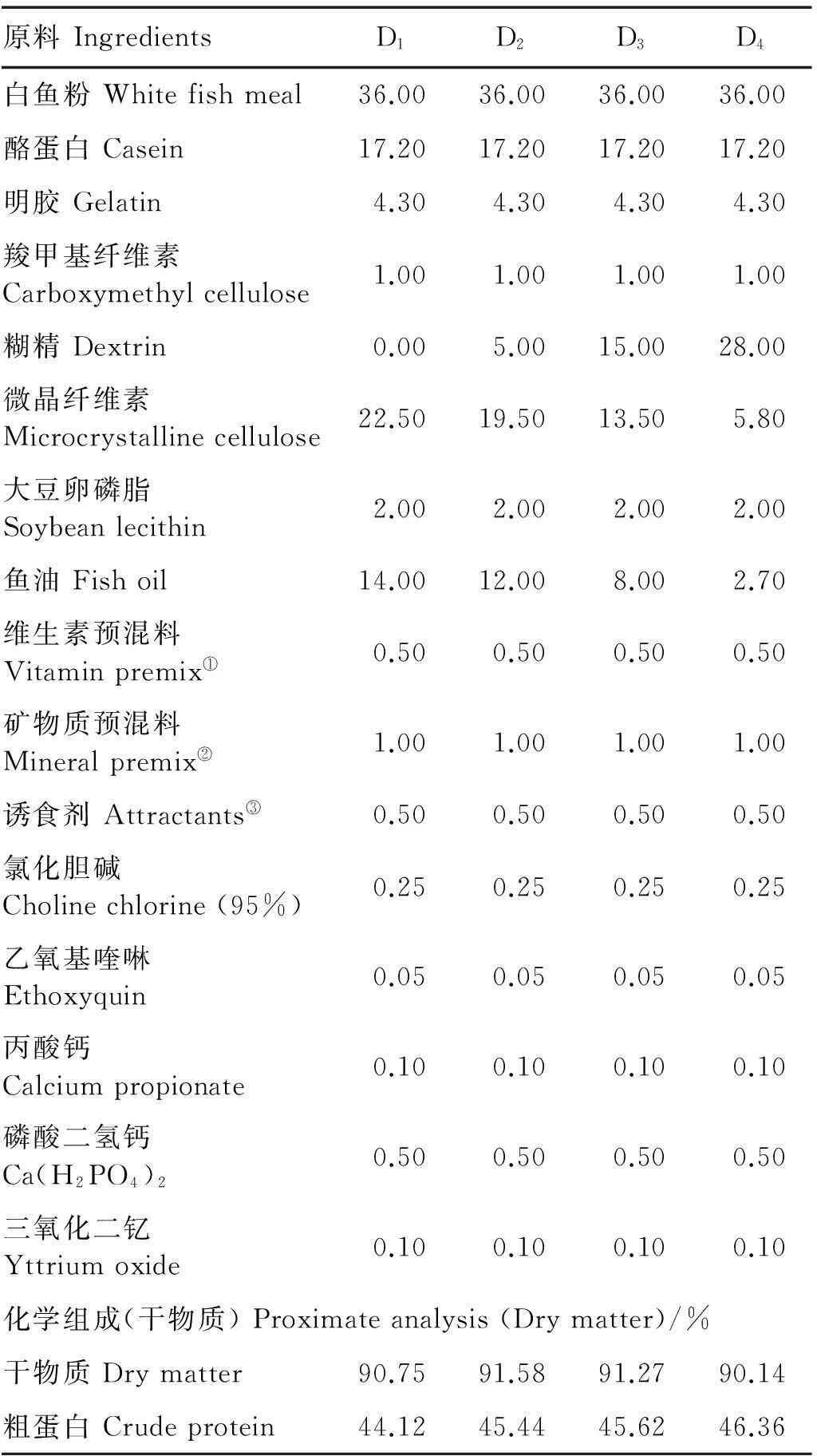
表1 试验饲料配方及常规营养组成(干物质)
续表1
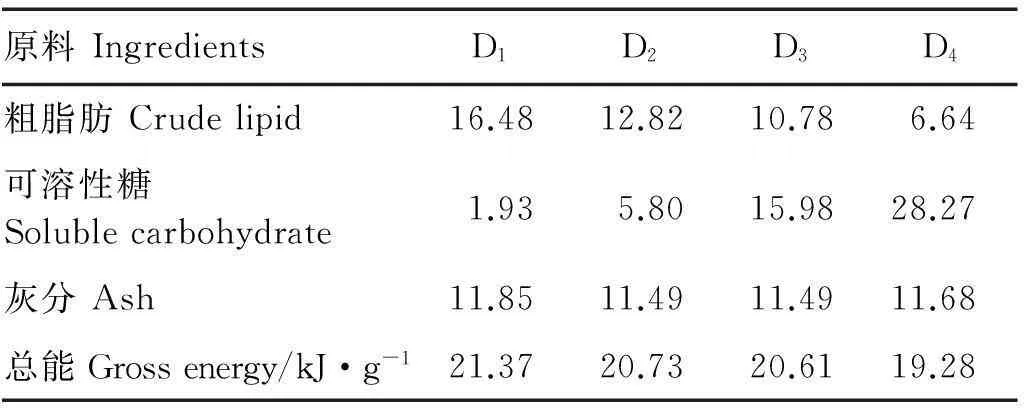
原料IngredientsD1D2D3D4粗脂肪Crudelipid16.4812.8210.786.64可溶性糖Solublecarbohydrate1.935.8015.9828.27灰分Ash11.8511.4911.4911.68总能Grossenergy/kJ·g-121.3720.7320.6119.28
注:①维生素混合物(mg/kg 饲料):维生素A,32mg;维生素D,5mg;维生素E,240mg;维生素K,10mg;维生素B1,25mg;维生素B2,45mg;烟酸, 200mg;维生素B6,20mg;生物素,60mg;肌醇,800mg;泛酸钙,60mg; 叶酸,20mg;维生素B12,10mg;维生素C,2000mg;微晶纤维素,4292.54mg。②矿物质预混物(mg/kg 饲料):五水硫酸铜,10mg;亚硒酸钠,20mg;一水硫酸锰,45mg;六水氯化钴(1%),50mg;一水硫酸锌,50mg;碘酸钙(1%),60mg;一水硫酸亚铁,80mg;七水硫酸镁,1200mg;沸石粉,18485mg。③诱食剂:牛磺酸∶甘氨酸∶甜菜碱=1∶3∶3。
Notes: ①Vitamin premix (mg/kg diet): Vitamin A, 32mg; Vitamin D, 5mg; Vitamin E, 240mg; Vitamin K, 10mg; Vitamin B1, 25mg; Vitamin B2, 45mg; Nicotinic acid, 200mg; Vitamin B6, 20mg; Biotin, 60mg; Inositol, 800mg; Calcium pantothenate, 60mg; Folic acid, 20mg; Vitamin B12, 10mg; Vitamin C, 2000mg; Microcrystalline cellulose, 4292.54mg;②Mineral premix (mg/kg diet): CuSO4·5H2O, 10mg; Na2SeO3, 20mg; MnSO4·H2O, 45mg; CoCl2·6H2O (1%), 50mg; ZnSO4·H2O, 50mg; Ca(IO3)2(1%), 60mg; FeSO4·H2O, 80mg; MgSO4·7H2O, 1200mg; Zeolite powder, 18485mg;③Attractants: taurine∶glycine∶betaine=1∶3∶3.
1.2 试验用鱼及养殖管理
试验用大菱鲆幼鱼购自山东省青岛市胶南养殖场,为当年人工培育的同一批种苗,大小均匀,健康无病。养殖试验在中国海洋大学鳌山卫实验基地室内流水养殖系统中进行,养殖容器为500L的玻璃钢桶,桶内水流速度为6L/min。实验前投喂商业饲料(青岛七好生物科技有限公司提供)暂养2周以适应环境。实验开始前,禁食大菱鲆24h,选择体重相近((8.36±0.02)g),体格健壮的幼鱼,随机分为4组,每组设3个重复,每个重复放养28尾鱼。每天人工投喂2次实验饲料(07:00和18:00),每日观察摄食情况并记录,调整饲料投喂达饱食水平。投喂结束1h后,收集残饵。实验周期为9周,每周检测2次水质指标,水温为18~20℃,pH为7.6~7.8,盐度为28.2~30.2,溶解氧7.10~8.07mg/L,氨氮为0.045~0.092mg/L、亚硝酸氮为0.023~0.058mg/L。
1.3 样品收集及指标测定
养殖实验结束后,大菱鲆禁食24h取样。为减少取样操作对鱼体产生的应激,所有的实验鱼于取样前麻醉(MS 222,100mg/kg)。随机取10尾鱼,用肝素钠取血器于尾静脉取血,血液先于离心机2000r/min离心10min,分离血浆后立刻置于液氮中保存以测定血液学及免疫学指标。其次,取5尾鱼的肝脏迅速置于液氮保存用于分析肝脏免疫学指标。
饲料原料及饲料中的糖含量采用蒽酮比色法[14]测定。
血浆总氨基酸含量参照Moore的茚三酮方法[15]进行测定。血糖采用葡萄糖氧化法进行测定(Sigma kit No. 510,Sigma Chemicals,St. Louis,MO)。血浆胰岛素的测定参照Plisetskaya等的方法[16]。血浆总胆固醇和甘油三酯的测定参照Trinder的方法[17]。血浆谷草转氨酶(AST)和谷丙转氨酶(ALT)活性用全自动生化分析仪测定(Hitachi 7020, Tokyo, Japan)。
免疫学指标测定方法如下:
碱性磷酸酶(AKP)活力测定苯磷酸二钠法[18]。一个酶活力单位定义为:每分钟每毫克蛋白质在37℃下与底物反应30min后产生1mg苯酚的酶量。
溶菌酶活力测定参照Ellis的方法[19]。一个酶活力单位定义为:每分钟每毫克蛋白质使吸光值变化0.001的酶量。
过氧化氢酶(CAT)活力测定参照Beer和Sizer的方法[20]。
超氧化物歧化酶(SOD)活力测定参照邹国林的方法[21]。计算公式:
1个酶活力单位=[(邻苯三酚自氧化率-每分钟测定样品OD值变化)/邻苯三酚自氧化率×50%]×[(反应液总体积/样品量)/样品中蛋白质的含量]。
总抗氧化能力(T-AOC)测定ABTS法(总抗氧化能力检测试剂盒,南京建成生物工程研究所)。
蛋白含量测定考马斯亮蓝法。以牛血清白蛋白为标准品,绘制标准曲线,根据标准曲线测得样品的蛋白含量。
所有测定均采用3个重复。
1.4 统计分析
采用EXCEL 2003和SPSS 13.0软件进行统计分析,数据采用平均值±标准误(Means ± S.E.)的形式表示,显著水平为P<0.05。当差异显著时采用Duncan’s多重比较分析组间的差异显著程度。
2结果
2.1 血液生理生化指标
大菱鲆幼鱼的血液学指标见表2。饲料中不同糊精水平替代鱼油后对大菱鲆幼鱼血浆总氨基酸、总胆固醇(CL)和甘油三酯(TGs)的含量没有显著影响(P>0.05),但显著影响血浆葡萄糖和胰岛素的含量以及谷草转氨酶(AST)和谷丙转氨酶(ALT)的活性(P<0.05)。其中,D4组大菱鲆幼鱼的血浆葡萄糖含量显著高于其余3组(P>0.05)。D4组大菱鲆幼鱼的血浆胰岛素含量最高,其次是D3组,D1和D2组胰岛素含量最低(P<0.05)。D4组AST活性显著高于其余3组(P<0.05),但D1组ALT活性显著高于其余3组(P<0.05)。
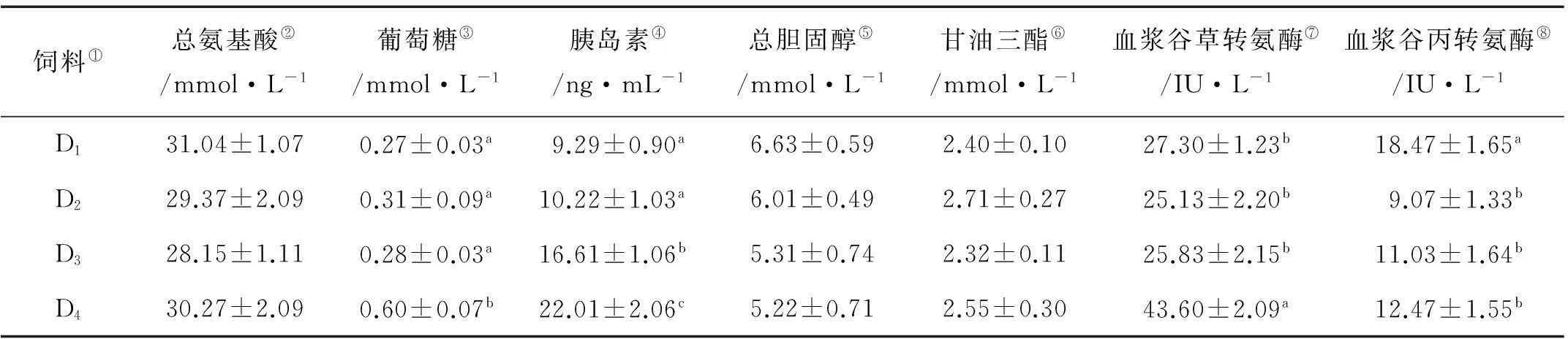
表2 饲料中不同含量糊精替代鱼油对大菱鲆幼鱼血液学指标的影响
注:表中数据以平均值±标准误表示(n=3),同列不同上标英文字母表示差异显著(P<0.05)。
Note:Values (mean ±S.E. of three replicates) in the same column not sharing a common superscript are significantly different (P<0.05).
①Diets;②Totalα-amino acids;③Glucose;④Insulin;⑤Total cholesterol;⑥Triacylglycerols;⑦Glutamic oxalacetic transaminase;⑧Glutamic-pyruvic transaminase
2.2 免疫学指标
大菱鲆幼鱼的免疫学指标见表3。
饲料中不同糊精水平替代鱼油后对大菱鲆幼鱼血浆碱性磷酸酶(AKP)活性没有显著影响(P>0.05),但显著影响了血浆溶菌酶和抗氧化酶的活性(P<0.05)。D4组血浆溶菌酶活性显著高于其余3组(P<0.05);D4组血浆过氧化氢酶(CAT)活性显著高于D1和D2组(P<0.05),D3组血浆CAT活性与其余3组没有显著差异(P>0.05);D4组血浆超氧化物歧化酶(SOD)活性显著低于其余3组(P<0.05);D1组血浆总抗氧化能力(T-AOC)显著高于其余3组(P<0.05)。
饲料中不同糊精水平替代鱼油后显著影响肝脏免疫学指标(P<0.05)。D1组大菱鲆幼鱼肝脏AKP活性最高,D2和D4组最低,D3组肝脏AKP活性与其余3组无显著差异(P<0.05);D4组大菱鲆幼鱼肝脏溶菌酶活性最高,其次为D3组,D1组最低(P<0.05),D2组与D1和D3组没有显著差异(P>0.05);D3组大菱鲆幼鱼肝脏的CAT和SOD活性显著高于D4组(P<0.05),D1和D2组CAT、SOD活性与其余两组没有显著差异(P>0.05);D4组肝脏T-AOC活性显著低于其余3组(P<0.05)。
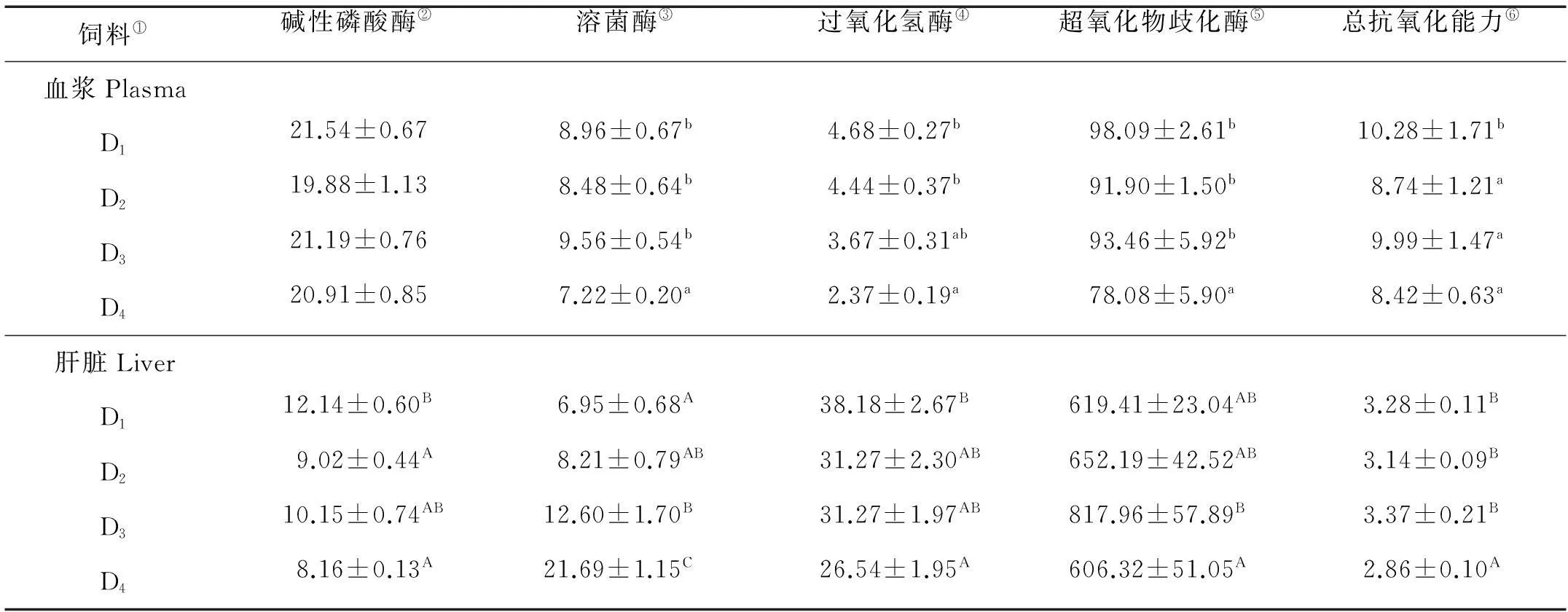
表3 饲料中不同含量糊精替代鱼油对大菱鲆幼鱼血浆及肝脏中免疫学指标的影响/U·mg-1
注:表中数据以平均值±标准误表示(n=3),同列不同上标英文字母表示差异显著(P<0.05)。
Notes: Values (mean ±S.E. of three replicates) in the same column not sharing a common superscript are significantly different (P<0.05).
①Diets;②Alkaline phosphatase;③Lysozyme;④Catalase;⑤Superoxide dismutase;⑥Total antioxidant capacity
3讨论
3.1 糊精替代鱼油对大菱鲆血液学指标的影响
部分血浆参数的变化可以反映鱼类对营养素代谢的改变。在本实验条件下,大菱鲆血浆总氨基酸含量不受饲料的影响。Lee等[22]对牙鲆(Paralichthysolivaceus)的研究也发现,随着饲料中糊精水平的增加,各组间牙鲆血浆氨基酸含量没有显著差异,说明饲料中一定量的糖替代脂肪不会对鱼类的蛋白质代谢产生影响。
一般而言,鱼体血糖水平随着饲料中糖含量的增加而升高[23]。在本试验条件下,仅当饲料中可溶性糖含量为28.27%时,血糖水平显著升高。但对武昌鱼(Megalobramaamblycephala)的研究得出了相反的结论,当饲料中糖替代脂肪,即饲料中糖的含量由19.30%升高到41.63%,同时脂肪的含量由11.89%降低至1.73%后,武昌鱼的血糖含量先升高而后降低[10]。Li等[10]认为这可能是由两方面的原因造成的。首先,武昌鱼是草食性淡水鱼类,具有较高的血糖调节能力,因此,饲料中的高糖水平没有引起血糖含量的升高;其次,饲料中高含量的脂肪可能引起鱼类的应激反应,从而导致血糖水平的升高。血糖能够诱导硬骨鱼类胰岛素的释放[24-25]。例如,当鱼类摄食高糖饲料后,血浆胰岛素水平显著升高[25],这主要是因为葡萄糖能够引起鱼类Brockmann小体分泌胰岛素[23]。胰岛素的释放一方面有利于组织对血糖的吸收,从而能够促使鱼类较好地利用糖;另一方面,饲料中高含量的糖能持续提高胰岛素敏感性,从而增加对糖的利用,提高鱼类对糖的适应[25]。对欧洲鲈(Dicentrarchuslabrax)的研究表明,饲料的营养组成也显著影响肝脏细胞对糖类的利用以及胰岛素对糖类刺激的应答[26]。在本研究中,随着饲料中糖含量的升高,胰岛素水平也显著上升。参照血糖水平的变化,说明血糖对胰岛素的诱导具有一定的滞后性,从而在一定程度上降低了鱼类对胰岛素的利用效率。另外,对胰岛素的分析表明,胰岛素通过与细胞表面的胰岛素受体结合而参与调节鱼类和其它脊椎动物的摄食、生长、发育及中间代谢等各个方面。肉食性鱼类对胰岛素受体的亲和力较低[27],同时也说明了肉食性鱼类对糖类利用的有限性。但对大鳞大麻哈鱼的葡萄糖耐受试验表明,血浆胰岛素水平与葡萄糖摄入量没有显著关系[28]。许多研究也表明,葡萄糖诱导胰腺分泌胰岛素的能力远低于氨基酸和脂肪酸,Hemre等[29]对大西洋鳕(Gadusmorhua)的研究显示,有氨基酸存在时,葡萄糖对胰岛素分泌的刺激作用得到加强,因此推测鱼类胰岛素的主要作用可能是调控蛋白质代谢而不是糖代谢[23,29]。
本研究中,血浆甘油三酯和胆固醇水平并不受饲料中糖脂含量变化的影响,这与Enes等[30]对欧洲鲈的研究结果一致。齐野等[31]对宝石鲈(Scortumbarcoo)的研究结果表明,淀粉和糊精对血浆甘油三酯的影响较大,随糖水平的升高而上升,但血浆总胆固醇含量却不受饲料可消化糖水平的影响。对瓦氏黄颡鱼(Pelteobagrusvachelli)的研究结果表明,血清中甘油三酯和总胆固醇的含量随着饲料中糖水平的升高而降低,其中40%糖处理组显著低于7%和24%糖处理组[32]。
谷草转氨酶和谷丙转氨酶主要分布于机体肝和肾等组织细胞中,在糖、蛋白质和脂肪三大物质代谢过程中起着十分重要的作用,是硬骨鱼类肝脏中重要的氨基转移酶[33]。正常情况下,血浆中这2种酶的活性低且含量稳定,当肝脏受到损伤时可导致大量转氨酶释放到血液中,引起血浆中这两种酶浓度上升或活性增强[34-35],这通常被认为是肝肾等组织受到损伤,鱼体健康状况受到影响的表现[36]。本试验结果表明,饲料中高糖水平显著升高谷草转氨酶和谷丙转氨酶的活性。可见,高糖对大菱鲆肝脏产生了一定的损伤。但Li等[10]对武昌鱼的研究结果表明,相对于高脂肪饲料组,高糖饲料组的鱼体谷草转氨酶和谷丙转氨酶活性呈下降趋势,说明武昌鱼对高糖的耐受能力较高脂强。
3.2 糊精替代鱼油对大菱鲆免疫学指标的影响
对哺乳类和鱼类的研究结果均表明,饲料的营养组成能够显著影响动物的抗病力[37],而免疫指标能准确地反映机体的健康状况。通过对免疫指标的检测可以间接考察大菱鲆对糖的耐受情况。非特异性免疫系统(吞噬细胞、中性粒细胞、巨噬细胞、溶菌酶等)被认为是病原防御的第一道屏障。Tokutake等[38]认为,溶菌酶是鱼类非特异性免疫的第一道屏障,能够防御外来细菌的入侵。在本研究中,当饲料中糖含量较高时,血浆溶菌酶活性显著下降,但肝脏溶菌酶活性显著上升。Vielma[39]等研究了糖类对白鲑(Coregonuslava-retus)应激和免疫参数的影响。结果表明,与低糖饲料组相比,高糖饲料组的溶菌酶活性较低;Lin等[6]对点带石斑鱼的研究发现,随着饲料糖水平的升高,血浆溶菌酶活性下降。但目前尚无实质性的证据表明长期摄食高糖饲料会对虹鳟的溶菌酶产生影响[40]。
正常状态下,机体能够利用抗氧化防御机制,如抗氧化酶等抵抗细胞产生的活性氧(ROS),从而缓解其对机体产生的氧化压力。在本研究中,血浆和肝脏抗氧化酶活性随着饲料中糖含量的升高而具有显著变化,糖含量升高,过氧化氢酶和总抗氧化能力具有一定程度的下降。高糖饲料显著降低了鱼类的抗氧化酶活性,说明高糖应激对鱼类产生了免疫抑制作用。超氧化物歧化酶是生物体内清除氧自由基的重要酶类,是活性氧防御系统中的主要成分,保护机体细胞免受自由基损伤[41]。超氧化酶歧化酶普遍存在于水产动物体内,正常情况下,鱼体SOD酶可清除氧化代谢产物,当鱼体处于应激状态时,其氧化能力下降,过量的氧自由基与不饱和脂肪酸发生脂质过氧化,对鱼体造成损伤[42]。对大菱鲆超氧化酶歧化酶的研究结果表明,饲料中适量的糖水平对血浆超氧化酶歧化酶活性没有显著影响,但过高的糖水平使超氧化酶歧化酶活性下降,提示高水平的糖可能对大菱鲆产生了一定的营养胁迫,使其清除自由基的能力减弱,可能会进一步影响大菱鲆的健康。
4结语
本研究结果表明,饲料中糊精替代鱼油水平的升高显著升高了大菱鲆血糖和血浆胰岛素的含量,但对总氨基酸、总胆固醇和甘油三酯的含量没有显著影响。同时,饲料糊精替代鱼油水平的升高显著降低血浆溶菌酶、CAT、SOD和T-AOC的活性及MDA的含量,同时肝脏AKP、CAT和T-AOC等酶活性也显著下降。这表明,饲料中不同的糊精替代鱼油水平不仅能够影响大菱鲆幼鱼的糖脂代谢,同时对免疫反应也产生显著影响。
参考文献:
[1]Wilson R P. Utilization of dietary carbohydrate by fish [J]. Aquaculture, 1994, 124: 67-80.
[2]Garling D L J, Wilson R P. Effects of dietary carbohydrate to lipid ratios on growth and body composition of fingerling channel catfish[J]. Progressive Fish-Culturist, 1977, 39: 43-47.
[3]Takeuchi T, Satoh S, Watnabe T. Requirement ofTilapianiloticafor essential fatty acids[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1983, 49: 977-982.
[4]Chou B S, Shiau S Y. Optimal dietary lipid level for growth of juvenile hybrid tilapia,Oreochromisniloticus×Oreochromisaureus[J]. Aquaculture, 1996, 143: 185-195.
[5]Castell J D, Sinnhuber R O, Lee D J, et al. Essential fatty acids in the diet of rainbow trout (Salmogaindneri), Physiological symptoms of EFA deficiency[J]. Journal of Nutrition, 1972, 102: 67-92.
[6]Lin Y H, Shiau S Y. Dietary lipid requirement of grouper,Epinephelusmalabaricus, and effects on immune responses [J]. Aquaculture, 2003, 225: 243-250.
[7]Lin Y H, Shiau S Y. Dietary vitamin E requirement of grouper,Epinephelusmalabaricus, at two lipid levels, and their effects on immune responses [J]. Aquaculture, 2005, 248: 235-244.
[8]Kumar V, Sahu N P, Pal A K, et al. Immunomodulation ofLabeorohitajuveniles due to dietary gelatinized and non-gelatinized starch [J]. Fish & Shellfish Immunology, 2007, 23: 341-353.
[9]Lim C, Yildirim-Aksoy M, Li M H, et al. Influence of dietary levels of lipid and vitamin E on growth and resistance of Nile tilapia toStreptococcusiniaechallenge [J]. Aquaculture, 2009, 298: 76-82.
[10]Li X F, Liu W B, Lu K L, et al. Dietary carbohydrate/lipid ratios affect stress, oxidative status and non-specific immune responses of fingerling blunt snout bream,Megalobramaamblycephala[J].Fish & Shellfish Immunology, 2012, 33: 316-323.
[11]Polakof S, Panserat S, Soengas J L, et al. Glucose metabolism in fish: a review [J]. Comparative Biochemistry and Physiology, part B, 2012, 182: 1015-1045.
[12]Nie Q, Miao H, Miao S, et al. Effects of dietary glucose and dextrin on activity and gene expression of glucokinase and fructose-1,6-bisphosphatase in liver of turbotScophthalmusmaximus[J]. Fish Physiology and Biochemistry, 2015, 41(3): 819-832.
[13]苗淑彦, 苗慧君, 聂琴, 等. 饲料中不同种类的碳水化合物对大菱鲆生长性能和代谢反应的影响[J].水产学报, 2013, 37(6): 910-919.
Miao S Y, Miao H J, Nie Q, et al. Effects of different dietary carbohydrates on growth performance and metabolism response of juvenile turbotScophthalmusmaximus[J]. Journal of Fisheries of China, 2013, 37(6): 910-919.
[14]Hedge J E,Hofreiter B T.Carbohydrate Chemistry[M]. New York: Academic Press, 1962.
[15]Moore S. Amino acid analysis: aqueous dimethyl sulfoxide as solvent for the ninhydrin reaction [J]. Journal of Biological Chemistry, 1968, 243: 6281-6283.
[16]Plisetskaya E M, Dickhoff W W, Paquette T L, et al. The assay of salmon insulin by homologous radio-immunoassay[J]. Fish Physiology and Biochemistry, 1986, 1: 37-43.
[17]Trinder P. Determination of blood glucose using an oxidase-peroxidase system with a non-carcinogenic chromogen [J].Journal of Clinical Pathology, 1969, 22: 158-161.
[18]Pipe R K. Hydrolytic enzymes associated with the granular haemocytes of the marine musselMytilusedulis[J]. Histochemical Journal, 1990, 22: 595-603.
[19]Ellis A E. Lysozyme assays[J]. Techniques in Fish Immunology, 1990, 1: 101-103.
[20]Beers R F, Sizer O W. Spectrophotometric method for measuring the breakdown of hydrogen peroxide by catalase [J]. Journal of Biological Chemistry, 1952, 195:133-140.
[21]邹国林, 桂兴芬, 钟晓凌, 等. 一种SOD的测定方法[J]. 生物化学和生物物理进展, 1986, 4: 71-73.
Zou G L, Gui X F, Zhong X L, et al. A method to analyze the activity of SOD [J]. Progress in Biochemistry and Biophysics, 1986, 4: 71-73.
[22]Lee S M, Kim K D, Lall S P. Utilization of glucose, maltose, dextrin and cellulose by juvenile flounder (Paralichthysolivaceus) [J]. Aquaculture, 2003, 221: 427-438.
[23]Hemre G I, Mommsen T P, Krogdahl Å. Carbohydrates in fish nutrition: effects on growth, glucose metabolism and hepatic enzymes [J]. Aquaculture Nutrition, 2002, 8: 175-194.
[24]Zhu H Y, Wang G J, Yu D G, et al. Changes in nitric oxide level and nitric oxide synthase and sensitivity to Vibrio parahaemolyticus in serum of white leg shrimp exposed to sudden changes in water temperature [J]. Journal of Dalian Fisheries University, 2006, 21(1): 46-50.
[25]Leung L Y, Woo Y S. Influence of dietary carbohydrate level on endocrine status and hepatic carbohydrate metabolism in the marine fishSparussarba[J]. Fish Physiology and Biochemistry, 2012, 38: 543-554.
[26]Enes P,Sanchez-Gurmaches J, Navarro I, et al. Role of insulin and IGF-I on the regulation of glucose metabolism in European sea bass (Dicentrarchuslabrax) fed with different dietary carbohydrate levels [J]. Comparative Biochemistry and Physiology, 2010, 157A: 346-353.
[27]Párrizas M, Planas J, Plisetskaya E M, et al. Insulin receptor and its tyrosine kinase activity in skeletal muscle of carnivorous and omnivorous fish[J]. American Journal of Physiology, 1994, 266: 1944-1950.
[28]Mazur C N, Higgs D A, Plisetskaya E, et al. Utilization of dietary starch and glucose tolerance in juvenile Chinook salmon (Oncorhynchustshawytscha) of different strains in seawater [J]. Fish Physiology and Biochemistry, 1992, 10: 303-313.
[29]Hemre G I, Lie Ø, Sundby A. Dietary carbohydrate utilisation in cod (Gadusmorhua): metabolic responses to feeding and fasting[J]. Fish Physiology and Biochemistry, 1993, 10(6): 455-463.
[30]Enes P, Panserat S, Kaushik S, et al. Rapid metabolic adaptation in European sea bass (Dicentrarchuslabrax) juveniles fed different carbohydrate sources after heat shock stress [J]. Comparative Biochemistry and Physiology, 2006, 145A: 73-81.
[31]齐野. 宝石鲈对饲料可消化糖利用的初步研究[D].天津: 天津农学院, 2010.
Qi Y. Preliminary study on the utilization of dietary digestible carbohydrate byScortumbarcoo[D]. Tianjin: Tianjin Agricultural University, 2010.
[32]杨莹, 陈立侨, 李二超, 等.饲料糖水平对瓦氏黄颡鱼幼鱼生长、体成分和血清生化指标的影响研究[J].复旦学报(自然科学版), 2011(5): 625-631.
Yang Y, Chen L Q, Li E C, et al. Effect of dietary carbohydrate level on growth, body composition and biochemical indices in serum of Pelteobagrus vachelli [J]. Journal of Fudan University (Natural Science), 2011(5): 625-631.
[33]Cowey C B, Walton M J. Intermediary metabolism. In: Halver JE (ed) Fish nutrition [M]. San Diego:Academic Press,1989: 260-329.
[34]郑永华, 蒲富永. 汞对鲤鲫鱼组织转氨酶活性的影响[J].西南农业大学学报, 1997, 19(1): 41-45.
Zheng Y H, Pu F Y. Effect of mercury on transaminase activities of tissues inCparpio&Cauratus[J]. Journal of Southwest Agricultural University, 1997, 19(1): 41-45.
[35]沈同, 王镜岩. 生物化学(下册) [M]. 北京: 高等教育出版社, 1999.
Shen T, Wang J Y. Biochemistry [M]. Beijing: Higher Education Press, 1999.
[36]高露姣, 施兆鸿, 艾春香. 不同脂肪源对施氏鲟幼鱼血清生化指标的影响[J].海洋渔业, 2005, 27(40): 319-323.
Gao L J, Shi Z H, Ai C X. Effect of dietary lipid sources on the serum biochemical indices ofAcipenserschrenckiijuvenile [J]. Marine Fisheries, 2005, 27(40): 319-323.
[37]Lygren B, Hemre G I. Influence of dietary carbohydrate on antioxidant enzyme activities in liver of Atlantic salmon (SalmosalarL.) [J]. Aquaculture International, 2001, 9: 421-427.
[38]Tokutake K, Mochizuki A, Matsumiya M. Seasonal variation of lysozyme activity in short-necked clam [J]. Nippon Suisan Gakkaishi, 1992, 58: 1103-1106.
[39]Vielma J, Koskelaa J, Ruohonenb K, et al. Optimal diet composition for European whitefish (Coregonuslavaretus): carbohydrate stress and immune parameter responses [J]. Aquaculture, 2003, 225: 3-16.
[40]Page G I, Hayworth K M, Wade R R, et al. Non-specific immunity parameters and the formation of advanced glycosylation end-products (AGE) in rainbow trout,Oncorhynchusmykiss(Walbaum), fed high levels of dietary carbohydrates [J]. Aquaculture Research, 1999, 30: 287-297.
[41]Mourente G, Good J E, Thompson K D. Effects of partial substitution of dietary fish oil with blends of vegetable oils, on blood leucocyte fatty acid compositions, immune function and histology in European sea bass (DicentrarchuslabraxL.) [J]. British Journal of Nutrition, 2007, 98(4):770-779.
[42]叶继丹, 韩友文, 赵吉伟, 等. 喹乙醇对鲤肝胰抗氧化酶系统的影响[J]. 水产学报, 2004, 28(3): 231-235.
Ye J D, Han Y W, Zhao J W, et al. Effects of dietary olaquindox on antioxidant enzymes system in hepatopancreas ofCyprinuscarpio[J]. Journal of Fisheries of China, 2004, 28(3): 231-235.
责任编辑朱宝象
Influence of Replacement of Dietary Fish Oil by Dextrin on Metabolism and Immune Response of Juvenile Turbot (Scophthalmusmaximus)
MIAO Shu-Yan1, 2, HAN Dong-Dong1, NIE Qin1, MIAO Hui-Jun1, ZHANG Wen-Bing1, MAI Kang-Sen1
(1.The Key Laboratory of Aquaculture Nutrition and Feeds of Ministry of Agriculture, Ocean University of China, Qingdao 266003, China; 2. College of Animal Science and Technology, Yangzhou University, Yangzhou 225009, China)
Abstract:A 9-week feeding trial was conducted to determine the influence of replacement of dietary fish oil by dextrin on the haematological and immunological parameters of juvenile turbot (Scophthalmus maximus) (initial body weight: (8.32 ± 0.06)g). Each of the four isonitrogenous and isoenergetic diets (D1, D2 through D4) containing graded levels of soluble carbohydrates (1.93%, 5.80%, 15.98% and 28.27%) and lipids (16.48%, 12.82%, 10.78% and 6.64%) was fed to turbot to apparent satiation in a flow-through water system. Results showed that dietary carbohydrate content significantly increased the plasma glucose and insulin concentration in turbot (P<0.05). The activity of glutamic oxalacetic transaminase (AST) in serum of fish fed diet D4 was significantly higher than that of other three groups (P<0.05). Meanwhile, the activity of glutamic-pyruvic transaminase (ALT) in serum of fish fed diet D1 was significantly higher than that in other three groups (P<0.05). However, dietary carbohydrate content did not significantly affect plasma total amino acids, total cholesterol (CL) and triglycerides (TGs) concentrations (P>0.05). With the increasing dietary carbohydrate contents, the activity of lysozyme, catalase (CAT), superoxide dismutase (SOD) and total antioxidant capacity (T-AOC) in plasma significantly decreased (P<0.05). The same thing was true in the activity of alkaline phosphatase (AKP), CAT and T-AOC in liver (P<0.05), but not lysozyme (P<0.05). The results of the haematological parameters suggested that the replacement of dietary fish oil by dextrin did not influence the protein metabolism of turbot. Glucose induced insulin secretion in the pancreas was much lower than that of amino acids and fatty acids. Meanwhile, the activities of ALT and AST in serum significantly increased in D4 treatment. It was suggested that high dietary carbohydrate content would have certain damage to the liver of turbot. This effect did not occurred in the study of blunt-snout bream. In regard to the immunological parameters, high dietary dextrin content significantly decreased the activity of lysozyme, CAT, SOD and the T-AOC in plasma. It was suggested that high dietary dextrin content stressed the metabolism of turbot. It would weaken its ability to scavenge free radicals. This may further affect the health of turbot.With the isonitrogenous and isoenergetic design, the results of present study indicated that different dietary dextrin contents not only affected the glucose and lipid metabolisms, but also the immunity of turbot.
Key words:turbot; carbohydrate; dextrin; fish oil; metabolism; immune
DOI:10.16441/j.cnki.hdxb. 20150101
中图法分类号:S963.71
文献标志码:A
文章编号:1672-5174(2016)04-021-07
作者简介:苗淑彦(1978-),女,博士生。研究方向:水生动物营养与饲料学**通讯作者: E-mail:wzhang@ouc.edu.cn
收稿日期:2015-04-22;
修订日期:2015-09-09
*基金项目:国家重点基础研究发展计划项目(2014CB138600)资助
Supported by the National Basic Research Program (2014CB138600)
