芍药甘草汤对中枢性肌张力增高大鼠脑内氨基酸及其受体的影响お
2016-05-11王景霞杨旭张建军周恬恬朱映黎王林元
王景霞 杨旭 张建军 周恬恬 朱映黎 王林元

[摘要]探讨芍药甘草汤对中枢性肌张力增高大鼠模型的神经递质及其受体的影响。采用线拴法所致的脑卒中恢复期痉挛性肌张力增高大鼠模型,以巴氯芬为对照,实验组给予芍药甘草汤3∶1配伍比例,给药3周后测定其神经功能评分、肌张力、痛阈的变化,并采用HPLC测定大脑皮层GABA,Gly,Glu,Asp含量,免疫组化法测定大脑皮层GABA受体Aα1,B与NMDA受体亚基NR1,NR2A,NR2B蛋白表达。结果显示芍药甘草汤3∶1配伍剂量组对脑卒中后痉挛偏瘫状态有较好的改善作用,能显著改善神经症状(P<001),降低肌张力(P<001),改善痛域(P<005);能够显著增加脑内抑制性氨基酸GABA,Gly的含量(P<001),对于兴奋性氨基酸Glu,Asp有降低的趋势,但没有统计学意义;能够显著增强大脑抑制性神经递质受体GABA受体Aα1和B的表达 (P<005),并减少大脑兴奋性神经递质受体NMDA各亚型NR1,NR2A,NR2B的表达(P<005)。研究表明,芍药甘草汤3∶1配伍剂量具有较好的解痉止痛之效,不仅能够增加脑卒中后痉挛状态大鼠脑内抑制性氨基酸的水平,同时还可增加其受体的表达,从而增加抑制性神经信号转导的强度;对于脑内兴奋性氨基酸水平虽然没有显著性作用,但也有降低的趋势,同时对于兴奋性氨基酸受体的表达也有抑制作用,从而减弱兴奋性神经信号转导的强度,减轻兴奋性神经毒性。结果表明,芍药甘草汤可通过调节脑内抑制性和兴奋性神经能系统的平衡,从而达到缓解脑卒中痉挛状态,起到柔筋止痉的作用。
[关键词]芍药甘草汤;柔筋止痉;肌张力;氨基酸;氨基酸受体
芍药甘草汤是《伤寒论》中的名方,由芍药和甘草2味药组成,其配伍精当,具有酸甘化阴、养阴血、平肝阳、息肝风、柔筋脉、缓挛急、止疼痛的作用特点。原方虽为脚挛急所设,但后世医家根据其配伍特点,对其拓展发挥,用于治疗临床各科肌肉痉挛疼痛,对于卒中后痉挛偏瘫也取得了很好的疗效[13]。本课题组前期研究成功复制了脑卒中痉挛偏瘫大鼠模型,掌握了中枢性肌张力增高的变化规律,实验结果显示芍药甘草汤对脑卒中后痉挛偏瘫状态有较好的改善作用,能够显著改善神经症状,降低肌张力,改善痛阈,具有解痉止痛之效,其解痉止痛最佳配伍比例为3∶1(芍药甘草)[4]。但对于中枢性肌张力增高模型大鼠痉挛状态的生化基础,以及芍药甘草汤缓解痉挛的中枢机制还不十分清楚。本实验在前期研究的基础上,采用线拴法所致的脑卒中恢复期痉挛性肌张力增高大鼠模型作为实验对象,给予最佳配伍比例的芍药甘草汤,对其柔筋止痉的作用进行进一步的确认,同时对其脑内氨基酸及其受体进行测定,分析芍药甘草汤对痉挛偏瘫大鼠的中枢神经系统的影响,探讨其柔筋止痉的特色。
1材料
SD雄性大鼠120只,体重250~280 g,斯贝福(北京)实验动物技术有限公司提供,动物许可证编号SCXK(京)20110004。
芍药甘草汤(18∶6)原料芍药,炙甘草购自北京圣惠堂中药饮片公司,药品生产许可证号分别为京20100018,京20100018。巴氯芬购自卫达化学制药有限公司,批号341101,规格80 mg·d-1。γ氨基丁酸(GABA),天门冬氨酸(Asp),谷氨酸(Glu),甘氨酸(Gly)购自美国Sigma公司。邻苯二甲醛(OPA),碳酸钾,甲醇,醋酸,乙腈,磷酸二氢钾和硼酸购自北京国药公司分析纯试剂。γ氨基丁酸受体Aα1(GABARAα1),γ氨基丁酸受体B(GABARB),N甲基D天门冬氨酸受体1(NR1),N甲基D天门冬氨酸受体2A (NR2A),N甲基D天门冬氨酸受体2B(NR2B)等抗体购自abcam公司,货号分别为ab52177,ab90883,ab33299,ab69873,ab84184。
MedLabU/4CS生物采集系统购自南京美易科技有限公司;新航JZ100型张力换能器购自北京新航兴业科贸有限公司;高效液相色谱仪购自美国Agilent公司;JJ12J型脱水机购自武汉俊杰电子有限公司;JBP5型包埋机购自武汉俊杰电子有限公司;RM2016型病理切片机购自上海徕卡仪器有限公司;KDP型组织摊片机购自浙江省金华市科迪仪器设备有限公司;GT1001型组化笔购自Gene tech;Nikon Eclipse TiSR型倒置荧光显微镜,Nikon DSU3型成像系统购自日本尼康。
2方法
21动物分组及给药
取雄性SD大鼠,随机分为假手术组、模型组、阳性药组、芍药甘草汤组(芍药甘草18∶6)。造模后除去造模失败、死亡及无症状大鼠,并开始给药,巴氯酚按135 mg·kg-1灌胃给药,芍药甘草汤按生药浓度32 g·kg-1灌胃给药(人体重按60 kg计),假手术组和模型组给等量纯水,每日1次,连续给药3周。
22造模方法
采用线拴法所致的脑卒中后痉挛性肌张力增高大鼠模型[5],作适当改进。使用腹腔注射10%水合氯醛溶液(35 mg·kg-1)麻醉动物。大鼠采取仰卧位固定,颈部正中用手术刀切开皮肤,钝性分离各层组织,暴露右侧的颈总动脉(CCA)。分离至颈内动脉(ICA)、颈外动脉(ECA)分叉后,分离仔细避免损伤迷走神经和气管等,置线备用。于颈总、颈内动脉处用动脉夹夹闭,颈外动脉近心端及远心端进行结扎,中间用剪刀剪断。将颈外动脉游离端拉至与颈内动脉成一条直线,将栓线由颈外动脉插入,插入后丝线结扎,防止出血,去除颈内动脉动脉夹,将尼龙线缓慢插入颈内动脉,继续插入至颅内,插入深度大约(185±05) mm至微感阻力,使栓线头端通过MCA起始处,达到较细的大脑前动脉,此时即实现右侧大脑中动脉的血流阻塞,结扎ICA以固定栓线预防出血,在伤口处撒少许青霉素积极预防术后感染,用手术线逐层缝合皮肤,并留置栓线线尾端15 cm于缝合皮肤外。于术后120 min将栓线抽至颈内动脉起始部恢复脑血流,并将皮肤外的栓线剪去。手术过程中室温保持在24~25 ℃。
23指标检测
造模3周后对各组大鼠进行神经行为学评分、肌张力、痛阈测试等。
231神经功能缺损评分[6]参考Zea Longa标准评定:0分,无神经损伤症状;1分,不能完全伸展对侧前爪;2分,向对侧转圈;3分,向对侧倾倒;4分,不能自发行走,意识丧失。1~3分为模型成功,0分及4分为造模失败。
232肌张力测定[7]将电刺激针的一端插入痉挛侧后肢股四头肌内,另一端连于电刺激器,并在后肢下端系一丝线,丝线经传感器与四道生理记录仪相连,定时对股四头肌进行刺激(刺激量15 mA),通过记录仪记录后肢伸直的幅度,观察大鼠肌张力情况。
233痛阈测定[8]将大鼠装入笼内露出尾部并自然下垂,100瓦白炽灯照射刺激尾部远端1/3处,距离为5 cm。记录从刺激开始至大鼠出现甩尾动作的时间,连续测量3次,每次间隔5 min,取平均值作为衡量痛阈的指标。
234邻苯二甲醛(OPA)柱前衍生HPLC荧光检测法测定大脑皮层GABA,Gly,Glu,Asp的含量给药结束后,各组大鼠闸刀断头,冰台上快速取脑。将取得的脑组织放入标记的冻存管中,液氮冻存数分钟后移入-80 ℃冰箱。取适量皮层组织,称湿重,按1∶9加入生理盐水,用手动玻璃匀浆器冰浴匀浆;匀浆液在4 ℃ 3 000 r·min-1低温离心15 min,取上清液05 mL,加04 mol·L-1高氯酸1 mL去蛋白,同时加50 μL混合标贮备液,混合,4 ℃ 3 000 r·min-1低温离心15 min,取上清液05 μL,加入2 mol·L-1碳酸钾缓冲溶液1 mL,再用01 mol·L-1碳酸钾缓冲溶液稀释到5 mL,在4 ℃ 1万r·min-1离心20 min,取上清液按衍生化反应和色谱条件进行洗脱。用含50%甲醇的01 mol·L-1碳酸钾缓冲液配制成1 mmol·L-1的Asp,Glu,Gly,GABA对照品贮备液。采用美国Agilen 1100高效液相色谱仪。流动相为01 mol·L-1,pH 60磷酸二氢钾缓冲液甲醇乙腈(6∶3∶1),用045 μm孔径滤膜过滤,脱气15 min。流速10 mL·min-1;荧光检测波长为发射波长455 nm,激发波长357 nm;柱温35 ℃;进样量20 μL。以各氨基酸同内标的峰面积比值和各自浓度作标准曲线,测定含内标样品的待测氨基酸与内标峰面积比值,求出样品中4种氨基酸浓度。
235免疫组化法测定大脑皮层GABA受体Aα1,B和NMDA受体亚基NR1,NR2A,NR2B蛋白表达给药结束后,各组大鼠腹腔注射3%水合氯醛10 mL·kg-1,麻醉大鼠,心脏穿刺经升主动脉快速灌注4 ℃生理盐水200 mL,换用4%多聚甲醛经心脏灌流固定,断头取脑放入4%多聚甲醛中后固定24 h,75%乙醇脱水,二甲苯透明,浸蜡,行石蜡包埋,制成5 μm厚度的同一冠状面石蜡切片,用于免疫组化试验。组织切片常规脱蜡至水,后将组织切片置于盛满EDTA抗原修复缓冲液(pH 80)的修复盒中并放于微波炉内进行抗原修复。先中火8 min,后停火8 min,再转至中低火7 min;后将切片放入3%过氧化氢溶液,在室温避光孵育25 min,将载玻片置于PBS(pH 74)溶液中在脱色摇床上洗涤晃动3次,每次时间5 min。切片轻轻甩干后用组化笔在组织周围画圆圈以防止抗体流走,然后滴加3% BSA室温封闭30 min,甩干BSA后在圈内滴加用3% BSA按一定比例稀释好的一抗来覆盖组织。将切片平放置于4 ℃湿盒内孵育过夜。后将载玻片置于PBS(pH 74)中在脱色摇床上洗涤晃动3次,每次时间5 min。切片稍甩干后在组织上滴加新鲜配制的DAB显色液,显微镜下严格控制显色时间,阳性为棕黄色,后用自来水冲洗切片以终止显色。然后用Harris苏木素复染3 min左右,使用自来水进行冲洗,再用1%盐酸乙醇分化数秒,自来水冲洗,氨水返蓝,再流水反复冲洗。然后将切片依次放入70%乙醇,80%乙醇,90%乙醇,95%乙醇,无水乙醇Ⅰ,无水乙醇Ⅱ,二甲苯Ⅰ,二甲苯Ⅱ中各5 min脱水透明,后将切片从二甲苯取出稍晾干,最后中性树胶封片。镜下观察细胞及轴突出现棕黄色为阳性细胞。阴性对照组用一抗稀释液(PBS液)代替一抗,其余步骤同实验组。显色后封片,显微镜下观察照相,每组切片20倍物镜,10倍目镜下随机选取9个视野进行测量分析。采用Imagepro plus 60病理图像分析系统分析皮层中GABAARα1,GABABR,NR1,NR2A,NR2B的积分光密度(integral optical density,IOD)。
24统计学处理
采用SPSS 200统计软件对数据进行处理,结果以±s表示,组间均值比较采用T检验,各组数据采用单因素方差分析(OneWay ANOVA)进行统计学分析,两两比较选择Dunnett,方差齐采用LSD检验,方差不齐采用Tamhanes T 2法进行多重比较,以P<005为差异有统计学意义。
3结果
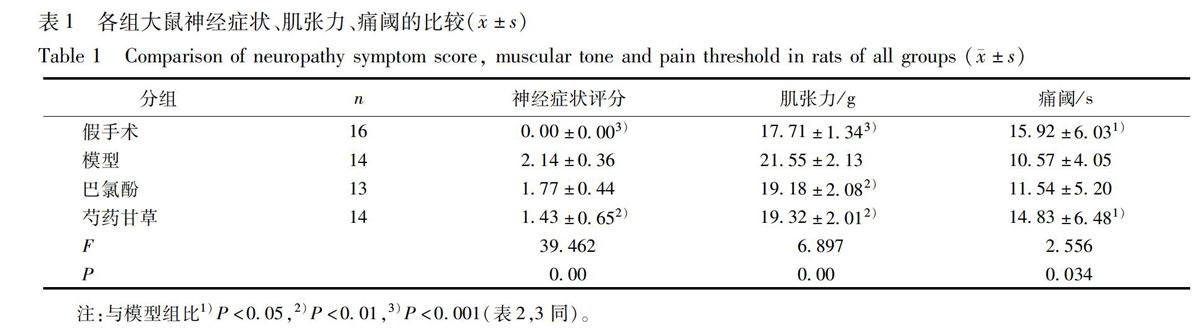
31芍药甘草汤对大鼠神经症状评分的影响
假手术组与模型组比较有统计学意义(P<0001),说明模型组出现明显的神经功能障碍;巴氯酚组与模型组比较无统计学意义;芍药甘草汤组与模型组比较有统计学意义(P<001),说明芍药甘草汤对卒中后痉挛偏瘫大鼠的神经功能障碍有显著的改善作用(表1)。
32芍药甘草汤对大鼠肌张力的影响
假手术组与模型组比较有统计学意义(P<0001),说明模型组大鼠的肌张力明显增高;巴氯芬组与模型组比较有统计学意义(P<001);芍药甘草汤组与模型组比较有统计学意义(P<001),说明芍药甘草汤能显著降低卒中后痉挛偏瘫大鼠的肌张力(表1)。
33芍药甘草汤对大鼠痛域的影响
假手术组与模型组比较有统计学意义(P<005),说明模型组大鼠对疼痛耐受性降低;巴氯芬组与模型组比较无统计学意义;芍药甘草汤组与模型组比较有统计学意义(P<001),说明芍药甘草汤能明显提高卒中后痉挛偏瘫大鼠对疼痛的耐受,缓解痉挛期的肌肉疼痛(表1)。
34芍药甘草汤对大鼠脑内GABA,Gly,Glu,Asp的影响
模型组大鼠脑内GABA,Gly含量明显下降(假手术组与模型组比较均有统计学意义,P<0001),而Glu,Asp含量明显升高(假手术组与模型组比较均有统计学意义,P<0001);巴氯酚对GABA,Gly含量有升高的趋势(与模型组比较均无统计学意义),能显著降低Glu,Asp含量(与模型组比较有统计学意义,P<0001,P<001);芍药甘草汤能显著升高卒中后痉挛偏瘫大鼠脑内GABA,Gly含量(与模型组比较均有统计学意义,P<001),对Glu,Asp含量有降低的趋势(与模型组比较均无统计学意义)(表2)。
35芍药甘草汤对大鼠脑内GABARAα1,GABARB,NMDAR1,NMDAR2A,NMDAR2B蛋白表达的影响
模型组大鼠脑内GABA受体Aα1,B蛋白表达明显减少(假手术组与模型组比较均具有极显著统计学意义,P<0001),NMDA受体NR1,NR2A,NR2B蛋白表达明显增加(假手术组与模型组比较均具有统计学意义,P<005或P<0001);巴氯酚对GABA受体Aα1蛋白表达有增加趋势(与模型组比较无统计学意义),对GABA受体B蛋白表达表
达明显增加(与模型组比较有统计学意义,P<0001),对NMDA受体NR1,NR2A,NR2B蛋白表达有减少趋势(与模型组比较均无统计学意义);芍药甘草汤能显著增加卒中后痉挛偏瘫大鼠脑内GABA受体Aα1,B蛋白表达(与模型组比较均有统计学意义,P<005),减少NMDA受体NR1,NR2A,NR2B蛋白表达(与模型组比较均有统计学意义,P<005)(表3)。
·
4讨论
现代医学认为痉挛主要可分为中枢性痉挛和周围性痉挛[9],而脑卒中痉挛状态属于中枢机制产生的肌张力增高异常变化,现代研究其与脑内的氨基酸类神经递质失衡关系密切[1014]。氨基酸类神经递质分为兴奋性氨基酸和抑制性氨基酸,抑制性神经递质包括γ氨基丁酸、甘氨酸等,兴奋性神经递质包括谷氨酸、天门冬氨酸、P物质等。研究表明脑内氨基酸浓度在痉挛状态中具有重要的作用,抑制性氨基酸浓度的降低与兴奋性氨基酸浓度的升高能够影响肌张力异常增高[15]。羊继平等[16]研究表明抑制性氨基酸上升,兴奋性氨基酸下降与缓解肌肉痉挛关系密切。研究表明甘氨酸存在于小脑、海马、延髓、脊髓中[17],其受体具有多个亚型,甘氨酸能够与γ氨基丁酸具有协同释放作用机制,甘氨酸是痉挛状态产生的重要影响因素。研究发现[1820],Glu至少兴奋N甲基D天门冬氨酸等5种受体,受体激活后引起神经元迅速又持久的兴奋效应,从而引起肢体痉挛状态;GABA可通过GABAB受体结合,抑制Ca2+流入前突触,并抑制兴奋性神经递质从而缓解肌痉挛。同时,GABA是负责Iα传导纤维通过脊髓中间神经元,对突触起到抑制性作用[16]。有报道显示[21],局灶性脑缺血28 d后,由于抑制性中间神经元的选择性死亡及轴索消失,缺血梗死灶部位GABA受体的2种亚型A,B介导的抑制效应分别降低了47%,37%。亦有文献报道显示[22],脑缺血时,由于Glu暴发性释放,其受体大量激活,突触后神经元过度产生兴奋、溃变,最后导致神经元的死亡,产生了神经毒性。对抗兴奋性损伤的治疗包括减少突触前膜氨基酸的释放以及抑制突触后膜氨基酸受体的激活,而这其中对于阻断突触后膜NMDA受体的激活尤为重要[23]。Zepeda等[24]报道,脑缺血后产生的细胞蛋白、NMDA受体及GABA受体表达的异常改变是由于兴奋性和抑制性信号系统失衡而产生的一种功能性改变。而现代解痉常用药巴氯酚属于GABA受体激动剂,其主要作用于突触前GABAB受体,能够抑制兴奋性氨基酸受体的释放,缓解神经细胞兴奋性,从而缓解痉挛,有学者研究发现[25]脑缺血5 min后给予GABA受体激动剂巴氯酚具有神经保护作用,但对于巴氯酚的其他作用机制还未明确。
中医学认为中枢性肌张力增高的基本病机主要为阴阳失调,气血逆乱,其病理多属于本虚标实。气血衰少,肝肾阴虚为其致病之本,风、火、痰、气、瘀为其发病之标,两者可互为因果。人体的阴阳处于不断消长平衡的状态,如果某一方出现偏盛或偏衰就成了一种病理状态。正常情况下,刚柔相济,阳刚阴柔,内外阴阳平衡,则人体处于健康状态,肢体运动功能正常。在卒中状态下,人体肝肾阴津匮乏,则肝阳上亢,风中于脑,则发为中风,阴精亏虚,肢体筋脉得不到濡养,则筋脉挛急,产生痉挛状态。所以对卒中后痉挛状态的治疗,当以平调阴阳为本。芍药甘草汤作为解痉止痛的经典方剂,可酸甘化阴,使筋脉得到阴津濡润,则挛急诸证皆平。但是其作用机制研究还不够深入,现代研究多为芍药与甘草的单体成分,李冬梅等[26]研究发现芍药苷能够明显降低脑缺血再灌注沙土鼠脑内兴奋性氨基酸水平,王景霞等[27]研究发现芍药苷能够显著降低抑郁症大鼠脑内谷氨酸的含量,对于芍药甘草配伍对脑损伤的保护作用及其解痉机制还未明确。本实验结果再次验证了芍药甘草汤缓解中枢性痉挛、降低肌张力的疗效,同时脑内氨基酸含量及其受体表达测定结果表明,芍药甘草汤能够显著性升高模型大鼠脑内抑制性氨基酸GABA,Gly的含量水平,对于兴奋性氨基酸Glu,Asp的含量有降低趋势,能显著增加GABA受体Aα1,B蛋白表达,减少NMDA受体NR1,NR2A,NR2B蛋白表达。
本实验研究表明,脑卒中大鼠脑内不同氨基酸含量以及相应受体的异常表达可能是导致痉挛状态的重要因素。芍药甘草汤既能增加抑制性氨基酸GABA,Gly的含量,又能激活GABA受体Aα1和B,促进γ氨基丁酸与其受体的结合,使得GABA神经信号传导加强,抑制性神经信号占主导地位;同时芍药甘草汤虽然对兴奋性氨基酸Glu,Asp的含量没有明显影响,但却可以抑制谷氨酸的离子型受体NMDAR1,NMDAR2A,NMDAR2B的表达,减少谷氨酸与其受体的结合,从而抑制Glu神经信号的传导,兴奋性神经信号受到抑制。按照中医对物质阴阳属性的划分,大脑中枢抑制性神经递质属“阴”,而兴奋性神经递质属“阳”。正常情况下兴奋性神经递质和抑制性神经递质处于一个动态平衡中,即“阴平阳秘”。脑卒中后由于中枢神经受损引致抑制性神经递质不能制约兴奋性神经递质,即“阴不制阳”,从而导致兴奋性神经递质的过度释放,即“阳亢无制”,引起骨骼肌的张力增高,呈痉挛状态。芍药甘草配伍可通过“酸甘化阴”功能,滋阴制阳,即调节大脑中枢抑制性和兴奋性神经递质系统,达到“柔筋止痉”的作用,即缓解脑卒中后的肢体痉挛状态。综合来看,芍药甘草汤可以调节抑制性和兴奋性能神经的平衡,但以增强抑制性神经通路为主,这与巴氯酚对GABABR的单向激活作用是不同的,可能与芍药甘草汤成分复杂,具有多项调节功能有关。
[参考文献]
[1]张秋香 芍药甘草汤合血府逐瘀汤加减治疗中风后痉挛性瘫痪35例临床观察[J] 河北中医,2012,34(5):690
[2]张颖,杨坚,高宁沁 芍药甘草汤结合运动疗法治疗脑卒中后肘关节屈曲痉挛的临床研究[J] 上海中医药杂志,2012,46(11):47
[3]刘超 芍药甘草汤治疗中风后肢体痉挛症[J] 中国医药导刊,2011,13(8):1352
[4]杨旭,王景霞,张建军,等 芍药甘草汤对中枢性肌张力增高大鼠解痉止痛最佳配比的筛选研究[J] 北京中医药大学学报,2015,38(1):33
[5]陈乐乐,岳增辉,朱小姗 大鼠脑卒中痉挛性瘫痪模型制备方法研究[J] 上海中医药大学学报,2012,26(2):75
[6]Bohannon R W,Smith M B Interrater reliability of a modified ashworth scale of muscle spasticity[J] Phys Ther,1987,67:206
[7]杨慎峭,朱天民,金荣疆,等 康复训练结合电针对脑卒中肢体痉挛大鼠γ氨基丁酸能中间神经元表达的影响[J] 中医康复医学杂志,2013,28(3):198
[8]陈党红 舒筋颗粒对脑卒中后肌张力增高大鼠神经行为学及痛阈的影响[J] 安徽中医学院学报,2009,28(1):44
[9]胡学英 浅谈偏瘫肢体肌肉痉挛的运动疗法治疗[J] 继续医学教育,2011,25(5):68
[10]岳增辉,袁建菱,姜京明 经筋论治脑卒中后痉挛状态及对脑脊液Glu、GABA的影响[J] 中国针灸,2004,24(8):565
[11]倪克锋,葛芳,包烨华 脑卒中后肌张力增高的机制研究[C] 嘉兴:2008年浙江省物理医学与康复学术年会,2008
[12]公维军,张通,孙新亭 脑卒中后痉挛性偏瘫的研究现状[J] 中国康复理论与实践,2008,14(3):212
[13]Yezierski Robert P Spinal cord injury pain: spinal and supraspinal mechanisms[J]J Rehabil Res Dev,2009,46(1):95
[14]杨远滨,金爽 痉挛状态与疼痛[J] 中国康复医学杂志,2011,26(3):292
[15]Rietman J S, Geertzen J H Efficacy of intrathecal baclofen delivery in the management of severe spasticity in upper motor neuron syndrome[J] Acta Neurochir suppl, 2007,97 (1):205
[16]羊继平,张锡庆,王晓东, 等 痉挛型脑瘫患儿脑脊液兴奋性、抑制性氨基酸的研究[J]中华小儿外科杂志,1998,19(5):282
[17]周鸿铭,雷娜,鲁亚平 甘氨酸神经递质研究进展[J] 生物学杂志,2011,28(1):79
[18]陈小飞,王永安 氨基酸及其受体在脑缺血中的作用及相关药物应用[J] 中国药物应用与监测,2010,7(2):116
[19]Zhou Cui, Li Chong, Yu Hongmin,et al Neuroprotection of gammaaminobutyric acid receptor agonists via enhancing neuronal nitric oxide synthase (Ser847) phosphorylation through increased neuronal nitric oxide synthase and PSD95 interaction and inhibited protein phosphatase activity in cerebral ischemia[J] J Neurosci Res,2008,86(13):2973
[20]Gladding Clare M,Raymond Lynn A Mechanisms underlying NMDA receptor synaptic/extrasynaptic distribution and function[J] Mol Cell Neurosci,2011,48(4):308
[21]Mittmann T, Qü M, Zilles K, et al Long term cellular dysfunction after focal cerebral isehemic: in vitro analyses[J] Neuroscience,1998,85(1):15
[22]Fukui M, Song J H, Choi J, et al Mechanism of glutamate induced neurotoxicity in HT22 mouse hippocampal cells[J] Eur J Pharmacol,2009,617(1/3):1
[23]陈虎,蔡定芳,沈思钰,等 电针对局灶性脑缺血大鼠海马兴奋性氨基酸受体的影响[J]上海针灸杂志,2003,22(5):13
[24]Zepeda A, Sengpiel F, Guagnelli M A, et al Functional reorganization of visual cortex maps after ischemic lesions is accompanied by changes in expression of cytoskeletal proteins and NMDA and GABAA receptor subunits[J] J Neurosci,2004,24(8):1812
[25]Friedman C J, Lyden P D, Nanez S, et al High dose baclofen is neuroprotective but also causes intracerebral hemorrhage:a quantal bioassay study using the intraluminal suture occulsion method[J]Exp Neurol,1997,147:346
[26]李冬梅,车薇,李霞,等芍药苷对脑缺血再灌注沙土鼠ATP酶和兴奋性氨基酸的影响[J]中国药物警戒,2014,11(12):717
[27]王景霞,张建军,屈胜胜,等芍药苷对血虚肝郁证候模型大鼠海马 CA3 区组织形态及一氧化氮通路的影响[J]北京中医药大学学报,2015,38(2):85
[责任编辑马超一]
