运动发酵单胞菌发酵苹果渣产乙醇工艺研究
2016-05-10史政豪龚国利
李 慧, 史政豪, 龚国利, 李 灏
(1.陕西科技大学 设计与艺术学院, 陕西 西安 710021; 2.陕西科技大学 食品与生物工程学院, 陕西 西安 710021; 3.北京化工大学 生命科学与技术学院, 北京 100029)
运动发酵单胞菌发酵苹果渣产乙醇工艺研究
李 慧1, 史政豪2, 龚国利2, 李 灏3
(1.陕西科技大学 设计与艺术学院, 陕西 西安 710021; 2.陕西科技大学 食品与生物工程学院, 陕西 西安 710021; 3.北京化工大学 生命科学与技术学院, 北京 100029)
以运动发酵单胞菌为发酵菌株、干苹果渣为原料发酵生产乙醇,通过单因素和正交试验,确定糖化过程中酸解时间20 min、果胶酶和纤维素酶的用量分别为0.3%和0.9%、最适宜的酶解时间为6 h;发酵过程中发酵液的最适pH为5.0、最适温度为28 ℃、菌种接种量为5%(体积比),依此糖化和发酵条件得到的乙醇产率为160.6 mL/kg.
运动发酵单胞菌; 苹果渣; 乙醇; 发酵工艺
0 引言
目前,中国是世界上最大的苹果生产国和消费国,苹果的种植面积在3 850万亩以上,总产量已达4 000万吨以上,所占比例均居世界首位[1].苹果产量的不断增加促进了苹果加工业的发展,也同时产生了更多的工业废弃物——苹果渣.苹果渣中富含可溶性糖、维生素、矿物质及纤维素等营养物质,可以作为饲料和工业发酵的材料.国内研究较多的是从苹果渣中提取果胶、生产乙醇和柠檬酸、做培养基基质等,但这些研究均为能达到进行产业化生产的要求,苹果渣的利用依然是一个有待解决的问题[2,3].本文主要讨论了利用干苹果渣发酵生产乙醇的工艺条件,与以往研究不同的是,发酵所利用的菌株不是常用的酿酒酵母,而是可以发酵产乙醇的细菌——运动发酵单胞菌.与酵母相比,相对传统乙醇发酵的酵母菌而言,运动发酵单胞菌有其独特的、优越的性状特点,比如发酵乙醇代谢过程简单,发酵速度快、转化率高和耐受力强等[4-8],在工业运用方面具有潜在的应用价值(用于燃料乙醇、酶制剂以及酒类生产等)[9-12].虽然没有取代酵母菌用于大规模乙醇生产,但是在乙醇发酵生产方面具有巨大发展潜力[13-17].
1 材料和方法
1.1 实验材料
苹果渣,陕西科技大学食品与生物工程学院杨辉教授惠赠;菌种:运动发酵单胞菌ZM607,陕西科技大学食品与生物工程学院实验室分离保存;酶制剂:果胶酶、纤维素酶,购于江苏锐阳生物科技有限公司.
1.2 实验方法
1.2.1 苹果渣的预处理
(1)酸水解对苹果渣糖化效果的影响
准确称取5 g苹果渣若干份,每份加入100 mL蒸馏水,待充分吸水膨胀后,用3 mol/L的硫酸调pH至1.0,在121 ℃下进行20 min、40 min、60 min酸水解处理,测定还原糖的含量.
(2)单因素实验
①酶作用时间的影响.准确称取5 g苹果渣若干份,经酸水解处理后,调pH至4.5(用柠檬酸缓冲液调节),每份中都加入0.7%的纤维素酶和0.25%的果胶酶,于50 ℃分别水浴1 h、3 h、6 h、12 h,蒸馏水浸提,定容,测定还原糖的含量.
②酶解过程中pH的影响.准确称取5 g苹果渣若干份,经酸水解处理后,分别调pH至3.5、4.0、4.5、5.0、5.5(用柠檬酸缓冲液调节),分别加入0.7%的纤维素酶和0.25%的果胶酶,于50 ℃水浴适当时间,蒸馏水浸提,定容,测定还原糖的含量.
③酶解温度的影响.确称取5 g苹果渣若干份,经酸水解处理后,调pH至适合值,每份中都加入0.7%的纤维素酶和0.25%的果胶酶,分别于35 ℃、40 ℃、45 ℃、50 ℃、55 ℃下水浴适当时间,蒸馏水浸提,定容,测定还原糖的含量.
④果胶酶用量的影响.准确称取5 g苹果渣若干份,经酸水解处理后,调pH至适合值,分别加入0.1%、0.15%、0.2%、0.25%、0.3%(底物重量)的果胶酶,于50 ℃水浴适当时间,蒸馏水浸提,定容,测定还原糖的含量.
⑤纤维素酶用量的影响.准确称取5 g苹果渣若干份,经酸水解处理后,调pH至合适值,分别加入0.1%、0.3%、0.5%、0.7%、0.9%(底物重量)的纤维素酶,于50 ℃水浴适当时间,蒸馏水浸提,定容,测定还原糖的含量.
1.2.2 还原糖含量的测定
采用3,5-二硝基水杨酸比色法测定样品中还原糖的量.
(1)测定原理
主要是利用3,5-二硝基水杨酸的还原作用.还原糖和碱性的3,5-二硝基水杨酸一起共热,会产生一种棕红色的氨基化合物,在一定的浓度范围内,棕红色物质颜色的深浅程度与还原糖的量成正比,可用于比色测定.
(2)方法
准确称取在干燥箱中烘至恒重的无水葡萄糖2 g,溶解于适量蒸馏水中,定容至1 000 mL.分别准确移取0、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5 mL的葡萄糖标准液(2 g/L)于10 mL具塞试管中,再分别加入3 mL 3,5-二硝基水杨酸试剂,最后补充蒸馏水至10 mL,摇匀后,在沸水浴中加热5 min,取出后迅速用冷水冷却至室温,调540 nm测OD值,以1号管为对照,再以糖含量为横坐标,吸光度为纵坐标做标准曲线.
1.2.3 苹果渣糖化液发酵参数及其工艺研究
(1)菌种的活化
挑取实验室保存的运动发酵单胞菌,加入到液体培养基中,于30 ℃下活化24 h,摇匀,备用.
(2)发酵参数及工艺的确定
①发酵体系初始pH的确定.取经过糖化处理的苹果渣糖化液若干份,将其灭菌冷却后用柠檬酸缓冲液调节pH,使pH值分别为3.0、4.0、5.0,按5%接入活化好的菌液,置于恒温培养箱中,30 ℃发酵4 d后测其乙醇含量.
②菌种接种量的确定.取经过糖化处理的苹果渣糖化液若干份,将其灭菌冷却后用柠檬酸缓冲液调节pH,调pH至合适值,再接入活化好的菌液,接种量分别为1%、5%、9%,置于恒温培养箱中,30 ℃发酵4 d后测其乙醇含量.
③发酵温度的确定.取经过糖化处理的苹果渣糖化液若干份,将其灭菌冷却后用柠檬酸缓冲液调节pH,调pH至合适值,再接入适量活化好的菌液,置于温度分别为25 ℃、30 ℃、35 ℃的恒温培养箱内发酵4 d时终止.
④发酵周期的确定.取经过糖化处理的苹果渣糖化液若干份,将其灭菌冷却后用柠檬酸缓冲液调节pH,调pH至合适值,再接入适量活化好的菌液,置于30 ℃的培养箱,分别发酵1 d、2 d、3 d、4 d.
(3)乙醇含量的测定
将发酵好的苹果渣使用蒸馏装置进行减压蒸馏,测定其乙醇的含量.测定乙醇含量的方法采取重铬酸钾比色法,并将其换算成每1 kg干苹果渣生成的乙醇量.
2 结果与讨论
2.1 还原糖含量测定的标准曲线
采用3,5-二硝基水杨酸比色法测定样品中还原糖的量.以糖含量为横坐标,吸光度为纵坐标,制作了还原糖含量测定的标准曲线,如图1所示.

图1 还原糖含量测定标准曲线
2.2 酸水解对苹果渣还原糖含量的影响
酸水解对苹果渣还原糖含量的影响如表1所示.由表1可以看出,当pH=1,T=121 ℃时,与CK相比,酸解后苹果渣中还原糖的含量都显著增加,增加率分别为142.8%、156.7%和161.6%.还可以看出,随着酸解时间的增加,还原糖的含量也增加,但增加的幅度较小,酸解时间过长可能会导致苹果渣其他成分的水解和一些营养成分的破坏.综合考虑,酸水解时间以20 min为宜.

表1 酸处理对苹果渣还原糖含量的影响
2.3 酶用量和酶解时间对还原糖含量的影响
苹果渣中含有不溶性的糖,如纤维素、果胶等,用纤维素酶、果胶酶处理苹果渣,能够很有效的将它们转化为可发酵性糖,同时提高了苹果渣发酵产乙醇的产率.而酶的添加量和作用时间都会影响到糖化效果,酶解时间对还原糖含量的影响如图2所示,果胶酶添加量对还原糖含量的影响如图3所示,纤维素酶添加量对还原糖含量的影响如图4所示.
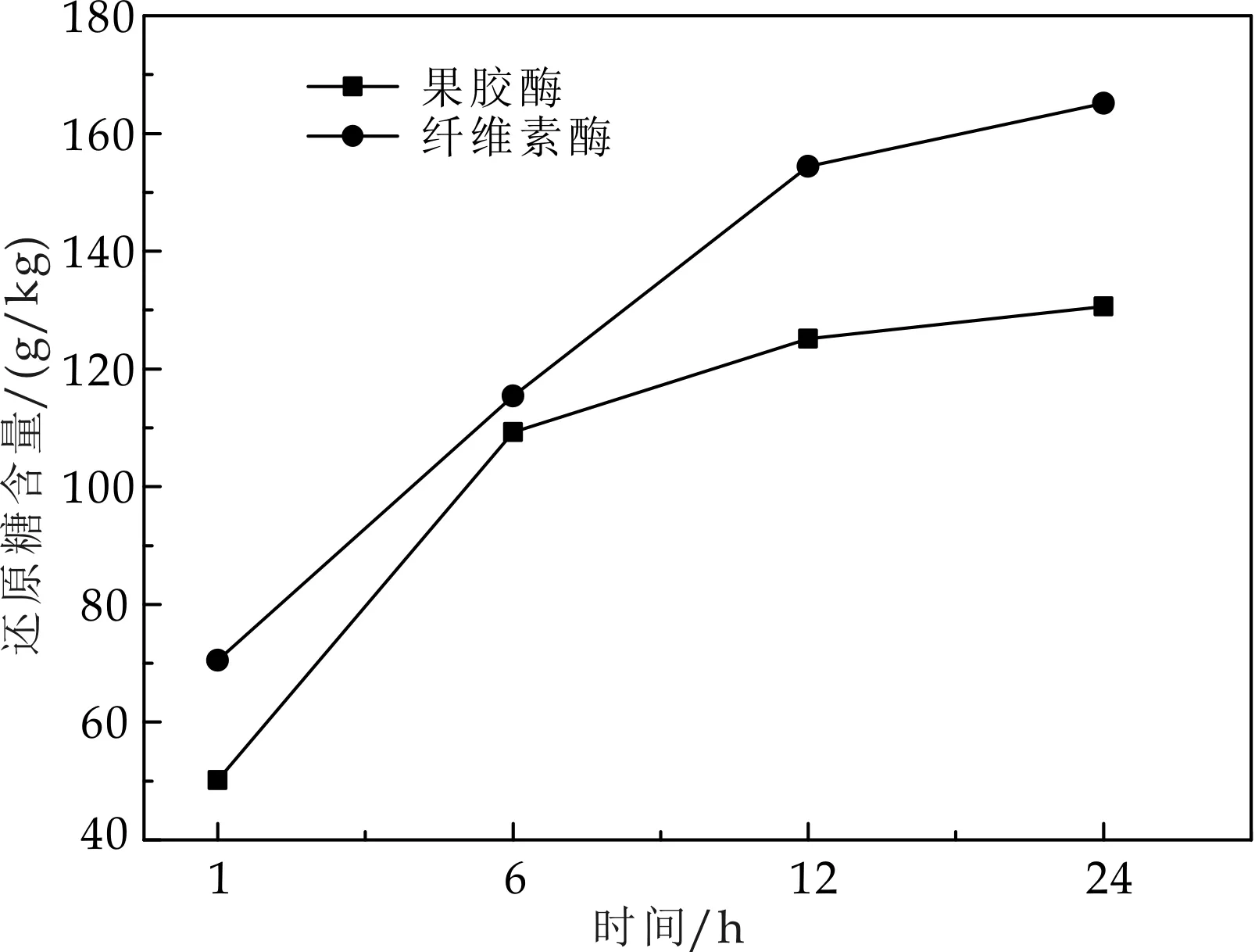
图2 酶作用时间对还原糖含量的影响

图3 果胶酶添加量对还原糖含量的影响

图4 纤维素酶添加量对还原糖含量的影响
由图2可以看出,酶解12 h和24 h还原糖的量变化较小,考虑到生产成本,选择酶解12 h为宜;由图3~4可以看出,当果胶酶、纤维素酶的添加量为0.25%、0.75%时,还原糖的含量最高,分别为137.7 g/kg苹果渣、164.1 g/kg苹果渣.
2.4 酶作用pH和作用温度对还原糖含量的影响
不同的作用pH和温度,会对酶的活性引起一定的变化,从而影响到糖化的效果,并最终影响还原糖的生成,其结果如图5、6所示.

图5 pH对还原糖含量的影响

图6 温度对还原糖含量的影响
从图5可以看出,pH为4.5左右时还原糖的含量最高,当pH继续升高时,还原糖的量反而会下降,可能是较高的pH破坏了酶的功能结构,使酶活有一定的下降;从图6可以看出,随着温度的不断升高,还原糖的含量先升高后下降,在50 ℃左右达到最大.
2.5 苹果渣酶解条件的正交优化
果胶酶添加量、纤维素酶添加量、pH、温度的L9(34)的正交试验设计及试验结果如表2所示.

表2 L9(34)正交试验及结果
由表2的极差值可知,影响酶解效果的诸因素的主次顺序:D>A>C>B,即酶解pH对还原糖含量的影响最大,其次是果胶酶添加量和温度.从节约能源和控制成本来看,最终选择的工艺组合为A3B3C1D2,通过此酶解,得到还原糖为307.1 g/kg.
2.6 发酵工艺的确定
2.6.1 发酵体系pH值的确定
发酵液的pH不仅对微生物的生长有很大的影响,同时也影响发酵过程中酶的活性.采用柠檬酸缓冲液调节pH,发酵体系pH对乙醇含量的影响,如图7所示.由图7可知,当发酵体系pH为5时,乙醇产率最大.

图7 发酵体系pH对乙醇产率的影响
2.6.2 发酵温度的确定
温度对运动发酵单胞菌的影响很大,温度的变化会明显的影响它的生长繁殖.发酵温度对乙醇产率的影响,如图8所示.由图8可知,发酵温度为30 ℃时,乙醇的产率最高.

图8 发酵温度对乙醇产率的影响
2.6.3 接种量对乙醇产率的影响
运动发酵单胞菌的接种量也会影响到乙醇产率的高低,合适的接种量会提高乙醇的产率.若接种量小,则发酵速度变慢,发酵周期变长;若接种量大,则发酵速度快,但接种量过大,会导致营养物质过多的用于菌体的生长,不利于乙醇的发酵.接种量对乙醇产率的影响,如图9所示.由图9可知,当接种量为5%时,乙醇产率最高.
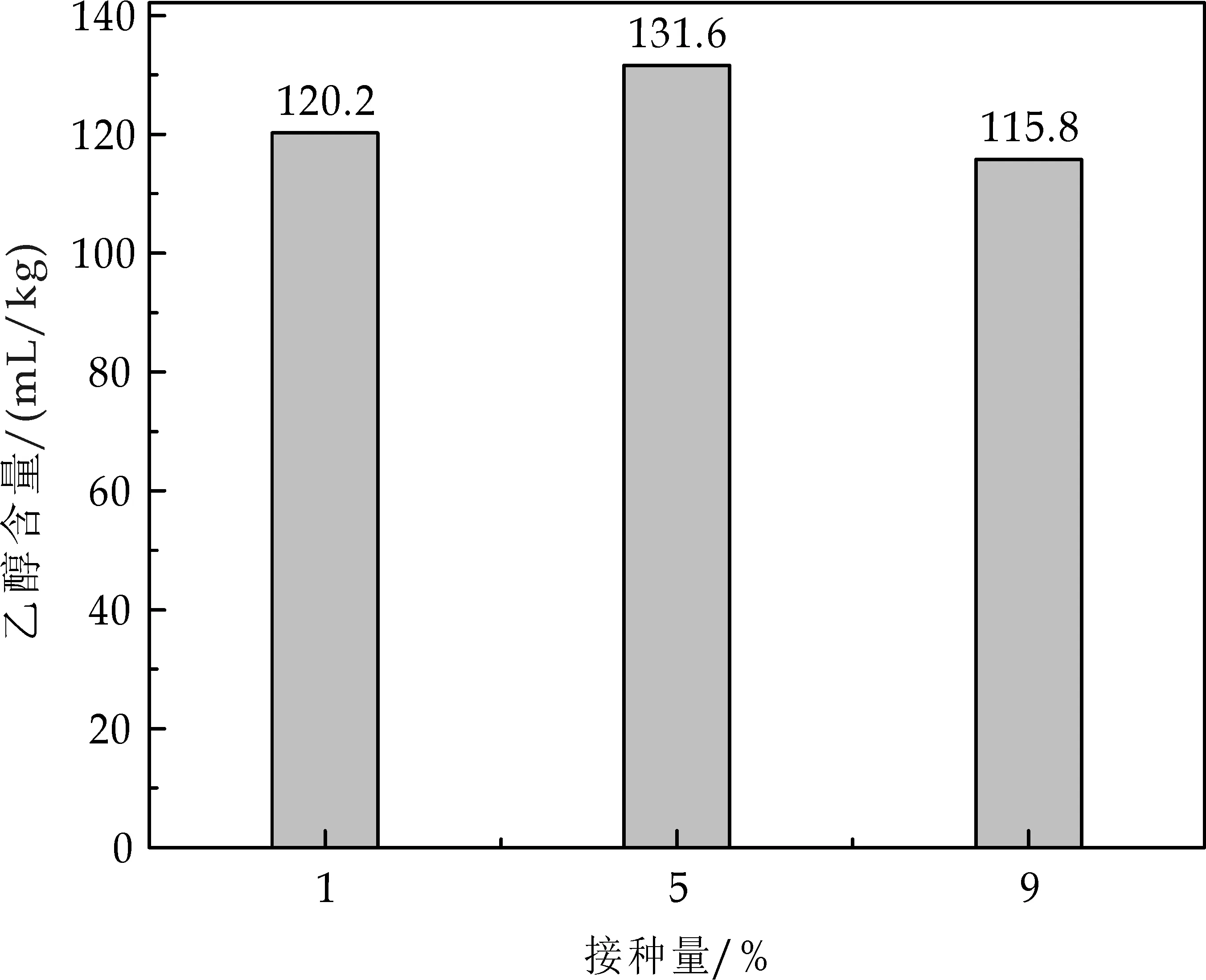
图9 接种量对乙醇产率的影响
2.6.4 发酵周期对乙醇产率的影响
发酵周期对乙醇产率的影响如图10所示.从图10可以看出,乙醇的产率随着发酵周期的延长而增加,发酵到第4天时,乙醇的增加相比第三天而言,增加不是很明显,故选择发酵周期为3天.由此可知,运动发酵单胞菌与酵母菌相比,发酵生产乙醇的周期比较短.

图10 发酵周期对乙醇产率的影响
2.6.5 发酵条件正交试验优化
以单因素结果为实验依据,拟定正交试验表如表3所示,并以乙醇产率为指标对试验数据进行极差分析,从而得到最优的发酵条件,发酵正交试验如表4所示.
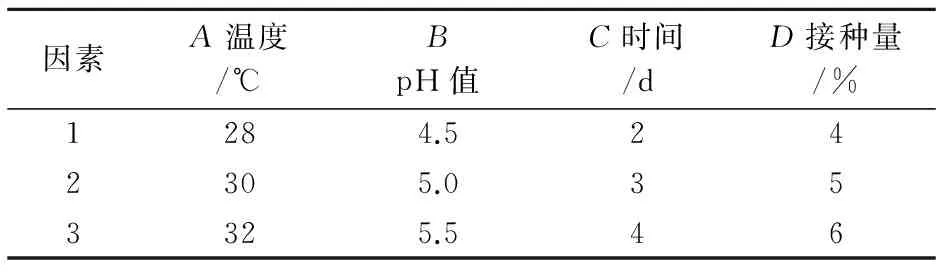
表3 发酵工艺参数因素水平

表4 发酵工艺的正交试验优化
由表4可以看出,最佳的发酵工艺为A1B2C2D2,即发酵温度为28 ℃,发酵液pH为5.0,发酵周期为3 d,接种量为5%,乙醇的含量为156.8 mL/kg.对实验结果进行极差分析可知,RB>RA>RC>RD,即所选取的四个影响因素对乙醇产率影响主次顺序为:发酵液初始pH>温度>发酵周期>接种量,说明发酵培养基的初始pH值对乙醇产量的影响最大,发酵温度影响次之,发酵周期第三,接种量影响最小.
3 结论
运动发酵单胞菌ZM607发酵苹果渣生产乙醇的最佳酸解糖化工艺条件为pH值1.0、温度121 ℃、酸处理时间20 min;酶解糖化工艺为果胶酶添加量0.3%、纤维素酶添加量0.9%、酶作用时间6 h;最佳发酵工艺为发酵初始pH 5.0,发酵温度28 ℃,接种量5%.采用最佳的糖化工艺和发酵工艺,乙醇的产率可以达到160.6 mL/kg.综上所述,可以利用运动发酵单胞菌发酵废弃苹果渣生产燃料乙醇.
[1] 陈学森,韩明玉,苏桂林,等.当今世界苹果产业发展趋势及我国苹果产业优质高效发展意见[J].果树学报,2010,27(4):598-604.
[2] 翟 衡,史大川,束怀瑞.我国苹果产业发展现状与趋势[J].果树学报,2007,24(3):355-360.
[3] 翟 衡,赵政阳,王志强,等.世界苹果产业发展趋势分析[J].果树学报,2005,22(1):44-50.
[4] Todhanakasem T,Tiwari R,Thanonkeo P.Development of corn silk as a biocarrier forZymomonasmobilisbiofilms in ethanol production from rice straw[J].J.Gen Appl Microbiol,2016,62(2):68-74.
[5] 车勇平.运动发酵单胞菌产乙醇的研究[D].厦门:厦门大学,2008.
[6] Schell D J,Dowe N,Chapeaux A,et al.Accounting for all sugars produced during integrated production of ethanol from lignocellulosic biomass[J]. Bioresour Technol,2016,205:153-158.
[7] Seo J S,Chong H.The genome sequence of the ethanologenic bacteriumZymomonasmobilisZM4[J].Nat Biotechnol,2005,23:63-68.
[8] Zhang M,Eddy C,Deanda K,et al.Metabolic engineering of a pentose metabolism pathwayin ethanologenicZymomonasmobilis[J].Science,1995(267):240-243.
[9] Ma K,Ruan Z,Shui Z,et al.Open fermentative production of fuel ethanol from food waste by an acid-tolerant mutant strain ofZymomonasmobilis[J].Bioresour Technol,2016,203:295-302.
[10] Cavalcanti D R,Malafaia C B,Silva T D,et al.Protein extraction method for the proteomic study ofZymomonasmobilisduring production of ethanol[J].Genet Mol Res,2015,14(4):14 406-14 421.
[11] Rogers P L,Jeon Y J,Lee K J,et al.Zymomonasmobilisfor fuel ethanol and higher value products[J].Adv Biochem Eng Bioteclinol,2007(108):263-288.
[12] Silva L C,Araújo J M,Azevedo J L,et al.Genetic variability analysis ofZymomonasmobilisstrains from the UFPEDA microorganisms collection[J].Genet Mol Res,2015,14(1):805-814.
[13] Kremer T A,LaSarre B,Posto A L,et al.N2gas is an effective fertilizer for bioethanol production byZymomonasmobilis[J].Proc Natl Acad Sci USA,2015,112(7):2 222-2 226.
[14] Zhang K,Shao H,Cao Q,et al.Transcriptional analysis of adaptation to high glucose concentrations inZymomonasmobilis[J].Appl Microbiol Biotechnol,2015,99(4):2 009-2 022.
[15] Yang S,Franden M A,Brown S D,et al.Insights into acetate toxicity inZymomonasmobilis8b using different substrates[J].Biotechnol Biofuels,2014,7(1):140.
[16] Tozakidis I E,Sichwart S,Teese M G,et al.Autotransporter mediated esterase display onZymomonasmobilisand zymobacter palmae[J].J Biotechnol, 2014,191:228-235.
[17] Hunter W J,Manter D K.Pre-treatment step with leuconostoc mesenteroides or L.pseudomesenteroides strains removes furfural fromZymomonasmobilisethanolic fermentation broth[J].Bioresour Technol,2014,169:162-168.
【责任编辑:蒋亚儒】
Study on producing ethanol ofZymomonasmobileusing apple pomace
LI Hui1, SHI Zheng-hao2, GONG Guo-li2, LI Hao3
(1.College of Art and Design, Shaanxi University of Science & Technology, Xi′an 710021, China; 2.School of Food and Biological Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China; 3.School of Life Science and Technology, Beijing University of Chemical Technology, Beijing 100029, China)
Ethanol was produced byZymomonasmobileusing dry apple pomace as raw material.The fermentation pamameters were optimized by single factor and orthogonal experiment.The optimal process parameters were that,acid hydrolysis of saccharification process time was 20 min,pectinase and cellulase amount was 0.3% and 0.9%,the hydrolysis time was 6 h,optimum pH during the fermentation broth was 5.0,the optimum temperature is 28 ℃,inoculation amount of 5% (by volume).The yield of ethanol on the optimal conditons 160.6 mL/kg.
Zymomonasmobile; apple pomace; ethanol; fermentation technology
2016-06-11
陕西省科技厅社会发展科技攻关计划项目(2010K01-200); 陕西省教育厅自然科学专项科研计划项目(14JK1101)
李 慧(1976-),女,内蒙古四子王旗人,副教授,研究方向:食品生物技术
1000-5811(2016)05-0123-06
TS201.1
A
