VSVG/HIV-1NL4-3Luc假病毒筛选抗HIV-1药物的条件优化及应用
2016-05-10罗荣华张高红郑永唐
王 萍,陈 欢,罗荣华,卿 晨,张高红,郑永唐
(1.昆明医科大学药学院暨云南省天然药物药理重点实验室,云南昆明 650500;2.中国科学院昆明动物研究所,中国科学院和云南省动物模型与人类疾病机理重点实验室,云南昆明 650223;3.中国科学院大学,北京 100039)
VSVG/HIV-1NL4-3Luc假病毒筛选抗HIV-1药物的条件优化及应用
王 萍1,2,陈 欢2,3,罗荣华2,卿 晨1,张高红2,郑永唐2
(1.昆明医科大学药学院暨云南省天然药物药理重点实验室,云南昆明 650500;2.中国科学院昆明动物研究所,中国科学院和云南省动物模型与人类疾病机理重点实验室,云南昆明 650223;3.中国科学院大学,北京 100039)
目的 建立并优化VSVG/HIV-1NL4-3Luc假病毒筛选抗HIV药物药效模型。方法 参照Promega 公司的荧光素酶活性分析系统,比较VSVG/HIV-1NL4-3Luc对4种不同细胞的感染力。通过采用3种不同实验条件对不同类型HIV-1上市药物进行活性评价,进一步验证了该模型的可行性与有效性。最后,应用该系统对特定靶点化合物进行筛选,并与HIV-1ⅢB病毒筛选体系所得结果进行比较。结果 VSVG/HIV-1NL4-3Luc对CRFK细胞的感染力最强,报告基因的表达水平与加入的病毒量呈剂量依赖关系。比较3种实验条件下不同阳性药物抑制VSVG/HIV-1NL4-3Luc的半数有效剂量浓度EC50,发现第3种条件最优。而用该假病毒对合成化合物进行筛选,发现其EC50与病毒HIV-1ⅢB所得EC50基本一致。结论 成功建立并优化了基于VSVG/HIV-1NL4-3Luc假病毒的抗HIV药物筛选系统。
VSVG/HIV-1NL4-3Luc,HIV,药物筛选,阳性药物,优化,应用
自1987年第1个抗HIV药物齐多夫定(zidovudine,AZT)获得美国FDA的批准上市以来,经过30多年的不懈努力,目前总共有28种抗HIV单体药物获批上市[1-2]。根据作用机制的不同,抗HIV药物可以分为6个经典类型,包括核苷类逆转录酶抑制剂(nucleoside reverse transcriptase in-hibitors,NRTIs)、非核苷类逆转录酶抑制剂(non-nucleoside reverse transcriptase inhibitors,NNRTIs)、蛋白酶抑制剂(pro-tease inhibitors,PIs)、融合抑制剂(fusion inhibitors,FIs)、辅助受体抑制剂(coreceptor inhibitors,CRIs)和整合酶抑制剂(integrase strand transfer inhibitors,INIs)[3-6]。
传统筛选抗HIV药物的方法是使用活病毒检测抗HIV活性[7],其操作流程复杂,工作量大,鉴于HIV病毒的高危害性,实验条件要求较高,需在3级生物安全实验室中进行,且易发生职业暴露,操作人员有一定的风险。因此,寻求一种替代活病毒的方法来进行抗HIV药物筛选和研究势在必行。假病毒技术就是在这样的背景下应运而生的,与活病毒相比,假病毒具有更高的生物安全性、宿主嗜性广、滴度高及稳定性强等优点[8-9],已广泛应用于疫苗研发[10]、病毒与宿主细胞之间的相互作用[11]、病毒敏感细胞的筛选[12]、抗病毒药物筛选[13-16]、中和抗体研究[17]等多个方面。
HIV-1假病毒感染细胞系统是指通过使用HIV-1假病毒感染易感细胞来模拟病毒的感染及复制过程,并以此进行HIV-1相关研究的系统[18]。通常通过选择合适的易感细胞和引入灵敏度高且易于检测的报告基因等方法来对系统进行优化。目前被广泛应用于HIV研究的假病毒主要有VS-VG/HIVΔenv和HIV ENV/HIVΔenv两类[19]。本文将表达水疱性口膜炎病毒包膜糖蛋白的质粒(pCMV-VSVG)与HIV-1骨架质粒(pNL4-3 Luc R-E-)[20]共转染293T细胞后获得了VSVG/HIVΔenv假病毒[21](Fig 1),其能感染不同类型的细胞,具有广泛的宿主细胞谱。该假病毒因为缺失了HIV必需的env基因、vpr基因和nef基因,无法包装出新病毒,只能进行单轮复制[22-23],具有较高的安全性,可在2级生物安全实验室进行操作。此外,在nef缺失的位置引入荧光素酶报告基因(Luciferase,Luc),为检测HIV-1假病毒在细胞内的复制水平提供了一条快速灵敏的途径。
我们对VSVG/HIV-1NL4-3Luc在不同细胞中的感染能力进行了比较,并设计了3种实验条件来检测各种类型阳性药物对VSVG/HIV-1NL4-3Luc的抑制作用,旨在优化该假病毒模型体系。将优化后的系统用于针对不同靶点合成的化合物筛选,并与活病毒HIV-1ⅢB所得结果进行比较,发现两者的EC50基本一致,说明VSVG/HIV-1NL4-3Luc是一个安全、有效地抗HIV-1药物筛选模型。
1 材料与方法
1.1 细胞、质粒和化合物 人胚肾细胞(293T)、人宫颈癌细胞(HeLa)和猫肾细胞(CRFK)均购自中国科学院上海生命科学研究院细胞资源中心,非洲绿猴肾细胞(Vero)购自ATCC,人白血病T淋巴细胞(C8166)和病毒HIV-1ⅢB均由英国MRC,AIDS Reagent Project惠赠;质粒pCMV-VSVG和pNL4-3 Luc R-E-均为中国科学院生物物理所高光侠研究员惠赠,按照康为世纪离心柱法提取质粒试剂盒进行大提后,测得浓度分别为pCMV-VSVG(276 mg·L-1),pNL4-3 Luc R-E-(768 mg·L-1);阳性药物:zidovudine(AZT,NR-TI)购自Sigma,nevirapine和efavirenz(NVP,EFV,NNRTI)购自U.S.P,Indinavir(IDV,PI)由昆明医科大学第一附属医院李玉叶博士惠赠,Enfuvirtide(T-20,FI)购自Roche Inc,Maravoric(MVC,CCR5I)和AMD3100(CXCR4I)购自Sigma,Raltegravir(RAL,INI)购自Selleck Chemicals。化合物DY系列为大连医科大学马晓东老师提供,FNC为郑州大学常俊标老师提供,A5为南开大学郭宇博士提供,均溶解于DMSO,4℃保存。
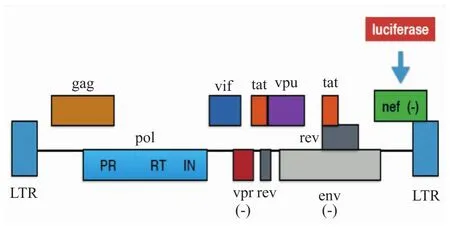
Fig 1 Schematics of pNL4-3 Luc R-E-
1.2 VSVG/HIV-1NL4-3Luc的制备 所用转染试剂为Lipo-fectamine 2000(Invitrogen)。转染前1 d,将293T细胞按细胞数1×107接种于10 cm培养皿中。24 h后,待细胞密度达到60%~80%时进行转染。转染步骤按照说明书进行操作,pNL4-3 Luc R-E-与pCMV-VSVG的浓度比为4∶1。转染4~6 h后,吸弃上清,用PBS清洗,并加入新鲜的培养基,置CO2培养箱中继续培养。48 h后,收集上清液,3 000 r· min-1离心5 min,用0.45 μm微孔滤膜过滤,分装,于-80℃保存。
1.3 细胞系的选择 本实验采用4株细胞(293T、HeLa、CRFK、Vero)进行假病毒感染效率的比较,接种细胞密度均为1×104/孔。
1.4 感染性检测 感染前1 d,将细胞接种到96孔板上,24 h后将VSVG/HIV-1NL4-3Luc假病毒以不同的浓度感染细胞。感染48 h后,PBS清洗,每孔加入细胞裂解液100 μL,裂解30 min,将荧光素酶底物与细胞裂解液按1∶1混合后采用Promega公司的荧光素酶活性分析系统对报告基因荧光素酶的活性进行分析[24]。
1.5 3种实验条件下阳性药物的检测 将不同类型阳性药物AZT、NVP、EFV、IDV、T-20、MVC、AMD3100、RAL在如下3种实验条件下进行检测,药物5倍稀释,共设6个梯度,每个梯度3个复孔,计算其EC50。所有条件均设加病毒的阳性对照孔(positive control,PC)和没有病毒的阴性对照孔(negative control,NC)。如Fig 2所示,3种方案均为96孔板先接种细胞24 h,经过药物与病毒的不同处理后,采取48 h为时间点测RLU值。

Fig 2 Flow chart of 3 experimental conditions
1.6 化合物筛选 对针对特定靶点合成的不同类型化合物用VSVG/HIV-1NL4-3Luc假病毒系统进行筛选,并与HIV-1ⅢB结果进行比较。
2 结果
2.1 VSVG/HIV-1NL4-3Luc可高效感染CRFK细胞 我们将假病毒感染4种细胞(293T、CRFK、HeLa和Vero)后,经3次独立重复实验,结果如Fig 3所示,CRFK能被VSVG/HIV-1NL4-3Luc高效感染,而293T、HeLa和Vero则感染率相对较低。所以之后的研究采用CRFK细胞。

Fig 3 VSVG/HIV-1NL4-3Luc infection efficiency on different cells(n=3)
2.2 被感染CRFK中Luc表达水平与加入病毒量呈剂量依赖关系 如Fig 4所示,加入不同稀释浓度的假病毒感染CRFK细胞48 h后,被感染细胞裂解液的荧光素酶活性水平与病毒的加入量呈剂量依赖关系。由此证明,被感染细胞中Luc的表达水平可以体现HIV-1的复制水平。经过3次独立重复实验,选择20倍稀释后的病毒用于之后的实验,其RLU值>10 000。
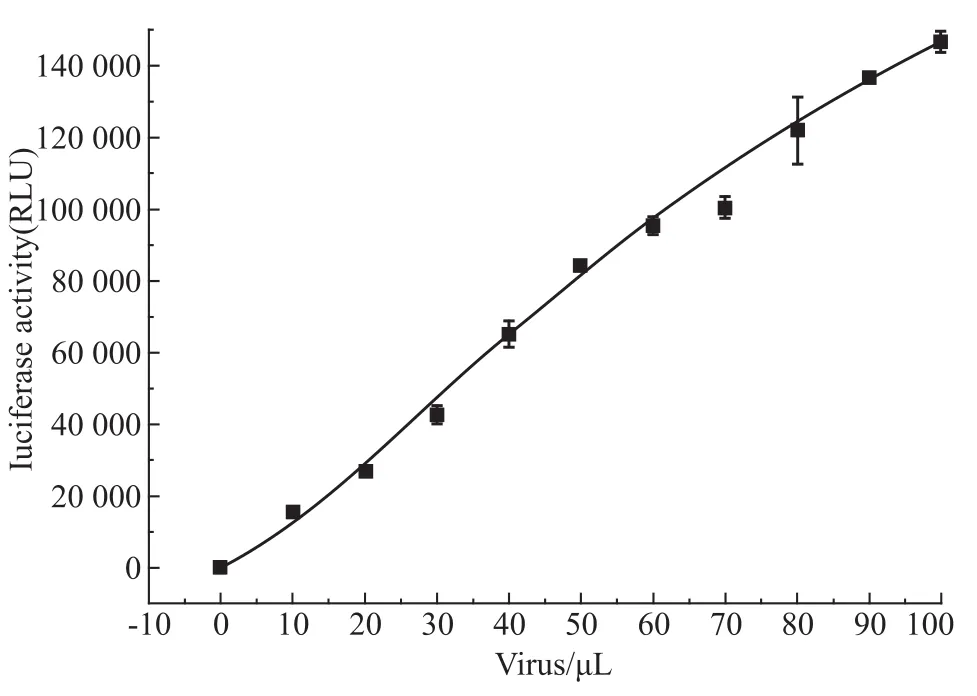
Fig 4 RLU under different VSVG/HIV-1NL4-3Luc concentrations(n=3)
2.3 3种不同实验条件下阳性药物对VSVG/HIV-1NL4-3Luc的抑制作用 在3种实验条件下检测各类型阳性药物对VSVG/HIV-1NL4-3Luc的抑制作用。AZT、EFV、NVP和RAL均表现出了较好的抗HIV-1活性,而MVC、T-20、IDV和AMD3100在浓度高达1 μmol·L-1也没有检测到其对假病毒的抑制活性(Tab 1),说明该系统能检测逆转录酶抑制剂和整合酶抑制剂,不能用于HIV-1进入抑制剂和蛋白酶抑制剂的筛选。AZT、EFV、NVP、RAL在3种实验条件下对VS-VG/HIV-1NL4-3Luc的抑制曲线如Fig 5所示,从图中可以看出,整体上第3种实验方案优于第1种和第2种,所以之后的实验采用第3种实验方案。

Tab 1 EC50of HIV-1 inhibitors against VSVG/HIV-1NL4-3Luc
2.4 VSVG/HIV-1NL4-3Luc筛选不同类型化合物 接下来我们利用建立的优化方法筛选了一批化合物,并对活性较好的样品采用实验室已有成熟的抗HIV药物活病毒筛选体系[7,25]进行实验验证,结果如Tab 2所示。比较VSVG/HIV-1NL4-3Luc(CRFK)体系与HIV-1ⅢB(C8166)体系所得各化合物的EC50,发现EC50值基本一致,因药物为5倍梯度稀释,其差值在可允许范围内。

Fig 5 Anti-HIV-1 drugs inhibit VSVG/HIV-1NL4-3Luc in 3 experimental conditions(n=3)

Tab 2 Comparison of EC50of anti-HIV-1 compounds between VSVG/HIV-1NL4-3Luc and HIV-1ⅢB
3 讨论
目前,抗HIV-1药物的体外筛选主要采用细胞和分子模型进行,构建一个稳定的HIV-1药物筛选模型,是药物研发中的关键环节。近年来,假病毒技术在抗HIV-1药物研发和治疗方面的应用有了很大发展[19,26-27]。由于HIV-1假病毒在细胞内复制的很多环节与活病毒相同,因此被越来越多地应用于抗HIV-1药物的筛选及药物抗病毒效果的评价[26,28]。已有不少研究者利用HIV-1假病毒,在细胞水平进行抗HIV-1药物的筛选和对患者体内HIV-1毒株进行耐药性分析,并且取得了较好的效果[21,29]。
对于含VSV外壳的假病毒来说,宿主范围很广,能感染VSV的细胞都能感染此类假病毒。很多文献[12,15]报道,VS-VG/HIV-1NL4-3Luc的宿主细胞可以是293T、HeLa、TZM-bl、A549、Jurkat C和Ghost等细胞。我们通过比较假病毒在293T、HeLa、Vero和CRFK 4种细胞上的感染性,发现CRFK 对VSVG/HIV-1NL4-3Luc最敏感,所以选择CRFK作为我们的宿主细胞。关于报告基因的选择,大多数假病毒系统都采用荧光素酶基因(Luciferase)或绿色荧光蛋白基因(GFP),如果选择带有GFP的质粒包装假病毒,结果需在荧光显微镜下或流式细胞仪上进行分析,费用较高,而带Luciferase的假病毒通过读值可以定量得到结果,方便高效。在筛选程序上,通过与传统的筛选方法进行比较,并用不同类型阳性药物进行验证,发现第3种方案最优。
本研究成功地包装出了VSVG/HIV-1NL4-3Luc假病毒,并对其各种实验条件进行了优化,建立了抗HIV-1药物假病毒筛选系统,与活病毒相比其具有较高的生物安全性,适用于普通实验室对于抗HIV-1药物研究的需求。在此模型中,不同稀释度的假病毒感染CRFK细胞后,荧光素酶的表达水平与病毒稀释度呈现明显的剂量依赖效应,可以灵敏快捷的体现HIV-1的复制水平,并以此来研究药物抑制试验,计算药物的半数有效浓度,其特点符合药理筛选模型的要求。而对各类型阳性药物进行检测后,表明该模型对筛选NNRTI、NRTI和INI具有可行性和有效性,但不能用于筛选蛋白酶抑制剂和进入抑制剂。不能检测进入抑制剂是由于假病毒采用了VSVG包膜,病毒采用不同于HIV的侵入机制进入细胞,不涉及HIV受体与辅助受体的参与及融合过程,因此该体系不适用HIV-1进入抑制剂的筛选。此外,假病毒中荧光素酶报告基因在病毒RNA转录后即进行表达,而病毒复制的晚期步骤,如病毒粒子的包装和出芽均发生在报告基因的表达之后,故通过检测报告基因的表达水平不能反映药物对病毒复制晚期步骤的抑制情况,所以该方法不适用于蛋白酶等晚期步骤的抑制剂的活性筛选。有文献报道[30],可以在包装病毒时即加入蛋白酶抑制剂进行活性筛选,该方法效果如何还有待进一步验证。
天然化合物具有结构多样性、毒副作用小、价格低廉等特点,目前具有抗HIV活性的化合物[25,31]不断被发现。VS-VG/HIV-1NL4-3Luc药物筛选方法的条件优化及应用对于筛选并进一步研发抗HIV-1药物具有重要的意义。该模型简单方便,但也存在不足之处,只能用于检测病毒侵入后的复制早期阶段,且转染效率容易受各方面条件的影响[32]。总之,VSVG/HIV-1NL4-3Luc假病毒药物筛选系统具有广泛的研究前景,特别是在用于筛选新的抗HIV化合物方面具有重要意义。随着假病毒体系的不断改良,相信其技术将越来越成熟,应用领域会越来越宽。
(致谢:本文实验在中国科学院昆明动物研究所分子免疫药理学实验室完成,在此对实验室成员的帮助与指导表示衷心的感谢!)
[1] 张兴权.抗HIV药物的最新研究进展[J].药学学报,2015,50 (5):509-15.
[1] Zhang X Q.The newest developments of the study on anti-HIV drugs[J].Acta Pharm Sin,2015,50(5):509-15.
[2] Pavlos R,Phillips E J.Individualization of antiretroviral therapy [J].Pharmgenomics Pers Med,2012,5:1-17.
[3] Sierra-Aragon S,Walter H.Targets for inhibition of HIV replica-tion:entry,enzyme action,release and maturation[J].Intervirolo-gy,2012,55(2):84-97.
[4] Este J A,Cihlar T.Current status and challenges of antiretroviral research and therapy[J].Antiviral Res,2010,85(1):25-33.
[5] De Clercq E.Anti-HIV drugs:25 compounds approved within 25 years after the discovery of HIV[J].Int J Antimicrob Agents,2009,33(4):307-20.
[6] De Clercq E.The nucleoside reverse transcriptase inhibitors,non-nucleoside reverse transcriptase inhibitors,and protease inhibitors in the treatment of HIV infections(AIDS)[J].Adv Pharmacol,2013,67:317-58.
[7] 郑永唐.抗HIV药物的体外筛选和研究方法[J].中国新药杂志,2002,11(8):596-600.
[7] Zheng Y T.In vitro screening and assays for anti-HIV agents[J].Chin New Drug J,2002,11(8):596-600.
[8] Nack U,Schnierle B S.Replacement of the murine leukemia virus (MLV)envelope gene with a truncated HIV envelope gene in MLV generates a virus with impaired replication capacity[J].Vi-rology,2003,315(1):209-16.
[9] Sanders D A.No false start for novel pseudotyped vectors[J].Curr Opin Biotechnol,2002,13(5):437-42.
[10]Schultz A,Koch S,Fuss M,et al.An Automated HIV-1 Env-pseudotyped virus production for global HIV vaccine trials[J].Plos One,2012,7(12):e51715.
[11]Raska M,Czernekova L,Moldoveanu Z,et al.Differential glyco-sylation of envelope gp120 is associated with differential recogni-tion of HIV-1 by virus-specific antibodies and cell infection[J].AIDS Res Ther,2014,11:23.
[12]Cheresiz S V,Grigoryev I V,Semenova E A,et al.A pseudovirus system for the testing of antiviral activity of compounds in different cell lines[J].Dokl Biochem Biophys,2010,435(1):295-8.
[13]Talekar A,Pessi A,Glickman F,et al.Rapid screening for entry inhibitors of highly pathogenic viruses under low-level biocontain-ment[J].Plos One,2012,7(3):e30538.
[14]Wu X,Mao Q Y,Yao X,et al.Development and Evaluation of a Pseudovirus-Luciferase Assay for Rapid and Quantitative Detection of Neutralizing Antibodies against Enterovirus 71[J].Plos One,2013,8(6):e64116.
[15]Rumschlag-Booms E,Zhang H,Soejarto D D,et al.Development of an antiviral screening protocol:one-stone-two-birds[J].J Anti-vir Antiretrovir,2011,3:8-10.
[16]Harrison A L,Henry S,Mahfoud R,et al.A novel VSV/HIV pseudotype approach for the study of HIV microbicides without re-quirement for level 3 biocontainment[J].Future Virology,2011,6 (10):1241-59.
[17]Hraber P,Korber B T,Lapedes A S,et al.Impact of clade,ge-ography,and age of the epidemic on HIV-1 neutralization by anti-bodies[J].J Virol,2014,89(21):12623-43.
[18]王 萍,张高红,郑永唐.基于假病毒筛选抗病毒药物的研究进展[J].国际药学研究杂志,2015,42(3):316-22.
[18]Wang P,Zhang G H,Zheng Y T.Antiviral drug screening based on pseudoviruses:research advance[J].J Int Pharm Res,2015,42 (3):316-22.
[19]Heyndrickx L,Vermoesen T,Vereecken K,et al.Antiviral com-pounds show enhanced activity in HIV-1 single cycle pseudovirus assays as compared to classical PBMC assays[J].J Virol Methods,2008,148(1-2):166-73.
[20]Petropoulos C J,Parkin N T,Limoli K L,et al.A novel pheno- typic drug susceptibility assay for human immunodeficiency virus type 1[J].Antimicrob Agents Chemother,2000,44(4):920-8.
[21]Garcia J M,Gao A,He P L,et al.High-throughput screening u-sing pseudotyped lentiviral particles:a strategy for the identifica-tion of HIV-1 inhibitors in a cell-based assay[J].Antiviral Res,2009,81(3):239-47.
[22]Adelson M E,Pacchia A L,Kaul M,et al.Toward the develop-ment of a virus-cell-based assay for the discovery of novel com-pounds against human immunodeficiency virus type 1[J].Antimi-crob Agents Chemother,2003,47(2):501-8.
[23]Blair W S,Isaacson J,Li X,et al.A novel HIV-1 antiviral high throughput screening approach for the discovery of HIV-1 inhibitors [J].Antiviral Res,2005,65(2):107-16.
[24]Feng L,Wang L,Ma Y Y,et al.A potential in vitro and in vivo anti-HIV drug screening system for Chinese herbal medicines[J].Phytother Res,2012,26(6):899-907.
[25]杨柳萌,王睿睿,张高红,等.中药有效部位复方奇士乐体外抗HIV-1活性研究[J].中国药理学通报,2011,27(4):566-71.
[25]Yang L M,Wang R R,Zhang G H,et al.In vitro anti-HIV-1 ac-tivities of Qishile,a Chinese medicine effective fraction formula [J].Chin Pharmacol Bull,2011,27(4):566-71.
[26]Chan E,Heilek-Snyder G,Cammack N,et al.Development of a Moloney murine leukemia virus-based pseudotype anti-HIV assay suitable for accurate and rapid evaluation of HIV entry inhibitors[J].J Biomol Screen,2006,11(6):652-63.
[27]Kfutwah A K,Mary J Y,Nicola M A,et al.Tumour necrosis fac-tor-alpha stimulates HIV-1 replication in single-cycle infection of human term placental villi fragments in a time,viral dose and en-velope dependent manner[J].Retrovirology,2006,3:36.
[28]曹颖莉,郭 颖.应用假病毒技术研究HIV-1复制抑制剂[J].药学学报,2008,43(3):253-8.
[28]Cao Y L,Guo Y.Screening of HIV-1 replication inhibitors by using pseudotyped virus system[J].Acta Pharm Sin,2008,43 (3):253-8.
[29]Zhang Z,Xu W,Koh Y H,et al.A novel nonnucleoside analogue that inhibits human immunodeficiency virus type 1 isolates resistant to current nonnucleoside reverse transcriptase inhibitors[J].Anti-microb Agents Chemother,2007,51(2):429-37.
[30]Westby M,Nakayama G R,Butler S L,Blair W S.Cell-based and biochemical screening approaches for the discovery of novel HIV-1 inhibitors[J].Antiviral Res,2005,67(3):121-40.
[31]张小娜,童 杰,周衍晶,等.忍冬属药材药效成分及药理作用研究进展[J].中国药理学通报,2014,30(8):1049-54.
[31]Zhang X N,Tong J,Zhou Y J,et al.Studies on medicinal ingredi-ents and pharmacological effects of Lonicera[J].Chin Pharmacol Bull,2014,30(8):1049-54.
[32]Ohishi M,Shioda T,Sakuragi J.Retro-transduction by virus pseudotyped with glycoprotein of vesicular stomatitis virus[J].Vi-rology,2007,362(1):131-8.
Optimization and application of VSVG/HIV-1NL4-3Luc system for screening of anti-HIV-1 compounds
WANG Ping1,2,CHEN Huan2,3,LUO Rong-Hua2,QING Chen1,ZHANG Gao-Hong2,ZHENG Yong-Tang2
(1.School of Pharmaceutical Science&Yunnan Key Laboratory of Pharmacology for Natural Products,Kunming Medical University,Kunming 650500,China;2.Key Laboratory of Animal Models and Human Disease Mechanisms of Chinese Academy of Science&Yunnan Province,Kunming Institute of Zoology,Chinese Academy of Sciences,Kunming 650223,China;3.University of Chinese Academy of Sciences,Beijing 100039,China)
Aim To establish and optimize the VSVG/HIV-1NL4-3Luc pseudovirus model for anti-HIV drugs screening.Methods The infectivity of VSVG/HIV-1NL4-3Luc in 4 different cell lines was investigated according to the method of the lucifer-ase activity analysis system of Promega company.3 different ex-perimental settings were used to detect the activities of approved anti-HIV drugs to confirm the feasibility and effectiveness of the system.Finally,some potential compounds were screened for their anti-HIV activities,and their antiviral activities against the pseudovirus were compared with HIV-1ⅢB.Results The pseud-ovirus showed the strongest replication ability in CRFK cells,and a clear dose-effect relationship was found between the report gene expression level and the virus quantity.Comparing the EC50of different positive inhibitors against VSVG/HIV-1NL4-3Luc on 3 kinds of experimental conditions,3rd scheme is the best.Finally,the system was used to screen compounds,the EC50s a-gainst pseudovirus were similar to those in HIV-1ⅢB.Conclusion An optimized VSVG/HIV-1NL4-3Luc anti-HIV screening sys-tem has been successfully developed.
VSVG/HIV-1NL4-3Luc;HIV;drug screening;posi-tive drugs;optimization;application
时间:2016-2-26 10:20 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160226.1020.052.html
10.3969/j.issn.1001-1978.2016.03.026
A
1001-1978(2016)03-0433-06
R329.24;R373.9;R394.2;R965.1;R978.7
2015-10-26,
2015-11-28
国家科技重大专项课题(No 2009ZX09501-029、2014ZX 10005-002);国家自然科学基金资助项目(No 81471620、81102483);云南省应用基础研究计划(No 2015FB182)
王 萍(1991-),女,硕士生,研究方向:抗HIV药物药效学,Tel:0811-65126855,E-mail:pingwang1991@126.com;张高红(1977-),女,博士,研究方向:抗HIV药物药效学,通讯作者,E-mail:zhanggh@mail.kiz.ac.cn;郑永唐(1962-),男,博士,研究员,博士生导师,研究方向:艾滋病免疫学和抗HIV药物,Tel:0811-65195684,E-mail:zhengyt@mail.kiz.ac.cn
