酸敏感离子通道1a在高糖环境下肝纤维化发病中的作用研究
2016-05-10汪应红田远耀孙仕伟黄蒙蒙李小枫孟晓明
王 欢,汪应红,田远耀,孙仕伟,黄蒙蒙,李小枫,孟晓明,黄 艳
(安徽医科大学药学院基础与临床药理教研室,安徽医科大学肝病研究所,安徽合肥 230032)
酸敏感离子通道1a在高糖环境下肝纤维化发病中的作用研究
王 欢,汪应红,田远耀,孙仕伟,黄蒙蒙,李小枫,孟晓明,黄 艳
(安徽医科大学药学院基础与临床药理教研室,安徽医科大学肝病研究所,安徽合肥 230032)
目的 研究ASIC1a(acid-sensing ion channel 1a)对糖尿病合并肝纤维化的病理影响及高糖环境下PDGF-BB刺激的HSC-T6细胞活化增殖的作用。方法 采用链脲佐菌素(STZ)制备大鼠糖尿病模型,四氯化碳(CCl4)诱导大鼠肝纤维化模型,观察糖尿病组、单纯肝纤维化组及糖尿病并发肝纤维化双模型组肝组织损伤程度及ASIC1a的表达变化;体外实验,利用ASIC1a阻断剂阿米洛利(amiloride)预处理HSC-T6细胞,然后加入高糖处理HSC-T6细胞24 h,再添加重组小鼠血小板衍生生长因子(PDGF-BB)刺激24 h,观察HSC-T6的活化增殖情况;Western blot检测ASIC1a、α-SMA 和Collagen I蛋白表达水平。结果 STZ诱导的糖尿病大鼠、CCl4诱导的肝纤维化大鼠和STZ加CCl4联合诱导的糖尿病肝纤维化双模型大鼠肝组织较对照组大鼠肝组织均出现不同程度的肝损伤,其中双模型大鼠的损伤最为严重,且3组大鼠肝组织较对照组大鼠肝组织中ASIC1a表达明显升高,双模型大鼠肝组织中ASIC1a升高最为明显;阿米洛利预处理HSC-T6,明显降低了高糖环境下ASIC1a的表达,并抑制了高糖环境下PDGF-BB诱导的HSC-T6中α-SMA、Colla-gen I的表达。结论 高糖环境加剧CCl4诱导大鼠肝纤维化及PDGF-BB诱导的HSC活化,其可能与高糖环境下ASIC1a的过表达有关。
高糖;糖尿病;肝星状细胞;ASIC1a;肝纤维化;活化增殖
糖尿病是一组可引起各种急、慢性并发症,以血糖升高和伴随组织酸化为特点的代谢性疾病。多项研究表明,高血糖对肾脏[1]、神经[2]、血管的纤维化形成[3]及视网膜病变[4]有着明显的促进作用。近年来的研究发现,高血糖对肝星状细胞(hepatic stellate cell,HSC)活化增殖及胶原形成也起重要的促进作用[5-6]。肝纤维化是由多种致病因子引起的肝脏慢性损伤、细胞外基质(extracellular matrix,ECM)沉积的炎症反应,是慢性肝病共有的病理过程。HSC的活化是肝纤维化的中心环节,同时活化增殖的HSC也是ECM的主要来源细胞。已有研究表明,高血糖是肝脏疾病死亡率增高的一个重要促进因子[7-8],因此,深入研究高血糖对HSC活化增殖的机制,已受到国内外学者广泛的关注。
酸敏感离子通道(ASICs)是一类由细胞外质子(H+)所激活的阳离子通道,当胞外pH降低时,开放的通道对Na+、Ca2+具有通透性,进而引起细胞一系列生理病理变化[9]。到目前为止,ASICs已克隆了由4个功能基因编码的6个亚基:ASIC1a、ASIC1b、ASIC2a、ASIC2b、ASIC3、ASIC4。过去20年,ASICs的研究主要围绕中枢神经系统和外周神经系统,ASIC1a在哺乳动物神经系统和骨骼等组织的细胞、肺上皮细胞及椎间盘细胞均有表达且起着重要的病理生理作用[10]。有研究表明,ASIC1a参与了酸诱导的大鼠关节软骨细胞基质代谢失衡及自噬的发生,从而参与关节炎的病变[11-12]。近来研究发现,在肝纤维化发生的过程中,ASIC1a变化,进而引起HSC活化增殖,促进肝纤维化的发生发展[13-14]。而高糖是否引起HSC中ASIC1a离子通道过表达及激活,从而部分解释糖尿病高发肝纤维化的机制,目前国内外尚未见报道。为此,本研究从体内实验和体外实验两个方面,探索高糖环境下肝纤维化进程中ASIC1a的变化及其可能作用,为糖尿病性肝纤维化的防治提供新思路。
1 材料与方法
1.1 实验动物 ♂SD大鼠,4~6周龄,体质量100~140 g,清洁级,购于安徽医科大学实验动物中心。
1.2 细胞株 细胞株HSC-T6购自中国科学院上海细胞库,为永生化大鼠HSC。
1.3 主要材料与试剂 链脲佐菌素STZ、阿米洛利(amiloride)、DMSO(美国Sigma公司),四氯化碳CCl4(汕头西陇化工厂);重组小鼠血小板衍生生长因子(PDGF-BB)(英国PEPROTECH公司);细胞组织裂解液RIPA、蛋白酶抑制剂PMSF(上海碧云天公司);Rabbit mAb anti-ASIC1(美国Alomone公司);Rabbit mAb anti-α-SMA、Rabbit mAb anti-Colla-genⅠ(北京博奥森生物技术有限公司);四甲基偶氮唑蓝(MTT)(美国Amresco公司);DMEM培养液(南京凯基生物科技发展有限公司);胎牛血清(杭州四季青生物工程材料有限公司)。
1.4 主要仪器 NAPCO-6100型细胞培养箱(美国SHELLAB);SW-CJ-IF型超净工作台(江苏苏净集团苏州安泰空气技术有限公司);Western blot设备(美国Biorad公司);酶标仪MK3(荷兰雷勃公司);Sig-ma3-16K高速离心机(美国Sigma公司);荧光倒置显微镜(日本Olympus公司)。
1.5 方法
1.5.1 动物分组与模型建立 实验动物自由饮水和进食,随机分为糖尿病组(n=45)、肝纤维化组(n =15)和对照组(n=6)。适应性饲养1周后,糖尿病组大鼠以高脂饲料(10%猪油,20%蔗糖,10%蛋黄粉,1%胆固醇,59%基础饲料)喂养6周,对照组和肝纤维化组以基础饲料喂养。喂养6周后,糖尿病组大鼠隔夜禁食12 h,腹腔内注射0.1 mmol·L-1的链脲佐菌素(STZ,45 mg·kg-1)柠檬酸盐缓冲液,肝纤维化组和对照组等体积柠檬酸盐缓冲液。72 h后尾尖采血测定空腹血糖,若空腹血糖≥7 mmol·L-1为糖尿病[15]。于实验第4周起,随机抽取20只糖尿病大鼠(糖尿病肝纤维化双模型组)和肝纤维化组大鼠,皮下注射40%CCl4植物油溶液,首剂4 ml·kg-1,以后2 ml·kg-1,2次/周,共8周,对照组皮下注射同体积植物油溶液。在末次注射CCl4植物油溶液3 d后隔夜禁食处死。
1.5.2 HE染色 取大鼠肝脏右叶相同位置组织,10%甲醛溶液固定,石蜡包埋,切片,HE染色,光镜下观察染色结果并拍照,分析和评价大鼠肝损伤和纤维化程度。
1.5.3 免疫组织化学检测ASIC1a、α-SMA的表达大鼠肝组织用10%甲醛溶液固定48 h,石蜡包埋、切片。采用SP法染色,切片常规脱蜡,加50 μL过氧化酶溶液,室温孵育30 min;PBS冲洗后加0.1%的胰蛋白酶消化20 min,加50 μL非免疫性动物血清,室温下孵育20 min;加50 μL的一抗,4℃孵育过夜,PBS冲洗后加50 μL生物素标记的二抗,室温下孵育30 min;再加50 μL链霉菌抗生素蛋白-过氧化物酶溶液,室温下孵育30 min;DBA显色、苏木精复染、封片观察。
1.5.4 HSC-T6细胞培养和传代 HSC-T6细胞使用含有10%胎牛血清及100 kU·L-1青霉素和100 mg·L-1链霉素的低糖培养基(1 000 mg·L-1),置于37℃、5%CO2培养箱中培养。当细胞生长融合达到约80%时,用0.25%胰蛋白酶消化传代或按所需浓度接种培养瓶、培养板。
1.5.5 MTT检测细胞增殖 HSC-T6细胞生长80%融合,用0.25%胰蛋白酶消化,完全培养基重悬,台盼蓝法细胞计数,每孔5×103个细胞接种于96孔板。待细胞贴壁后,加入D-Glucose溶液,使其终浓度分别为1 000、2 500、4 500、6 000、8 000 mg· L-1,作用不同时间(0、6、12、24、48、72 h),同时设立等浓度甘露醇(D-mannitol)作为高渗对照,每组6个复孔,每孔均为200 μL体系。置于37℃、5% CO2培养箱中培养到时间后,每孔加20 μL 5×103mg·L-1MTT,37℃继续培养4 h。终止培养,5 mL注射器小心吸尽各孔中液体,加入150 μL DMSO,立即用酶标仪于490 nm波长处检测吸光度值。
1.5.6 Western blot检测HSC中ASIC1a、α-SMA和Collagen I蛋白表达 根据MTT结果筛选出最适高糖浓度(6 000 mg·L-1)和作用时间(48 h),①采用低糖(1 000 mg·L-1)、高糖(6 000 mg·L-1)和甘露醇对照(1 000 mg·L-1+5 000 mg·L-1甘露醇)分别作用细胞48 h,收集细胞蛋白检测ASIC1a、α-SMA和Collagen I的表达;②细胞分为低糖、高糖、高糖+Amiloride及甘露醇对照组。Amiloride预处理1 h后,细胞分别用低糖、高糖和甘露醇培养48 h,收集蛋白检测ASIC1a、α-SMA和CollagenⅠ的表达;③细胞分为高糖、高糖+PDGF、高糖+PDGF+Amiloride及甘露醇对照组,Amiloride预处理1 h后,分别用低糖、高糖和甘露醇培养24 h,再加入PDGF-BB刺激24 h,提取细胞蛋白检测ASIC1a、α-SMA和CollagenⅠ的表达。具体步骤如下:收集各组细胞,加蛋白裂解液RIPA(含PMSF),冰上摇晃裂解30 min。4℃,12 000 r·min-1离心30 min,取上清液。用定量仪对蛋白样品定量后,加入5×蛋白上样缓冲液,100℃加热10 min使蛋白变性。每孔加15 μL总蛋白,进行SDS-PAGE电泳,采用湿转法将胶上蛋白转移至PVDF膜上,膜在室温下用5%脱脂奶粉(TBST配制)封闭3 h,用TBST清洗后,用待检测蛋白的一抗孵育,4℃,过夜。次日,膜用TBST清洗后,用与一抗种属相匹配的的二抗室温孵育1 h,ECL发光试剂盒显影,以β-actin为内参,Image J软件分析条带的灰度值。
1.6 统计学处理 采用SPSS 13.0统计软件进行分析,数据以±s表示,用One-Way ANOVA检验各组间差异的显著性。
2 结果
2.1 肝组织病理染色 HE染色结果(Fig 1)显示,正常组大鼠肝组织结构完整,肝细胞排列整齐,肝小叶结构正常;糖尿病组肝脏结构轻度破坏,出现炎性坏死、脂肪变性;肝纤维化组肝细胞广泛脂肪变性、坏死,炎性细胞浸润,以汇管区及中央静脉周围较重,有胶原纤维沉积,纤维间隔粗大,形成假小叶;糖尿病肝纤维化双模型组可见正常肝小叶结构破坏,纤维结缔组织增生形成纤维条索,伸入肝实质内,肝细胞脂肪变性、坏死,有炎性细胞浸润,并已向肝硬化转化,表明STZ诱发的高血糖可以促进大鼠肝纤维化发生,并加剧CCl4对肝纤维化的病变作用。
2.2 各组大鼠肝组织中ASIC1a、α-SMA蛋白表达免疫组化法检测各组大鼠肝组织中ASIC1a、α-SMA蛋白的表达,阳性染色细胞质呈棕黄色颗粒。结果显示,正常组大鼠肝脏组织中ASIC1a、α-SMA抗原阳性表达较少,STZ糖尿病大鼠和CCl4肝纤维化大鼠及双模型组大鼠肝脏组织中ASIC1a、α-SMA抗原阳性细胞明显增多、着色明显加深,且多分布在肝实质区域,而双模型大鼠的抗原细胞及着色较STZ与CCl4单独诱导的大鼠肝组织明显增多。提示高糖可加重肝纤维化的发生,其机制可能与ASIC1a相关,见Fig 2。

Fig 1 HE staining of rat liver tisssues(HE×200)

Fig 2 Immunostaining signal of ASIC1a and α-SMA(SP×200)
2.3 不同糖浓度培养基对HSC增殖活化的影响MTT结果(Fig 3)显示,糖对HSC-T6细胞的活化增殖有促进作用,且这一作用有浓度-时间依赖性,在6 000 mg·L-1浓度,作用48 h时,细胞增殖最佳,与低糖组比较差异有统计学意义(P<0.01)。Western blot结果(Fig 4)显示,高糖可明显增加HSC-T6细胞中ASIC1a、α-SMA和CollagenⅠ的表达,较低糖组差异有统计学意义(P<0.01)。
2.4 阿米洛利对高糖诱导的HSC中ASIC1a表达的调控作用 结果如Fig 5所示,阿米洛利(25、50、100、200 μmol·L-1),能够剂量依赖性的明显抑制高糖诱导的HSC中ASIC1a的表达,与高糖组比较差异有统计学意义(P<0.01)。此外,ASIC1a抑制剂阿米洛利可明显减少高糖诱导的α-SMA和Colla-genⅠ基因表达,与高糖组比较差异有统计学意义(P<0.01)。Western blot结果(Fig 6)还显示,与高糖组比较,阿米洛利可明显抑制高糖对PDGF-BB诱导的HSC-T6中α-SMA和CollagenⅠ表达的促进作用,抑制HSC-T6细胞活化增殖,差异有统计学意义(P<0.01)。

Fig 3 Effect of glucose on proliferation of HSC-T6

Fig 4 Effect of high glucose on expression of ASIC1a,α-SMA and collagen I in HSC-T6
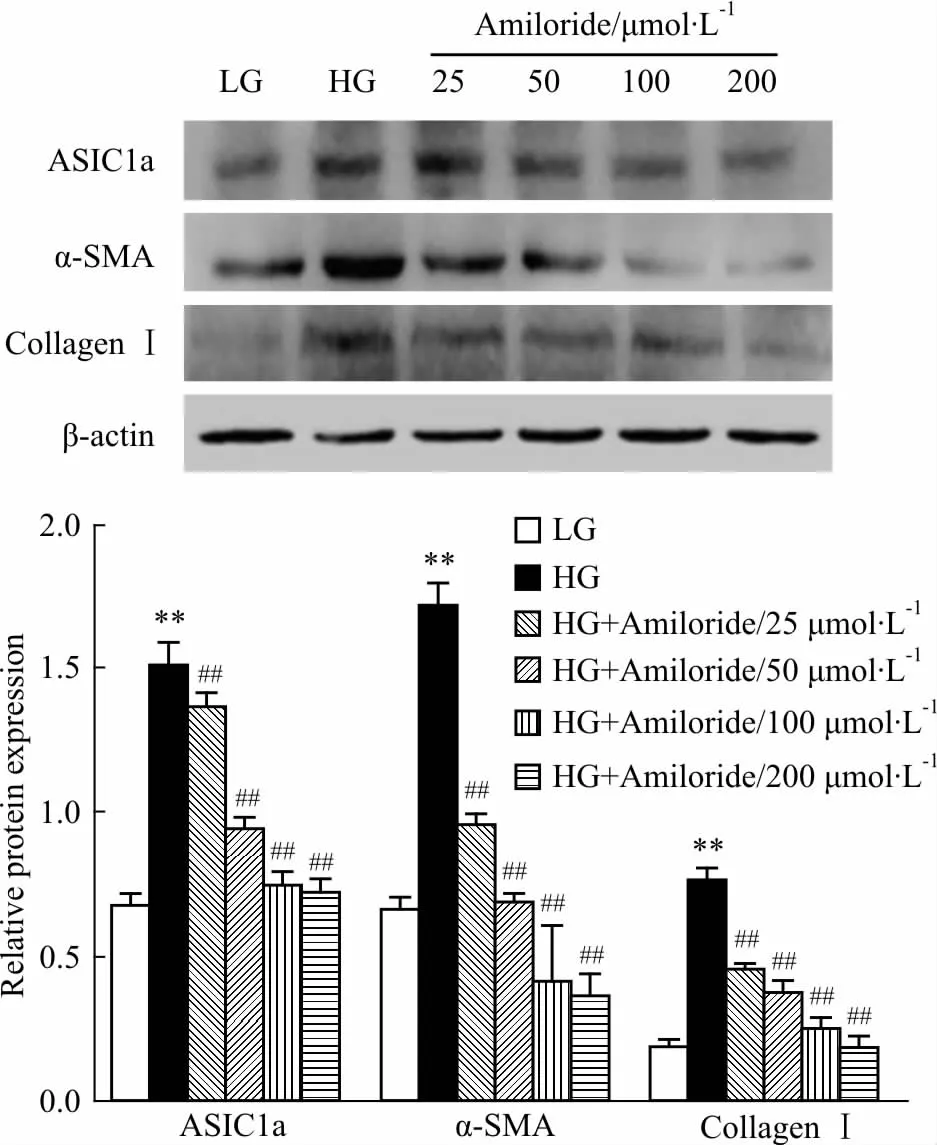
Fig 5 Amiloride inhibits the expression of ASIC1a,α-SMA and collagenⅠin HSC-T6 under high glucose

Fig 6 Amiloride inhibits expression of ASIC1a and relieves effect of high glucose on PDGF-BB induced HSC-T6 cells expression of α-SMA and collagenⅠ
3 讨论
糖尿病和肝脏疾病关系密切,一方面慢性肝损伤可影响糖代谢,导致糖耐量减退和糖尿病。另一方面糖尿病可促进慢性肝病肝纤维化进展,各种慢性肝病的发生率增高。近年来的研究发现,HSC在肝纤维化的发生发展过程中发挥了重要作用,其激活时发生表型转变,成为肌成纤维细胞并特异性地表达α-SMA等细胞外基质[16]。本研究HE染色结果显示,糖尿病组大鼠肝组织和肝纤维化组大鼠肝组织均出现不同程度的肝脏细胞脂肪变性,并伴有脂肪空泡,胶原沉积,炎性细胞浸润等现象。在糖尿病肝纤维化双模型组中,纤维结缔组织增生形成纤维条索,伸入肝实质内,脂肪空泡多且大,并已向肝硬化转化,表明高血糖可促进肝纤维化发生,加剧肝纤维化的病变。
有研究表明,在肝纤维化大鼠组织及PDGF-BB诱导的肝星状细胞中均发现ASIC1a的高表达,ASIC1a离子通道或通过升高细胞内Ca2+从而促进肝纤维化的发生[13-14]。本实验免疫组化结果显示,糖尿病组和肝纤维化组大鼠肝组织ASIC1a和α-SMA表达的范围及棕黄色着色深浅均大于对照组,而糖尿病肝纤维化双模型组表达进一步加深。提示ASIC1a离子通道开放或在糖尿病肝纤维化的形成过程中起着重要的促进作用。
本研究结果显示,高糖培养状态下,HSC-T6表达ASIC1a、α-SMA和CollagenⅠ均明显增加,提示ASIC1a可能参与高糖诱导的HSC的活化增殖。阿米洛利是ASICs家族的有效阻断剂,在高糖环境下,阿米洛利阻断ASIC1a的表达,伴随着HSC活化增殖标志α-SMA和CollagenⅠ表达的降低,进一步证实高糖对肝纤维化促进作用或与ASIC1a的表达增加有关。进一步研究显示,PDGF在高糖环境下刺激的HSC-T6表达ASIC1a、α-SMA和CollagenⅠ较高糖组明显增加,提示高糖不仅可以促进HSC活化增殖,更能加剧PDGF对HSC的活化增殖作用。本研究结果还表明,阻断ASIC1a表达,抑制高糖对PDGF诱导的HSC活化增殖作用,证实ASIC1a在高糖加剧PDGF诱导HSC活化增殖作用中起重要促进作用。
综上所述,高血糖可诱导HSC的活化,并增强PDGF-BB诱导HSC表达α-SMA和CollagenⅠ,其机制可能与ASIC1a的变化有关,为肝纤维化的治疗提供新的靶点。
(致谢:本实验主要在安徽医科大学药学院科教大楼分子药理学实验室完成,在此特别感谢实验室的负责老师及研究生同学的支持与帮助!)
[1] Eboh C,Chowdhury T A.Management of diabetic renal disease [J].Ann Transl Med,2015,3(11):54.
[2] Witzel II,Jelinek H F,Khalaf K,et al.Identifying common ge-netic risk factors of diabetic neuropathies[J].Front Endocrinol (Lausanne),2015,6:88.
[3] Romero M J,Iddings J A,Platt D H,et al.Diabetes-induced vas-cular dysfunction involves arginase I[J].Am J Physiol Heart Circ Physiol,2012,302(1):H159-66.
[4] Pescosolido N,Barbato A,Stefanucci A,Buomprisco G.Role of electrophysiology in the early diagnosis and follow-up of diabetic retinopathy[J].J Diabetes Res,2015,2015:319692.
[5] Sugimoto R,Enjoji M,Kohjima M,et al.High glucose stimulates hepatic stellate cells to proliferate and to produce collagen through free radical production and activation of mitogen-activated protein kinase[J].Liver Int,2005,25(5):1018-26.
[6] Lin J,Chen A.Curcumin diminishes the impacts of hyperglycemia on the activation of hepatic stellate cells by suppressing membrane translocation and gene expression of glucose transporter-2[J].Mol Cell Endocrinol,2011,333(2):160-71.
[7] Su C C,Wang K,Hsia T L,et al.Association of nonalcoholic fat-ty liver disease with abnormal aminotransferase and postprandial hyperglycemia[J].J Clin Gastroenterol,2006,40(6):551-4.
[8] Xu Y Z,Zhang X,Wang L,et al.An increased circulating angio-tensin II concentration is associated with hypoadiponectinemia and postprandial hyperglycemia in men with nonalcoholic fatty liver disease[J].Intern Med,2013,52(8):855-61.
[9] Waldmann R,Bassilana F,De Weille J,et al.Molecular cloning of a non-inactivating proton-gated Na+channel specific for sensory neurons[J].J Biol Chem,1997,272(34):20975-8.
[10]Qadri Y J,Rooj A K,Fuller C M.ENaCs and ASICs as therapeu-tic targets[J].Am J Physiol Cell Physiol,2012,302(7):C943-65.
[11]张礼菊,胡 伟,唐 杰,等.ASIC1a对大鼠关节软骨细胞基质代谢及MAPK信号通路表达的影响[J].中国药理学通报,2014,30(8):1165-70.
[11]Zhang L J,Hu W,Tang J,et al.Role of acid-sensing ion channel 1a in matrix turnover and MAPK expression of articular chondro-cytes of rats[J].Chin Pharmacol Bull,2014,30(8):1165-70.
[12]张晨晨,唐 杰,胡 伟,等.酸敏感离子通道1a在酸诱导的大鼠关节软骨细胞自噬的作用及其机制研究[J].中国药理学通报,2013,29(8):1092-8.
[12]Zhang C C,Tang J,Hu W,et al.Effects of acid-sensing ion chan-nel 1a on acid-induced autophagy of articular chondrocytes and its possible mechanisms[J].Chin Pharmacol Bull,2013,29(8):1092-8.
[13]Pan C X,Wu F R,Wang X Y,et al.Inhibition of ASICs reduces rat hepatic stellate cells activity and liver fibrosis:an in vitro and in vivo study[J].Cell Biol Int,2014,38(9):1003-12.
[14]Wu F R,Pan C X,Rong C,et al.Inhibition of acid-sensing ion channel 1a in hepatic stellate cells attenuates PDGF-induced acti-vation of HSCs through MAPK pathway[J].Mol Cell Biochem,2014,395(1-2):199-209.
[15]邓子玄,周 健,贾伟平.2014年美国糖尿病学会糖尿病医学诊治标准更新内容解读[J].中国医学前沿杂志(电子版),2014,6(1):66-73.
[15]Deng Z X,Zhou J,Jia W P.The interpretation of American dia-betes association on the update treatment standard and content of diabetes medical diagnosis in 2014[J].China Acad J Electr Pub-lish House,2014,6(1):66-73.
[16]Hernandez-Gea V,Friedman S L.Pathogenesis of liver fibrosis [J].Annu Rev Pathol,2011,6:425-56.
Effect of ASIC1a on hepatic fibrosis under high glucose
WANG Huan,WANG Ying-hong,TIAN Yuan-yao,SUN Shi-wei,HUANG Meng-meng,LI Xiao-feng,MENG Xiao-ming,HUANG Yan
(School of Pharmacy,Anhui Medical University,Hefei 230032,China;Institute for Liver Diseases of Anhui Medical University,Hefei 230032,China)
Aim To investigate the effect of ASIC1a (acid-sensing ion channel 1a)on the pathological change of diabetes complication liver fibrosis and the proliferation and activation of hepatic stellate cell (HSC-T6)stimulated by PDGF-BB under hyperglyce-mia.Methods Diabetes rats model was established by streptozotocin(STZ),and liver fibrosis rats model was induced by carbon tetrachloride(CCl4).Then,the liver extent of damage and the expression of ASIC1a were observed in the diabetic rats,liver fibrosis rats and diabetes complication liver fibrosis rats.In vitro,after pretreated with amiloride,HSC-T6 was treated with high glucose for 24 h and then stimulated with PDGF-BB for another 24 h.The proliferation and acti-vation of HSC-T6 were observed,and the expression of ASIC1a,α-SMA and collagenⅠwere detected by Western blot.Results Compared with the control group,rats from diabetic group induced by STZ,liver fibrosis group induced by CCl4,and the diabetes com-plication liver fibrosis rats co-induced by STZ and CCl4were all observed with liver damage at different levels,and tissue injury of complication group was most seri-ous.However,the expression of ASIC1a in the three model groups was significantly increased compared to the control group.ASIC1a level was most obvious in the diabetes complication liver fibrosis rats.Amiloride pretreatment significantly decreased ASIC1a expression and inhibited PDGF-BB mediated proliferation and the expression of α-SMA and collagenⅠin HSC-T6 under high glucose environment.Conclusion High ambient glucose aggravates HSC activation and hepatic fibrosis,and this may be related with the increasing expression of ASIC1a.
high glucose;diabetes;hepatic stellate cell;acid-sensing ion channel 1a;hepatic fibrosis;ac-tivation and proliferation
时间:2016-2-26 10:20 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160226.1020.034.html
10.3969/j.issn.1001-1978.2016.03.017
A
1001-1978(2016)03-0384-06
R-332;R322.47;R329.24;R575.202.2;R587.1;R587.2
2015-09-01,
2015-11-28
安徽省学术技术带头人后备人选课题(No 2015H040);安徽省高校优秀青年人才支持计划重点项目资助课题(No gxyq2016049);安徽医科大学临床医学(“5+3”一体化)专业学生“早期接触科研”训练计划项目(No 2015-ZQKY-46)
王 欢(1990-),女,硕士生,研究方向:抗炎免疫药理学,E-mail:wanghuan7@126.com;黄 艳(1979-),女,博士,教授,硕士生导师,研究方向:抗炎免疫药理学,通讯作者,E-mail:aydhy@126.com
