灯盏细辛提取物中3种活性成分在Caco-2细胞模型吸收机制的研究
2016-05-10李月婷王爱民
胡 杰,侯 佳,李月婷,王爱民,2,黄 勇
(贵州医科大学1.贵州省药物制剂重点实验室,2.民族药与中药开发应用教育部工程研究中心,3.药学院,贵州贵阳 550004)
灯盏细辛提取物中3种活性成分在Caco-2细胞模型吸收机制的研究
胡 杰1,3,侯 佳1,李月婷1,3,王爱民1,2,黄 勇1,3
(贵州医科大学1.贵州省药物制剂重点实验室,2.民族药与中药开发应用教育部工程研究中心,3.药学院,贵州贵阳 550004)
目的 研究灯盏细辛提取物(erigeron breviscapus ex-tract,Ebe)中3种活性成分灯盏甲素、咖啡酸和绿原酸的吸收机制。方法 建立人结肠腺癌细胞系(the human colon carcinoma cell line,Caco-2细胞)模型;利用该模型研究Ebe的细胞摄取规律,通过UPLC-MS/MS法测定Caco-2细胞中灯盏甲素、咖啡酸和绿原酸的浓度,研究pH、时间以及药物浓度对3种活性成分的转运影响;考察在P-糖蛋白抑制剂(维拉帕米、环孢素A)存在与否时3种活性成分在Caco-2细胞模型中的转运情况。结果 受试物Ebe在所设置的浓度范围内(0.1~25.0 g·L-1)对Caco-2细胞无毒副作用。灯盏甲素和绿原酸在Caco-2细胞摄取实验中具有浓度、时间依赖性,呈正相关,渗透系数维持在一个平衡状态。咖啡酸具有浓度饱和性,且加入P-糖蛋白抑制剂后咖啡酸的细胞摄取量明显增加。结论 Ebe中灯盏甲素和绿原酸主要表现为被动转运,P-糖蛋白参与了咖啡酸的摄取过程,咖啡酸的吸收主要由载体媒介转运实现。
吸收;灯盏细辛提取物;灯盏甲素;咖啡酸;绿原酸;Caco-2细胞;UPLC-MS/MS法;P-糖蛋白抑制剂
灯盏细辛是菊科植物短葶飞蓬Erigerm brevisca-pus(Vant.)Hand.-Mazz的干燥全草,主要分布于我国西南地区,具有散寒解表、活血化瘀、通经活络、消炎止痛之功效。现代药理研究表明:灯盏细辛具有抗血栓、抗缺血以及脑缺血/再灌注神经损伤保护作用。目前已从灯盏细辛中分离、鉴定出黄酮类化合物、咖啡酸酯类化合物、酚酸类化合物以及其它类化合物[1]。其中灯盏甲素、咖啡酸和绿原酸分别代表这三大类化合物,均具有抗氧化、清除自由基等脑保护作用,是灯盏细辛中的有效成分。灯盏甲素、咖啡酸和绿原酸的同时检测能够较好地代表灯盏细辛的整体效应,符合中药研究整体观念的新思路。Caco-2来源于人结肠腺癌细胞,其结构和生化作用类似人小肠上皮细胞。将Caco-2细胞模型作为中药吸收研究的快速筛选工具,能够在细胞水平上提供药物分子吸收的综合信息。因此本文采用Caco-2细胞模型,结合UPLC-MS/MS法研究灯盏细辛提取物(erigeron breviscapus extract,Ebe)中有效成分灯盏甲素、咖啡酸和绿原酸的吸收特征,以期为Ebe的口服制剂研究提供一定的科学依据,并为中药体外吸收机制研究提供新思路[2-5]。
1 材料与方法
1.1 药品与试剂 葛根素(批号110752-200912)、绿原酸(批号L11-2013012)、咖啡酸(批号1163-091112)和灯盏甲素(批号1384-101215),以上对照品均购自中药固体制剂制造技术国家工程研究中心;灯盏细辛提取物自制(批号:20130615);Hank’s缓冲溶液(HBSS,Gibco);DMEM培养基(Dulbecco’s Modified Eagle’s Medium,Gibco);考马斯亮蓝(20140822,南京建成生物工程研究所);胎牛血清(Fetalbovineseurm,Biochrom);链霉素;胰蛋白酶(Trypsin,igma);DMSO(北京Solarbio科技有限公司);实验用水为超纯水。
1.2 仪器 ACQUITY系统超高效液相色谱-三重四级杆串联质谱仪,包括二元梯度泵、自动进样器、柱温箱、三重四级杆质量分析器和Masslynx4.1质谱工作站(美国Waters公司);Allegra 64R高速离心机(美国Beckman Coulter公司);超净工作台(苏州净化设备总厂);二氧化碳培养箱(Thermo scientif-ic);ZH-2涡旋混合器(天津药典标准仪器厂);CQ 250A-TS超声波清洗机(上海跃进医用光学器械厂);置相差显微镜(日本Olympus);功能酶标仪(Thermo3001 VARIOSKAN FLASH);TGL-16G离心机;Mill cell-ERS电位仪(美国Millipore公司)。
1.3 色谱条件 Waters Acquity BEH C18(2.1 mm ×50 mm,1.7 μm)色谱柱;0.1%甲酸乙腈-0.1%甲酸水梯度洗脱,梯度为0~3 min:5%~25%,3~4 min:25%~95%,4~5 min:5%;流速为0.35 mL ·min-1;柱温:45℃。进样体积为1 μL[6]。
1.4 质谱条件 Waters Acquity TQD质谱仪,Mass-LynxV4.1工作站,电喷雾电离源(ESI);毛细管电压:3kV;离子源温度:120℃;去溶剂气温度:350℃;去溶剂气为氮气(650 L·h-1);碰撞气为氩气(0.16 mL·min-1)[6];扫描方式为多反应离子监测模式(MRM),用于定量的正离子对等质谱信息见Tab 1。

Tab 1 Mass spectrometric condition
1.5 标准溶液的配制 精密称取绿原酸、咖啡酸和灯盏甲素适量,用甲醇定容至10 mL。获得绿原酸(0.5004 g·L-1)、咖啡酸(0.497 g·L-1)和灯盏甲素(1.06 g·L-1)储备液。分别精密量取绿原酸等3种对照品储备液适量,用甲醇按梯度稀释成所需浓度,得混合系列标准溶液。置冰箱(-20℃)保存,备用。
1.6 Caco-2细胞模型的建立 Caco-2细胞株,传代数在50代之内。将细胞接种于培养瓶,培养液为高糖DMEM培养基,培养基中含10%胎牛血清(含3.7 g·L-1NaHCO3,1%L-谷氨酰胺以及105U· L-1青霉素、链霉素双抗液)置于5%CO2,37℃培养箱中培养[2]。待细胞生长融合约80%贴壁时,采用0.25%胰蛋白酶消化,细胞按10×104个·cm-2接种于6孔培养板,接种24 h后更换培养液,以后隔天换培养液1次,1周后每天换液1次,细胞培养14 d后,细胞生长均匀、边界清晰,成单层膜状态,测定细胞跨膜电阻值为300 Ω·cm2以上,可用于摄取实验[2]。
1.7 细胞裂解液的制备 将已培养好的Caco-2细胞用PBS缓冲液洗去其表面杂质。加入含药的Hank’s溶液(考察药物浓度对Caco-2细胞的影响时,此处加入不同浓度的Ebe Hank’s溶液)2 mL,置于37℃的培养箱中,分别考察不同培养时间、培养介质不同pH和P-糖蛋白抑制剂对Ebe细胞摄取的影响。在考察的培养时间取出后,加入4℃的PBS缓冲液洗去细胞表面药液和杂质,加入0.1% Triton X-100细胞裂解液500 μL,反复冻融裂解细胞,取出细胞超声5 min,得细胞裂解液[2]。
1.8 样品前处理方法 取转运样品(细胞裂解液或细胞混悬液)300 μL,加入10 μL葛根素内标和300 μL甲醇沉淀蛋白,涡混2 min,离心(4℃,15 000 r·min-1)10 min,分离上清液2 μL进样分析。
2 结果
2.1 UPLC-MS/MS分析方法的确证 分别取空白细胞混悬液、混合标准溶液(内标为葛根素)以及进行摄取实验的细胞样品溶液,涡旋2 min,离心(15 000 r·min-1)10 min,分离出上清液进样分析。在本实验条件下,空白细胞混悬液中无杂质峰干扰,细胞混悬液中绿原酸,咖啡酸、灯盏甲素及内标葛根素分离完全,保留时间Rt分别为1.55、1.77、3.19、1.87 min。结果见Fig 1,图中以时间为横坐标,百分强度为纵坐标。
以混合溶液中的药物浓度为横坐标,样品与内标的峰面积比为纵坐标,得到灯盏细辛提取物的工作曲线,其线性范围、回归方程如Tab 2所示。

Tab 2 Linear relationships of three components
选取Tab 2中2、4、6这3个浓度的标液,加入空白细胞混悬液中作为质量控制样品(QC),分别进样分析,将测定的浓度与加入的已知标液浓度比较,求得提取回收率为90.2%~105.8%。每一个浓度进行5样本分析,连续测定3 d,日内精密度RSD% 为0.11%~8.44%;日间精密度RSD%为0.11%~6.43%。上述质控样品分别于室温下保存1、2和 3 d后处理并测定,与零时测定结果比较,RSD%均<15%。以上结果表明,该方法稳定、灵敏,重现性好。

Fig 1 Typical UPLC-MS/MS chromatograms

Fig 2 Study on toxicity of Ebe to Caco-2 cells(±s,n=5)
2.2 不同浓度Ebe对Caco-2细胞毒性实验 实验分为对照组、药物组。对照组每孔加入100 μL DMEM培养液;药物组将药物稀释至不同体积比浓度:0.1、1、5、15、25 g·L-1,每孔加入100 μL。分别作用Caco-2细胞4 h后用MTT法检测。该实验每个浓度平行5孔,重复3次,结果见Fig 2,对照组与各给药组间细胞生长情况差异无统计学意义,表明在所设置的浓度范围内,随着浓度的增加,Ebe对Caco-2细胞的生长无毒性作用,可以进行下一步摄取实验。
2.3 浓度依赖性摄取实验 取不同浓度的Ebe Hank’s溶液(0.3、1、2.5、4、5 g·L-1)2 mL(n=3)加入Caco-2细胞中,于37℃条件培养60 min,考察不同浓度Ebe对细胞摄取的影响。结果见图3,灯盏甲素和绿原酸的摄取量随着Ebe溶液浓度的增加而缓慢增加;咖啡酸随着Ebe溶液浓度的增加,先增加,后减少。

Fig 3 Effects of different concentrations of Ebe on uptake of Caco-2 cells(±s,n=5)
2.4 时间对Caco-2细胞摄取的影响 将Ebe(4 g ·L-1)加入到培养好的细胞中,考察不同时间(15、 30、60、90、120、180 min)后Ebe中各成分作用被Ca-co-2细胞摄取的变化。结果见Fig 4,随着摄取时间的延长,绿原酸和灯盏甲素的摄取量缓慢增加,而咖啡酸的摄取量呈递减趋势,可能受药物外排转运器的影响,使已摄取入胞内的部分咖啡酸排出细胞。

Fig 4 Effects of different time of Ebe on uptake of Caco-2 cells(±s,n=5)
2.5 pH值对Caco-2细胞摄取的影响 将Ebe(4 g·L-1)分别溶于不同pH(4.0、6.0、7.4)Hank’s溶液中,在加药培养60 min后测定不同pH值对Caco-2细胞摄取Ebe的影响。结果见Fig 5,灯盏甲素、绿原酸的细胞摄取量随pH值增加而降低,咖啡酸的细胞摄取量随pH值增加而明显增加,表明Ebe中各成分的转运依赖于pH,综合各成分的吸收特征确定药物吸收的最佳pH值有利于药物的最大吸收。
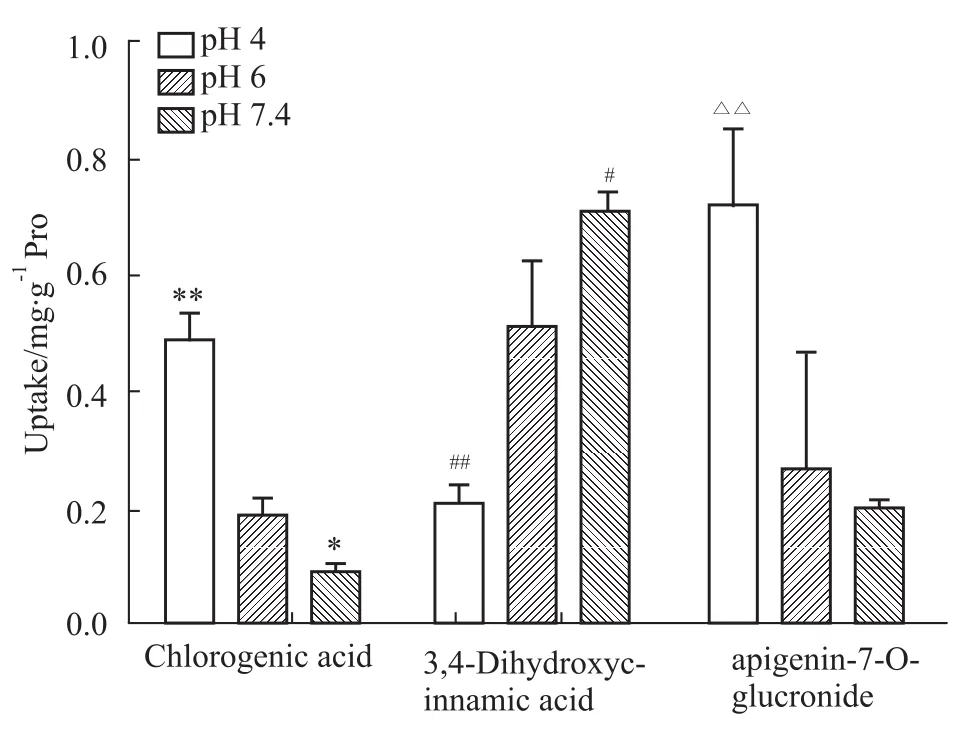
Fig 5 Effects of different pH of Ebe on uptake of Caco-2 cells(±s,n=5)
2.6 p-糖蛋白抑制剂对Caco-2细胞摄取的影响P-糖蛋白抑制剂维拉帕米(verapamil,50 mg·L-1)和环孢素A(cyclosporine A,10 mg·L-1)对Ebe中各成分转运的影响见Tab 3。灯盏甲素和绿原酸的细胞摄取量与对照组相比差异均无显著性(P>0.05),表明灯盏甲素和绿原酸的摄取不受P-gp影响。而维拉帕米和环孢素A均能影响咖啡酸的摄取,P-糖蛋白抑制剂的参与使咖啡酸的摄取量明显增加(P≤0.05)。
Tab 3 Effect of verapamil and cyclosporine A on uptake by Caco-2 cell monolayers(±s,n=3)

Tab 3 Effect of verapamil and cyclosporine A on uptake by Caco-2 cell monolayers(±s,n=3)
*P<0.05 vs extract.
Composition Uptake/mg·g-1Pro Chlorogenic acid 0.11±0.03 Verapamil+Chlorogenic acid 0.10±0.01 Cyclosporin A+Chlorogenic acid 0.11±0 3,4-Dihydroxycinnamic acid 0.15±0.01 Verapamil+3,4-Dihydroxycinnamic acid 0.19±0.02*CyclosporinA+3,4-Dihydroxycinnamic acid 0.19±0.02*Apigenin-7-O-glucronide 9.46±2.59 Verapamil+Apigenin-7-O-glucronide 9.52±2.11 CyclosporinA+Apigenin-7-O-glucronide 10.03±0.87
3 讨论
Caco-2细胞模型是目前国内外广泛应用的体外吸收模型,已成为药物吸收研究的快速筛选工具,并获得美国FDA批准。该模型能够在细胞水平上提供药物透过小肠黏膜的吸收、转运以及毒性的综合信息。用Caco-2细胞模型可以分别研究药物从AP侧(apical side)的摄入和BL侧(basolateral side)的外排过程,该模型能够较好地阐明药物在小肠中的吸收机制,而动物体内实验则无法做到[7]。
Caco-2细胞的实验结果表明,Ebe中各成分的转运依赖于pH,且各成分吸收的最佳pH并不一致,综合Ebe中各成分的吸收特征确定其吸收的最佳pH,将有助于该药物制剂的设计。Ebe中咖啡酸的吸收具有饱和现象,其吸收机制可能为载体媒介转运。进一步的实验证明,维拉帕米和环孢素A的参与能够明显提高咖啡酸的吸收。因此,咖啡酸可能是P-糖蛋白的底物,其转运机制是载体媒介转运中的主动转运。P-糖蛋白作为主要的药物外排转运器,能将其底物从浆膜侧泵回黏膜侧而进入肠腔排出,其结果可能会导致药物透膜吸收减少,生物利用度降低。因此,对于某些可被P-糖蛋白识别并外排的药物,通过抑制P-糖蛋白的表达可促进药物吸收,提高其生物利用度[8-9]。
研究显示,中药防治疾病的物质基础是多成分协同作用的综合结果。因此,同时研究中药中多个成分的吸收特征,将多成分整体性质拟合进行综合分析,符合中药研究整体观念新思路。并且在中药多成分研究中,有预见性地针对吸收性质不良或特殊的成分提出新的口服剂型方案,将对中药口服剂型的现代化发展和走向世界起到重要作用[10]。
(致谢:本实验在贵州省药物制剂重点实验室和民族药与中药开发应用教育部工程研究中心联合完成。真诚感谢贵州省药物制剂重点实验室和民族药与中药开发应用教育部工程研究中心为本实验开展提供相关实验耗材与仪器设备。真诚感谢实验室各位同事、老师在实验中给予我的指导与帮助。)
[1] 曾桂梅.灯盏细辛药理作用研究进展[J].科技致富向导,2014,(8):187,204
[1] Zeng G M.Research progress on pharmacological effects of Eriger-on breviscapus[J].Guide Sci-tech Magaz,2014,(8):187,204.
[2] 兰燕宇,刘 跃,曹 旭,等.杜仲提取物中4种主要成分在Caco-2细胞的摄取特性研究[J].中国药理学通报,2014,30 (9):1306-1.
[2] Lan Y Y,Liu Y,Cao X,et al.Uptake of Eucommia ulmoides ex-tract in Caco-2 cell monolayer[J].Chin Pharmacol Bull,2014,30(9):1306-1.
[3] 王俊俊,廖晓欢,叶 敏,等.Caco-2单层细胞模型上士的宁的体外吸收机制及其与甘草苷的转运相互作用[J].药学学报,2010,45(9):1160-4.
[3] Wang J J,Liao X H,Ye M,et al.In vitro absorption mechanism of strychnine and the transport interaction with liquiritin in Caco-2 cell monolayer model[J].Acta Pharm Sin,2010,45(9):1160 -4.
[4] Sato Y,Itagaki S,Kurokawa T,et al.In vitro and in vivo antioxi-dant properties of chlorogenic acid and caffeic acid[J].Int J Pharm,2011,403(1-2):136-8.
[5] 郑 林,胡 杰,曹 旭,等.灯盏乙素衍生物代谢性质的快速体外评价[J].中国药理学通报,2014,30(9):1298-301.
[5] Zheng L,Hu J,Cao X,et al.Rapid pharmacokinetic characteris-tics evaluating of scutellarin derivatives in vitro[J].Chin Phar-macol Bull,2014,30(9):1298-301.
[6] 胡 杰,李月婷,侯靖宇,等.UPLC-MS同时测定赤芍中五个指标成分的含量[J].天然产物研究与开发,2015,27(2):282-5.
[6] Hu J,Li Y T,Hou J Y,et al.Simultaneous determination of five main index compounds in radix paeoniae rubra by UPLC-MS[J].Nat Prod Res Dev,2015,27(2):282-5.
[7] 卢智玲,冯怡,徐德生,等.Caco-2细胞模型在中药口服吸收及机制研究中的应用[J].中草药,2006,37(4):616-9.
[7] Lu Z L,Feng Y,Xu D S,et al.Application of Caco-2 cell model in peroral absorption of Chinese materia medica and its mechanism [J].Chin Tradit Herbal Drugs,2006,37(4):616-9.
[8] Scherbl D,Muentnich S,Richling E.In vitro absorption studies of cholrogenic acids from coffee using the Ussing chamber model [J].Food Res Int,2014,63(5):456-63.
[9] 任 静,邓盛齐,蒋学华,等.吸收促进剂对绿原酸的跨膜转运影响[J].药学学报,2014,49(2):252-5.
[9] Ren J,Deng S Q,Jiang X H,et al.Enhancers on the transmem-brane transport of chlorogenic acid[J].Acta Pharm Sin,2014,49(2):252-5.
[10]赵 静,梁爱华.Caco-2细胞模型及其在中药吸收转运研究中的应用[J].中国实验方剂学杂志,2009,15(5):79-83.
[10]Zhao J,Liang A H.Caco-2 cell model and its application in the absorption and transportation research of Chinese materia medica [J].Chin J Exp Tradit Med Form,2009,15(5):79-83.
In vitro absorption mechanism of Erigeron breviscapus extract in Caco-2 cell monolayer model
HU Jie1,3,HOU Jia1,LI Yue-ting1,3,WANG Ai-min1,2,HUANG Yong1,3
(1.Guizhou Provincial Key Laboratory of Pharmaceutics;2.Engineering Research Center for the Development and Application of Ethnic Medicine and TCM(Ministry of Education);3.School of Pharmacy,Guizhou Medical University,Guiyang 550004,China)
Aim To study the absorption mechanism of apigenin-7-O-glucronide,3,4-Dihydroxycinnamic acid and chlorogenic acid in Erigeron breviscapus extract (Ebe)by Caco-2 cell monolayer model.Methods The three active ingredients were quantified by UPLC-MS/MS method,and the effect of Ebe concentrations,conveying times,pH values and P-glycoprotein inhibi-tor on the transport of three active ingredients were also investigated.Results Apigenin-7-O-glucronide and chlorogenic acid in Caco-2 cell monolayer model were time-dependent and concentration-dependent.The 3,4-Dihydroxycinnamic acid in Caco-2 cell uptake was concentration-saturate and P-glycoprotein inhibitor was involved in the uptake process.Conclusion The mechanism of apigenin-7-O-glucronide and chlorogenic acid absorption in cells is mainly through passive trans-port,and the absorption of 3,4-Dihydroxycinnamic acid is mainly realized by the carrier transport.
absorption;Erigeron breviscapus extract;apigenin-7-O-glucronide; 3,4-Dihydroxycinnamic acid;chlorogenic acid;Caco-2 cell;UPLC-MS/MS method;P-glycoprotein inhibitor
时间:2016-2-26 10:20 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160226.1020.030.html
10.3969/j.issn.1001-1978.2016.03.015
A
1001-1978(2016)03-0373-05
R284.1;R329.24;R977.6
2015-10-22,
2015-12-17
国家自然科学基金资助项目(No 81260636);贵州省科学技术基金项目(No黔科合J字[2013]2035号);贵州省高等学校创新能力提升计划(No黔教合协同创新字No [2013]04);贵州省中药现代化科技产业专项基金项目(No黔科合重G字[2013]4001);贵州省中医药管理局项目(No QZYY-2015-080)
胡 杰(1991-),女,硕士生,E-mail:hujie51619@sina.cn;黄 勇(1976-),男,博士,教授,研究方向:中药活性成分及新药开发,通讯作者,Tel/Fax:0851-86908899,E-mail:759843553@qq.com
