转化生长因子-β激活激酶1抑制剂对AGEs诱导小鼠骨髓来源巨噬细胞活化作用及机制
2016-05-10徐兴欣邵云侠冯世尧李媛媛吴永贵
付 欣,徐兴欣,邵云侠,冯世尧,李媛媛,吴永贵
(安徽医科大学第一附属医院肾内科,安徽合肥 230022)
转化生长因子-β激活激酶1抑制剂对AGEs诱导小鼠骨髓来源巨噬细胞活化作用及机制
付 欣,徐兴欣,邵云侠,冯世尧,李媛媛,吴永贵
(安徽医科大学第一附属医院肾内科,安徽合肥 230022)
目的 应用转化生长因子-β激活激酶1(TGF-β acti-vated kinase-1,TAK1)抑制剂(5Z-7-oxozeaenol,OZ)作用于晚期糖基化终末产物(adavnaced glyeation end porudets,AGEs)诱导的小鼠骨髓来源巨噬细胞(bone marrow-derived macro-phages,BMMs),探讨TAK1信号通路在AGEs诱导的BMMs活化中作用及机制。方法 获取C57小鼠的BMMs,运用流式细胞术鉴定BMMs纯度。检测TAK1抑制剂在不同浓度下对AGEs培养巨噬细胞活力的影响,激光共聚焦显微镜和流式细胞术检测巨噬细胞M1亚型;RT-PCR检测各组细胞中MCP-1与TNF-α mRNA的表达;Western blot法检测TAK1、MAPK及NF-κB通路蛋白的表达。结果 AGEs刺激能增加M1型巨噬细胞百分比,TAK1抑制剂可抑制AGEs诱导下巨噬细胞向M1表型活化;与正常对照组比较,AGEs刺激不仅上调BMMs中MCP-1、TNF-α mRNA的表达(P<0.01),而且p-TAK1、TAB1、p-JNK、p-p38MAPK、NF-κBp65蛋白表达也明显增加(P<0.05);通过TAK1抑制剂下调p-TAK1表达的同时AGEs培养BMMs的TAB1、p-JNK、p-p38MAPK、NF-κBp65及TNF-α、MCP-1表达均明显降低(P<0.05)。结论 AGEs能诱导BMMs向M1表型活化,TAK1抑制剂可能通过TAK1/MAPKs、MAPKs/NF-κB途径抑制AGEs对巨噬细胞的激活和炎症因子的表达。
AGEs;TAK1;MAPK;NF-κB;巨噬细胞;炎症
糖尿病肾病(diabetic nephropathy,DN)是一种巨噬细胞激活介导的慢性炎症性疾病[1-2]。在糖尿病的高糖环境中,体内游离氨基之间发生非酶促糖基化反应,最终生成晚期糖基化终末产物(AGEs)。研究表明,AGEs的聚集增加可诱发巨噬细胞的活化,是导致DN发生发展的重要原因。转化生长因子β激活激酶1(TAK1)是一种丝氨酸/苏氨酸激酶,是细胞丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和核因子-κB(nuclear factor-kappa B,NF-κB)信号通路上游炎症和免疫信号途径的共同关键调节子[3]。有研究表明,MAPK和NF-κB信号通路是参与巨噬细胞激活的细胞内信号转导途径[4-5]。但是TAK1是否参与AGEs诱导巨噬细胞活化及其机制研究,目前尚未见报道,本实验以BMMs为研究对象,体外模拟糖尿病肾病病理状态,观察TAK1抑制剂对BMMs中相关信号通路蛋白及炎症因子的影响,探讨TAK1信号通路在AGEs诱导巨噬细胞激活中的具体机制。
1 材料与方法
1.1 实验动物 清洁级♂C57BLKS/J小鼠24只,同窝清洁级♂野生对照小鼠12只,6~8周龄,体质量30~40 g,南京大学动物模式中心,动物合格证号:SCKX(苏)2010-0001。
1.2 药品与试剂 AGEs、牛血清白蛋白(BSA)(北京博奥森生物技术公司),胎牛血清(FBS),RPMI 1640(加拿大WISENT公司),小鼠成纤维细胞L929(中科院上海细胞库),5Z-7-oxozeaenol(美国EMD Billerica公司),抗鼠F4/80抗体,抗鼠/人CD11b抗体,抗鼠CD11c抗体(美国Bio Legend公司),TR-Izol试剂(美国Life Technology公司),荧光定量试剂盒(美国Bio-Rad公司),RT-PCR引物(上海,生工),兔抗p-TAK1多克隆抗体、兔抗TAK1多克隆抗体、兔抗TAB1多克隆抗体、鼠抗ED-1单克隆抗体(美国Abcam公司)、小鼠抗p-p38MAPK单克隆抗体、兔抗p38MAPK多克隆抗体、兔抗NF-κB p65多克隆抗体(美国Cell Signaling公司)、兔抗MCP-1多克隆抗体、兔抗TNF-α多克隆抗体、小鼠抗β-ac-tin单克隆抗体、辣根酶标记羊抗兔IgG、辣根酶标记羊抗小鼠IgG(武汉三鹰生物技术公司)
2 方法
2.1 骨髓来源巨噬细胞提取 C57小鼠麻醉后颈椎脱臼处死,分离并剪断股骨及胫骨的两端,用含2%FBS的冷PBS冲洗出骨髓,过筛离心后加入红细胞裂解液,冰上孵育10min;再以4℃离心5 min;弃上清,使用RPMI 1640培养基+15%L929上清+10%FBS+双抗培养基重悬细胞后计数,细胞浓度调整至1×109cells·L-1接种到6孔板,于5% CO2,37℃孵箱中培养。7 d后,0.25%胰酶消化并收集非贴壁细胞。
2.2 流式细胞术分析BMMs纯度 无血清培养基同步化BMMs 24 h,200 mg·L-1AGEs刺激24 h后收集[6],经离心洗涤,加入抗小鼠CD16/32Fcγ受体20min阻断细胞膜上Fc受体;再加入FITC标记的F4/80抗体,APC标记的CD11b和PE标记的CD11c,避光室温孵育30 min,离心洗涤2次,重悬于500 μL PBS中,使用美国BD FACS Calibur流式细胞仪分别检测F4/80、CD11b和CD11c阳性细胞百分比。
2.3 抑制剂对巨噬细胞活力影响 按照CCK-8 (cell counting kit)细胞毒性试剂盒说明书进行,取BBMs对数期生长细胞(每孔1×104)接种于96孔板,同步化培育24 h,分别加入不同浓度(10~1 000 nmol·L-1)的TAK1抑制剂或DMSO(对照组),37℃孵育1 h后,AGEs干预24 h;每孔加入10 μL CCK-8溶液,孵育4 h;用酶标仪测490 nm处各孔吸光度,重复3次,计算平均细胞活力。
2.4 实时荧光定量PCR检测各组巨噬细胞的MCP-1及TNF-α mRNA的表达 选TAK1抑制剂浓度30、100及300 nmol·L-1,作用于AGEs刺激的BBMs,分别加入1 mL TRIzol试剂,提取总RNA,进行RNA纯度和浓度鉴定,使OD260/OD280在1.8~2.0之间;将RNA通过反转录系统A3500逆转录成cDNA,采用SYBR Green PCR试剂盒进行PCR测定。GAPDH:上游序列5′-GGTGAAGGTCG GTGTGAACG-3′,下游序列5′-CTCGCTCCTG-GAAGATGGTG-3′;TNF-α:上游序列5′-GCT-GAGCTCAAACCCTGGTA-3′,下游序列5′-CG-GACTCCG CAAAGTCTAAG-3′;MCP-1:上游序列5′-TTGACCCGTAAATCTGAAG CTAAT-3′,下游序列5′-TCACAGTCCGAGTCACACTAGTTCAC-3′。每个样本设3个复孔,取均值,获得平均Ct值,以GAPDH作为内参照校正,用2-△△Ct法分析基因的相对表达。
2.5 巨噬细胞实验分组 通过预实验摸索最佳抑制剂浓度为300 nmol·L-1,及各组蛋白表达最佳时间点。细胞培养至70%~80%融合时,同步化24 h,进行细胞分组:正常对照组(normal control,NC,RPMI 1640培养基);BSA组(200 mg·L-1BSA,BSA);AGEs组(200 mg·L-1AGEs,AGEs);AGEs +OZ组(200 mg·L-1AGEs+OZ300)。
2.6 激光共聚焦显微镜分析 将BMMs以1×105/孔的密度接种在玻璃皿底,4%多聚甲醛4℃下固定10 min,5%驴血清白蛋白阻断2 h,加入抗iNOS抗体4℃孵育过夜。PBST洗3次后,加入Alexa Fluor 647标记的F4/80和FITC标记的二抗避光孵育2 h,DAPI染核,漂洗封片后,在德国Leica TCS SP5激光共聚焦显微镜下观察采像。
2.7 Western blot检测各组的蛋白表达 AGEs刺激同步化后的巨噬细胞,相应的时间点收集蛋白;并将蛋白电转移至NC膜,使用丽春红染色判断有无条带,将NC膜取出并置于TBST配制的5%脱脂奶粉于37℃封闭2 h;加入p-TAK1抗体(1∶1 000)、TAK1(1∶1 000)、TAB1(1∶1 000)、pJNK(1∶1 000)、JNK(1∶2 000)、p-p38MAPK(1∶1 000)、p38MAPK(1∶2 000)、NF-κBp65(1∶1 000)、β-actin抗体(1∶2 000)、4℃过夜;洗膜后加入用TBST稀释的辣根酶过氧化物标记的羊抗兔IgG(1∶2 000),37℃孵育45 min;洗膜3次后使用ECL反应30 s,在Tanon 4500SF成像系统中显影。用Tanon公司Lab-Works 4.5软件对Western blot条带进行半定量分析。以β-actin作为内参照,所有的结果至少重复3次。
3 结果
3.1 骨髓来源巨噬细胞纯度鉴定 L929细胞上清液中含巨噬细胞集落刺激因子(M-CSF),加入小鼠骨髓来源干细胞,d 7时,诱导成BMMs,经流式细胞仪检测巨噬细胞表面标记物F4/80和CD11b,双标阳性率达到99.35%(Fig 1)。

Fig 1 Purity detection of bone marrow derived macrophages
3.2 5Z-7-oxozeaenol对巨噬细胞活性的影响 选取10 nmol·L-1到1 000 nmol·L-1之间5种抑制剂浓度,Fig 2表明5Z-7-oxozeaenol浓度在10~300 nmol·L-1对AGEs刺激的BMMs活性无影响(P>0.05),5Z-7-oxozeaenol 1 000 nmol·L-1时对AGEs刺激的BMMs活性有影响(P<0.05)。

Fig 2 Viability analysis of BMMs after treatment with 5Z-7-oxozeaenol(10~1 000 nmol·L-1)in AGEs-induced BMMs
3.3 各组巨噬细胞MCP-1和TNF-α的mRNA表达 RT-PCR结果显示,与对照组比较,AGEs刺激组BMMs MCP-1和TNF-α的mRNA表达明显上调(P<0.01),这一结果表明AGEs可以增加巨噬细胞炎症因子的产生;随5Z-7-oxozeaenol浓度(30、100、300 nmol·L-1)的升高,MCP-1、TNF-α mRNA表达呈下降趋势,其中300 nmol·L-1的5Z-7-oxoze-aenol对炎症因子抑制作用最强(P<0.01),故5Z-7-oxozeaenol可以降低AGEs诱导的BMMs炎症因子的表达,见Fig 3。
3.4 AGEs对巨噬细胞的活化及5Z-7-oxozeaenol的抑制作用 Fig 4A系激光共聚焦显微镜分析结果,提示AGEs组iNOS荧光强度明显高于对照组,AGEs+OZ300组iNOS荧光强度明显减弱;但F4/80在所有组别的BMMs上均表达。流式细胞术显示,AGEs组的F4/80、CD11b和CD11c三标的M1型巨噬细胞百分比较对照组明显升高(P<0.01),说明AGEs刺激可成功诱导BMMs功能表型向M1型活化;AGEs+OZ300组M1型巨噬细胞百分比明显降低(P<0.01),提示5Z-7-oxozeaenol可抑制AGEs对巨噬细胞的活化作用,见Fig 4B。
3.5 各组巨噬细胞p-TAK1、p-JNK、p-p38MAPK、TAB1、NF-κB p65的蛋白表达 Western blot印迹条带分析显示AGEs组p-TAK1、p-JNK、p-p38MAPK、TAB1和NF-κB p65蛋白表达较对照组增加(P<0.05),5Z-7-oxozeaenol干预可使巨噬细胞上述蛋白表达与AGEs组相比下降(P<0.05),见Fig 5。
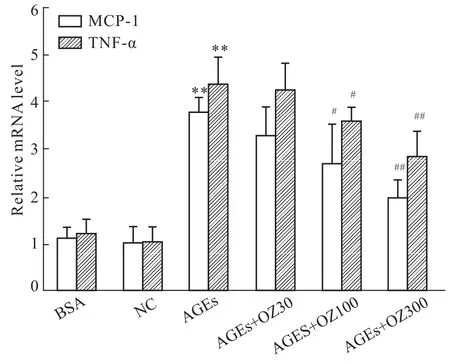
Fig 3 Real time PCR analyses effects of OZ on MCP-1 and TNF-α mRNA expression of BMMs under AGEs
4 讨论
巨噬细胞的活化和浸润是DN炎症反应的特征性表现之一。经典激活型(classically activated,M1型)巨噬细胞是促炎及促纤维化的巨噬细胞表型,在早期炎症反应阶段,浸润的巨噬细胞通过分泌IL-12、IL-23、TNF-α、IL-1β、活性氧(ROS),诱导型一氧化氮合酶(iNOS)及MCP-1等促炎因子引起的肾脏组织结构的损伤和破坏,参与DN间质炎症反应及肾小球纤维化的发生[7]。糖尿病环境下生成的AGEs可以通过与细胞表面特异性受体结合,激活氧化应激及MAPK、NF-κB等信号传导途径,诱导细胞因子的表达及细胞外基质的聚集,导致肾小球纤维化、炎性细胞浸润和蛋白尿产生[8-10]。故巨噬细胞的活化和AGEs的聚集与DN发生发展有着密切的关系。本实验采用AEGs孵育巨噬细胞24 h,模拟体外糖尿病肾病炎症状态。F4/80、CD11b表示巨噬细胞的成熟度,iNOS和CD11c在活化的巨噬细胞中高表达,可作为M1型巨噬细胞表面标志[11]。激光共聚焦显示AGEs组上述M1型巨噬细胞表面标志的百分比明显高于对照组,说明AGEs刺激可成功诱导BMMs向M1型巨噬细胞分化。作为免疫反应的主要效应细胞,M1型巨噬细胞产生多种炎性细胞因子,如TNF-α和IL-1β,TNF-α具有介导生长、炎症、免疫调节等多方面生物学效应[12]。最近的一项研究显示,在单核/巨噬细胞中,AGEs通过上调mRNA水平并释放促炎细胞因子IL-1β和TNF-α,进而诱导人单核细胞表达单核细胞趋化因子-1(monocyte chemoattractant protein-1,MCP-1),它对单核巨噬细胞具有很强的趋化激活作用[12-14]。前期预实验结果显示,10、30、100及300 nmol·L-1的5Z-7-oxozeaenol对AGEs刺激的BMMs活性无影响,在安全剂量范围内选用30、100及300 nmol· L-13种浓度作用于AGEs刺激的BMMs,RT-PCR法检测炎症因子TNF-α、MCP-1的表达,较AGEs组均有降低(P<0.05),其中300 nmol·L-1时的炎症因子的表达最弱(P<0.01),故后期的实验分组中5Z-7-oxozeaeno的浓度选为300 nmol·L-1,而AGEs +OZ300组M1型巨噬细胞表面标志较AGEs组明显降低(P<0.01),提示5Z-7-oxozeaenol可抑制AGEs刺激的巨噬细胞的活化及TNF-α和MCP-1的产生,但具体的分子机制尚不清楚。

Fig 4 Effects of 5Z-7-oxozeaenol on macrophage activation in AGEs-induced BMMs

Fig 5 Effects of OZ on p-TAK1,TAB1,p-JNK,p-p38MAPK protein in AGEs-induced BMMs analysed by Western blot
TAKl为苏氨酸/丝氨酸蛋白激酶,在序列与功能上属于丝裂原激活蛋白激酶家族成员。TAK1作为调节多种促炎因子信号转导通路,在促炎因子,如TNF-α、IL-1β、TGF-β、Toll样受体(TLR)配体的参与下,首先通过激活MAP2Ks家族的MEK3/6和MEK4/7,然后MEK3/6和MEK4/7信号分别激活MAPK家族的应激活化激酶(JNK)、p38MAPK激酶进而激活转录因子激活蛋白1(AP-1)[15]。TAK1又可以通过与结合蛋白TAB1的共表达而被激活,磷酸化修饰被认为是TAK1依赖的信号转导过程中重要调节机制[16]。NF-κB是转录因子家族中的成员,被AGEs产生的ROS激活,与靶基因上特定的DNA序列结合并调节基因转录,产生和释放各种细胞因子,如MCP-1及TNF-α等,后者可进一步增加ROS的产生,二者形成级联反应,构成恶性循环,导致NF-κB活性持续升高[17-18]。Hofmann等[19]的研究发现,DN患者外周血单个核细胞NF-κB的活性较DM患者明显增强,并与蛋白尿程度相关,表明NF-κB活性与DN的发生及其程度密切相关。在UUO致肾小管间质纤维化小鼠模型中,JNK、p38MAPK、NF-κB信号通路在肾脏组织被激活以及下游的炎症因子IL-1α、TNF-α、NOS2和CCL2mRNA表达增加,同时巨噬细胞浸润明显增加。利用基因敲除技术使UUO小鼠模型TAK1基因敲除,结果JNK、p38MAPK、NF-κB信号通路被抑制,炎症因子的释放减少以及巨噬细胞的浸润明显降低[8]。体内研究表明,TAK1抑制剂可以阻止损伤导致的TAK1和NF-κBp65的磷酸化[20],TAK1基因敲出小鼠细胞的TNFR1、IL-1R和TLR3通路功能缺陷,下游信号NF-κB、JNK和IKKβ不能被激活[21]。因此,TAK1基因在调节JNK、p38MAPK和NF-κB通路及其下游炎症因子的表达上发挥重要作用。本实验通过Western blot法探讨TAK1抑制剂对BMMs中TAK1、MAPK 和NF-κB信号通路的影响,与对照组相比较,AGEs组的p-TAK1、TAB1表达明显升高,同时JNK、p38MAPK及NF-κB的磷酸化水平均增加,给予300 nmol·L-1TAK1抑制剂治疗后,上述信号通路蛋白的表达均降低,说明TAK1通过磷酸化介导在调节MAPK及NF-κB信号通路中发挥至关重要的作用。
综上所述,本研究模拟体外糖尿病病理环境,AGEs可以激活巨噬细胞中TAK1、MAPK及NF-κB信号通路,初步证实TAK1抑制剂可以干预巨噬细胞MAPK及NF-κB信号转导通路的活化以及炎症因子TNF-α、MCP-1的表达,从而抑制糖尿病炎症反应,且为临床上控制糖尿病炎症的激活提供理论基础。但是TAK1、MAPK及NF-κB信号通路之间是否存在相互作用,以及肾脏巨噬细胞分离进一步验证TAK1在糖尿病肾病中的作用机制需要进一步的探讨。
[1] Chow F Y,Nikolic-Paterson D J,Atkins R C,et al.Macrophages in streptozotocin-induced diabetic nephropathy:potential role in re-nal fibrosis[J].Nephrol Dial Transplant,2004,19(12):2987-96.
[2] Fang Q,Zhao L,Wang Y,et al.A novel chalcone derivative atten-uates the diabetes-induced renal injury via inhibition of high glu- cose-mediated inflammatory response and macrophage infiltration [J].Toxicol Appl Pharmacol,2015,282(2):129-38.
[3] Chow F Y,Nikolic-Paterson D J,Ozols E,et al.Monocyte che-moattractant protein-1 promotes the development of diabetic renal injury in streptozotocin-treated mice[J].Kidney Int,2006,69 (1):73-80.
[4] Banba N,Nakamura T,Matsumura M,et al.Possible relationship of monocyte chemoattractant protein-1 with diabetic nephropathy [J].Kidney Int,2000,58(2):684-90.
[5] Wang Q Y,Chen F Q.Clinical significance and different levels of urinary monocyte chemoattractant protein-1 in type 2 diabetes mel-litus[J].Diabetes Res Clin Pract,2009,83(2):215-9.
[6] Qin Q,Niu J,Wang Z,et al.Astragalus membranaceus inhibits in-flammation via phospho-P38 mitogen-activated protein kinase (MAPK)and nuclear factor(NF)-κB pathways in advanced gly-cation end product-stimulated macrophages[J].Int J Mol Sci,2012,13(7):8379-87.
[7] 罗邦雨,熊 俊.巨噬细胞在肾脏纤维化中的调节作用[J].中华肾脏病杂志,2012,28(8):657-60.
[7] Luo B J,Xiong J.Regulation of macrophages in renal fibrosis[J].Chin J Kidney Dis,2012,28(8):657-60
[8] Ma F Y,Tesch G H,Ozols E,et al.TGF-β1-activated kinase-1 regulates inflammation and fibrosis in the obstructed kidney[J].Am J Physiol Renal Physiol,2011,300(6):1410-21.
[9] Ma F Y,Liu J,Nikolic-Paterson D J.The role of stress-activated protein kinase signaling in renal pathophysiology[J].Braz J Med Biol Res,2009,42(1):29-37.
[10]Mezzano S,Aros C,Droguett A,et al.NF-kappaB activation and overexpression of regulated genes in human diabetic nephropathy [J].Nephrol Dial Transplant,2004,19(10):2505-12.
[11]Ying W,Cheruku P S,Bazer F W,et al.Investigation of macro-phage polarization using bone marrow derived macrophages[J].J Vis Exp,2013,(76):e50323.
[12]Hickey F B,Martin F.Diabetic kidney disease and immune modu-lation[J].Curr Opin Pharmacol,2013,13(4):602-12.
[13]Sugimoto K,Yasujima M,Yagihashi S.Role of Advanced Glycation End Products in Diabetic Neuropathy[J].Curr Pharm Des,2008,14(10):953-61.
[14]Labonte A C,Tosello-Trampont A C,Hahn Y S.The role of mac-rophage polarization in infectious and inflammatory diseases[J].Mol Cells,2014,37(4):275-85.
[15]Ajibade A A,Wang H Y,Wang R F.Cell type-specific function of TAK1 in innate immune signaling[J].Trends in Immunol,2013,34(7):307-16.
[16]Sakurai H.Targeting of TAK1 in inflammatory disorders and cancer [J].Trends Pharmacol Sci,2012,33(10):522-30.
[17]Chen L,Zhang J,Zhang Y,et al.Improvement of inflammatory re-sponses associated with NF-kappa B pathway in kidneys from dia-betic rats[J].Inflammation Res,2008,57(5):199-204.
[18]Nam J S,Cho M H,Lee G T,et al.The activation of NF-kappaB and AP-1 in peripheral blood mononuclear cells isolated from pa-tients with diabetic nephropathy[J].Diabetes Res Clin Pract,2008,81(1):25-32.
[19]Hofmann M A,Schiekofer S,Isermann B,et al.Peripheral blood mononuclear cells isolated from patients with diabetic nephropathy show increased activation of the oxidative-stress sensitive transcrip-tion factor NF-kappaB[J].Diabetologia,1999,42(2):222-32.
[20]Song Z,Zhu X,Jin R,et al.Roles of the kinase TAK1 in CD40-me-diated effects on vascular oxidative stress and neointima formation after vascular injury[J].PLoS One,2014,9(7):e101671.
[21]Shim J H,Xiao C,Paschal A E,et al.TAK1,but not TAB1 or TAB2,plays an essential role in multiple signaling pathways in vivo [J].Genes Devel,2005,19(22):2668-81.
Effect of TGF-β activated kinase-1 inhibitor on bone marrow-derived macrophages activation and its mechanism
FU Xin,XU Xing-xin,SHAO Yun-xia,FENG Shi-yao,LI Yuan-yuan,WU Yong-gui
(Dept of Nephrology,the First Affiliated Hospital,Anhui Medical University,Hefei 230022,China)
Aim We used bone marrow-derived macro-phages(BMMs),to explore the mechanism of macro-phage activation and the effect of TGF-β activated ki-nase-1(TAK1)inhibitor 5Z-7-oxozeaenol on it under AGEs conditions.Methods The BMMs were obtained from C57 mice,and purity of BMMs was detected by flow cytometry.Cell viability was tested after treatment with different concentrations of TAK1 inhibitors.Laser confocal microscopy was used to detect macrophage M1 subtype.Flow cytometry was used to analyse the macro-phage activated by AGEs.TNF-α and MCP-1 mRNA levels were evaluated by qRT-PCR.Western blot was used to detect the expression levels of TAK1 signal pathway protein.Results AGEs stimulation could in-crese the activity of M1 macrophages,and 5Z-7-oxoze-aenol could inhibit the differentiation of BMMs.Com-pared with control group,AGEs increased the expres-sion of MCP-1 and TNF-α mRNA(P<0.01).p-TAK1,TAB1,p-JNK,p-p38MAPK and NF-κBp65 proteins ex-pression also increased significantly(P<0.05).After treatment with inhibitor,transcription levels of MCP-1 and TNF-α decreased significantly(P<0.05,P<0.01).5Z-7-oxozeaenol treatment downregulated the expression of p-TAK1,TAB1,p-JNK,p-p38MAPK and NF-κBp65 proteins(P<0.05).Conclusions AGEs can induce BMMs to M1 phenotypic polarization.5Z-7-oxozeaenol reduces the expression of inflammatory cyto-kine via inhibiting TAK1/MAPKs,MAPKs/NF-κB pathways.
advanced glycation end products;TAK1;MAPK;NF-κB;macrophage;inflammation
时间:2016-2-26 10:20 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160226.1020.024.html
10.3969/j.issn.1001-1978.2016.03.012
A
1001-1978(2016)03-0355-07
R-332;R329.24;R329.25;R345.57;R364.5;R692.39
2015-08-31,
2015-11-06
国家自然科学基金资助项目(No 81270813)
付 欣(1990-),女,硕士生,研究方向:糖尿病肾病分子机制研究与干预,Tel:0551-62922111,E-mail:fuxin729@163.com;吴永贵(1966-),男,博士,教授,博士生导师,研究方向:糖尿病肾病分子机制研究与干预,Tel:0551-62922111,E-mail:wuyonggui@medmail.com.cn
