早产儿早期经验性应用抗生素对其肠道菌群的近期影响
2016-05-09朱丹萍杜立中余加林艾青肖洒程晨张云辉贺雨潘云宋思捷
朱丹萍杜立中余加林艾 青肖 洒程 晨张云辉贺 雨潘 云宋思捷
早产儿早期经验性应用抗生素对其肠道菌群的近期影响
朱丹萍1杜立中2余加林1艾青1肖洒1程晨1张云辉1贺雨1潘云1宋思捷1
摘要目的利用16S rDNA PCR及变性梯度凝胶电泳(DGGE)技术,探讨生后经验性应用抗生素对早产儿早期肠道菌群的影响。方法以2014年1月至2015年1月在重庆医科大学附属儿童医院住院治疗的早产儿为研究对象,使用哌拉西林-他唑巴坦>7 d为哌拉西林组,7 d内未使用抗生素为对照组。收集胎粪(<12 h)和3、5、7日龄(d3、d5、d7)的粪便标本,采用PCR-DGGE方法对肠道菌群的变化行动态观察,同时行克隆测序分析菌群组成的变化。结果24例早产儿的96份粪便标本进入分析,哌拉西林组和对照组各12例,两组基线具可比性。24份胎粪提取细菌DNA后行PCR扩增失败,未行DGGE分析。①哌拉西林组d3、d5、d7时点的Shannon指数中位数(P(25)~P(75))分别为1.64(1.16~1.92)、1.97(1.69~2.20)和1.22(0.69~2.10) ;对照组分别为1.39(0.94~1.94)、2.24(2.07~2.49)和2.38(2.07~2.61),哌拉西林组d7时点的Shannon指数显著低于对照组(P<0.05)。②随日龄增加,对照组Shannon指数逐渐升高;哌拉西林组Shannon指数呈降低趋势。③d7时点哌拉西林组和对照组均以克雷伯菌属占绝对优势(35.5%和42.4%),且乳酸杆菌属检出率均较低(1.6%和0.8%)。哌拉西林组较对照组肠球菌属(21.0% vs 7.2%)及链球菌属(25.8% vs 4.0%)比例明显增加,肠杆菌比例明显降低(3.2% vs 12.8%)。结论早产儿菌群结构简单,生后抗生素应用会降低肠道菌群多样性。
关键词早产儿;肠道菌群;抗生素;变性梯度凝胶电泳
作者单位1重庆医科大学附属儿童医院新生儿中心,儿童发育疾病研究教育部重点实验室,儿科学重庆重点实验室,儿童发育重大疾病国家国际科技合作基地重庆,410014; 2浙江大学医学院附属儿童医院杭州,310003
由于早产儿免疫功能不完善、对感染抵抗力差,且由于早发败血症诊断困难,常需要生后即开始经验性应用抗生素。而待血常规、CRP、降钙素原、血培养等检查除外早发败血症后,应在48 h内停用抗生素[1]。但由于早产儿产前常合并感染高危因素,且即便出现阴性的实验室检查结果,也不能完全排除早产儿感染,导致抗生素使用时间延长。有研究发现经验性抗生素应用时间延长与早产儿晚发败血症、新生儿坏死性小肠结肠炎(NEC)的发生相关[2],这一现象提示抗生素的长期使用是否会对早产儿肠道菌群产生影响,从而引起部分疾病的发生?目前尚未见相关研究。
1 方法
1.1研究设计以生后使用哌拉西林-他唑巴坦>7 d的早产儿为哌拉西林组,生后7 d内未使用抗生素的早产儿为对照组。采用16S rDNA PCR-DGGE及克隆测序技术对不同日龄粪便标本行动态观察,考察生后经验性应用抗生素对早期肠道菌群的影响。
1.2伦理和知情同意本研究获得重庆医科大学附属儿童医院(我院)伦理委员会批准(批准号: 109/2013),且获得患儿父母或法定监护人的书面知情同意。
1.3早产儿经验性应用抗生素的指征存在感染危险因素(胎膜早破>18 h,绒毛膜羊膜炎等)和临床表现怀疑早期感染。
1.4哌拉西林组纳入标准①出生后即转运至我院治疗的早产儿;②有经验性应用抗生素指征;③入院24 h内应用哌拉西林-他唑巴坦,且应用>7 d。
1.5对照组纳入标准①出生后即转运至我院治疗的早产儿;②无经验性抗生素治疗指征;③生产方式、胎龄[3]与哌拉西林组尽量匹配。
1.6排除标准两组均排除,①临床需要使用微生态制剂,②存在败血症、先天畸形、先天异常或遗传代谢性疾病者。
1.7标本采集方法及时点使用一次性无菌粪便采集管收集早产儿出生后胎粪(<12 h)及3、5、7日龄(d3、d5、d7)时点的粪便标本,称量250 mg粪便置于1.5 mL无菌EP管中,并于收集后2 h内冻存于-80℃冰箱中。
1.8粪便细菌DNA提取将冻存的粪便标本置于冰上,按照QIAamp FAST DNA stool Mini Kit试剂盒(QIAGEN,德国)说明提取细菌DNA,保存于-80℃备用。
1.9PCR-DGGE
1.9.1PCR扩增参照课题组前期的方法,使用细菌16S rDNA V3区的通用引物进行扩增[2]。因标本细菌DNA量少,改良PCR办法为降落PCR,反应条件: 94℃预变性5 min; 94℃30 s; 61~56℃,每循环降低0.5℃30 s,72℃ 1 min,10个循环; 94℃30 s,56℃30 s,72℃1 min,25个循环; 72℃延伸7 min,2%琼脂糖凝胶检测PCR产物。
1.9.2PCR产物行DGGE根据课题组前期建立的方法[2,3],采用BIO-RAD Dcode Universal Mutation System进行电泳分析,观察并记录凝胶条带,同时对优势条带切割回收。DGGE图谱使用Quantity one软件分析,得出条带丰富度(S),其越大代表检测到菌种数量越多。采用多样性数据分析软件(BIO-DAP)计算Shannon指数(H'),细菌种类越丰富Shannon指数越大[4]。
1.10条带回收、克隆、测序切割回收的胶条经清洗后,用30 μL灭菌去离子水浸泡12~16 h得到DNA液,用不含“GC”夹的引物:上游357f (5'-CCTACGGAGGCAGCAG-3')和下游518r(同上)行PCR扩增,所得产物用TaKaRa胶回收试剂盒进行纯化、回收(步骤参照相应说明书),行T-A克隆后,送上海生物工程有限公司测序,测序结果在Blast上进行比对,分析细菌种类。
1.11统计学方法使用SPSS 22.0软件进行统计分析。正态分布计量资料以±s表示,组间比较采用t检验;非正态分布计量资料以中位数(P25,P75)表示,组间比较采用秩和检验;计数资料以百分比表示,组间比较采用χ2检验或Fisher精确概率法。P<0.05为差异有统计学意义。
2 结果
2.1一般情况2014年1月至2015年1月我院住院治疗的24例早产儿的96份粪便标本纳入分析,哌拉西林组和对照组各12例,平均胎龄分别为(34.3±1.2)和(34.4± 1.4)周;两组男性均为4例;出生体重分别为(2.2±0.4) 和(2.3±0.5) kg;两组剖宫产均为10例;出生后均采用人工喂养,两组基线数据差异均无统计学意义(P>0.05)。
2.2DGGE图谱多样性分析24份胎粪标本提取细菌DNA后行PCR扩增失败,故未行DGGE分析。其余3个时点(d3、d5、d7) 72份粪便标本经分析得到DGGE图谱(图1)。其中哌拉西林组d5、d7时点的条带数低于对照组(d5: 90 vs 119条; d7: 62 vs 125条),d3时点的条带数哌拉西林组和对照组分别为62和61条。
哌拉西林组d3、d5、d7时点的条带丰富度中位数(P25,P75)分别为5.50(3.50~7.00)、7.50(5.75~9.25)和3.50 (2.00~8.25),对照组分别为4.50(2.75~7.25)、10.00 (8.00~12.25)和11.00(8.00~14.00),其中d7时点条带丰富度哌拉西林组显著低于对照组(Z =-3.229,P = 0.001),d3、d5时点条带丰富度两组差异均无统计学意义。
哌拉西林组d3、d5、d7时点的Shannon指数中位数(P25,P75)分别为1.64(1.16~1.92)、1.97(1.69~2.20)和1.22(0.69~2.10),对照组分别为1.39(0.94~1.94)、2.24(2.07~2.49)和2.38(2.07~2.61),其中d5时点的Shannon指数哌拉西林组略低于对照组,但差异无统计学意义(Z =-1.850,P = 0.068),d7时点的Shannon指数显著低于对照组(Z =-3.133,P =0.001)。
随日龄增加,对照组Shannon指数逐渐升高;哌拉西林组Shannon指数呈降低趋势,d7时点Shannon指数低于d3时点水平,但差异无统计学意义(P>0.05)。
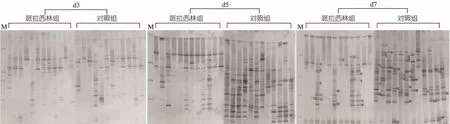
图1 哌拉西林组与对照组在3、5、7日龄时点的粪便细菌DNA 16S rDNA PCR-DGGE结果
2.3细菌种属组成分布对d7时点的DGGE图谱(图1)的条带行细菌种类分析,切胶回收优势细菌片段序列在Blast上比对分析显示,序列一致性达95%~100%,结果如表1及表2所示。其中哌拉西林组62个条带共检测出无法培养及可培养的5个菌属,对照组125个条带共检测出无法培养及可培养的7个菌属。表3显示,两组均以克雷伯菌属占绝对优势,哌拉西林组和对照组分别为35.5%和42.4%;乳酸杆菌属检出率较低,哌拉西林组和对照组分别为1.6%和0.8%;与对照组相比,哌拉西林组肠球菌属及链球菌属比例明显增加(P<0.05),肠杆菌比例明显降低(P<0.05),未检测到韦荣球菌属及梭菌属。
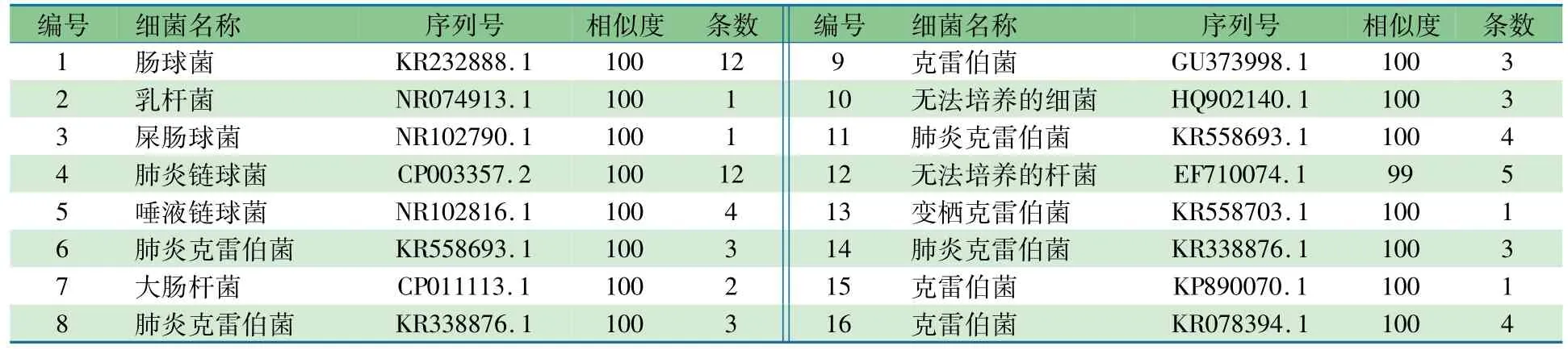
表1 哌拉西林组DGGE胶回收测序对比结果
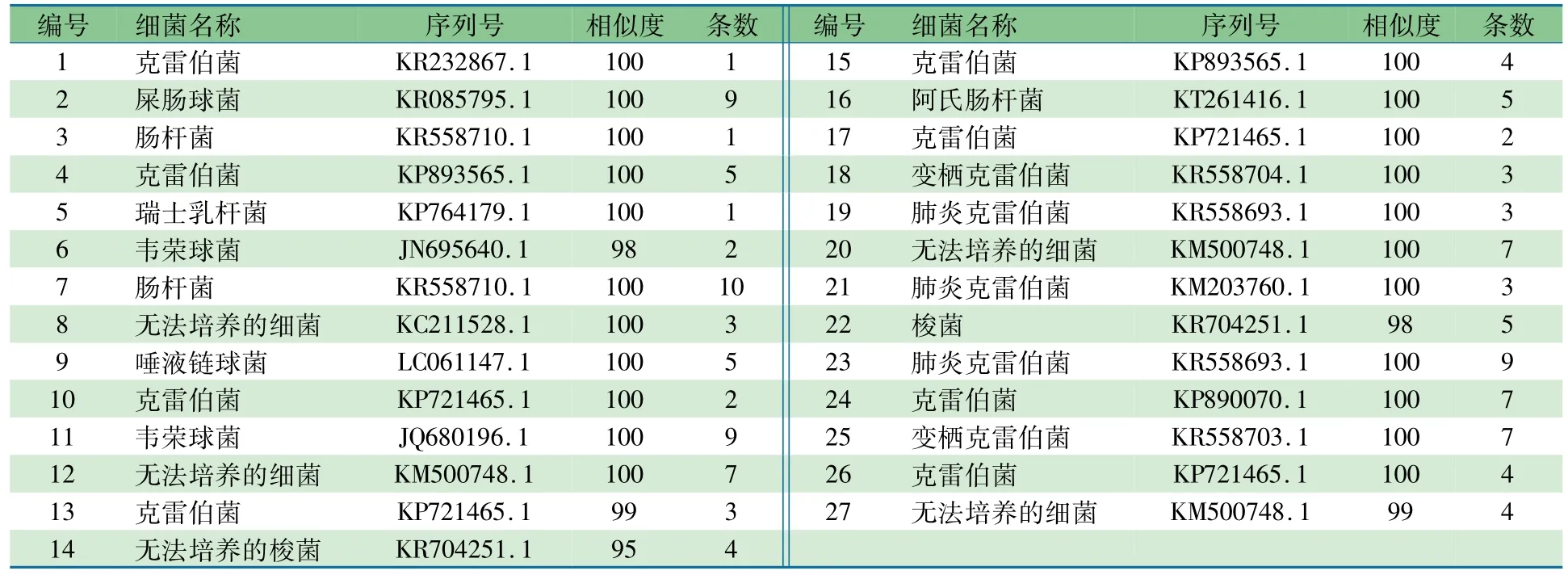
表2 对照组DGGE胶回收测序对比结果
3 讨论
肠道菌群在人体健康中的作用十分重要,与营养吸收及代谢、免疫系统维护息息相关;同时菌群失衡亦与许多疾病相关,如Ⅰ型糖尿病、过敏及肥胖等[5]。在新生儿期,肠道菌群处于动态变化的特殊时期,其定植和构成不仅受到胎龄、生产方式和喂养方式等因素影响,还与接受的治疗有关[6]。早产儿易受病原体感染,故临床上因不能除外败血症,常在早产儿生后给予经验性抗生素治疗。

表3 细菌种属组成构成比[n(%)]
早产儿早期感染常由大肠埃希菌等革兰阴性菌引起[7,8],但也不能完全除外革兰阳性菌,故常选择针对革兰阴性菌的广谱抗生素如哌拉西林-他唑巴坦经验性治疗,本研究也选择该药探讨其对早产儿早期肠道菌群的影响,结果显示哌拉西林组3 d内对菌群多样性影响较小,7 d时点肠道菌群多样性明显低于对照组,且肠道细菌的种类也有明显差异,提示随抗生素使用时间延长,其对肠道菌群的影响明显。同时观察到随日龄的增加,对照组肠道菌群多样性呈升高趋势,而使用抗生素早产儿菌群多样性有降低趋势,提示抗生素会导致肠道菌群的种类减少。Greenwood等[9]研究报道,极低出生体重儿经验性应用抗生素会导致其生后1月龄时菌群多样性的降低,与本文结果类似。且有研究发现菌群多样性的降低可能与NEC发生相关[10],生后经验性应用抗生素也与早产儿NEC及晚发败血症的发生相关[2]。提示经验性使用抗生素后,应在确认排除感染后及时停用,以减轻其对肠道菌群的影响。
本研究结果显示,克雷伯菌属在早产儿粪便菌群中占主要地位,与Schwiertz等[11]和唐小丽等[12]研究结果一致。对比哌拉西林组和对照组的菌群结构发现,肠球菌属及链球菌属在哌拉西林组的比例明显高于对照组,这可能是由于抗生素的选择作用所致。肠球菌细胞壁坚厚,对许多抗菌药物大多表现为固有耐药,加之多数链球菌为致病菌,抗生素可将肠道内共生菌杀灭,从而导致了上述耐药细菌及致病菌的过度生长。对照组由于没有抗生素的作用,其细菌种类相对较多,韦荣球菌属及梭菌属均有检测到。
益生菌被认为是定植在肠道内对机体有益的微生物,有研究表明益生菌制剂可降低早产儿NEC的发生率[13],出生后随着需氧菌的定植消耗肠道内的氧气,才使得益生菌等厌氧菌得以生存,肠道内常见的益生菌主要是乳酸杆菌及双歧杆菌,且双歧杆菌在肠道内的出现与胎龄相关,多出现在≥33周早产儿中[14]。本研究中未检测到双歧杆菌,乳酸杆菌也仅在2例>34周的早产儿出现,但由于例数太少,无法推断其与胎龄的关系。本研究益生菌检出率低,可能与早产儿肠道功能不成熟、细菌定植延迟有关。
本研究胎粪标本经细菌通用引物多次PCR失败,表明其中细菌存在较少,传统观念认为,出生时肠道内是无菌的,出生后周围环境及母亲的细菌迅速在肠道定植,但Mshvildadze等[10]发现胎粪中也有细菌的存在,认为其来源于子宫。同时有研究[15]通过粪便培养的办法在≤32周早产儿自然排出的胎粪标本中也检测到杆菌及厚壁菌门,其中葡萄球菌属占主要地位。上述研究与本研究结果差异较大,可能主要是不同方法检验敏感度不同所致。
本研究的不足之处:仅收集到早产儿生后1周内粪便标本,无法判断抗生素对菌群的长期影响。
参考文献
[1]Polin RA; Committee on Fetus and Newborn.Management of neonates with suspected or proven early-onset bacterial sepsis.Pediatrics,2012,129(5) : 1006-1015
[2]李阳,余加林,艾青,等.早产儿坏死性小肠结肠炎肠道菌群多样性及其动态研究.中国循证儿科杂志,2014,9 (2) : 117-121
[3]杨静丽,余加林,王政力,等.16S rDNA-变性梯度凝胶电泳技术与临床培养方法对比分析儿童阑尾炎组织菌群多样性.中国循证儿科杂志,2014,9 (1) : 23-27
[4]Ley BE,Linton CJ,Bennett DM et al.Detection of bacteraemia in patients with fever and neutropenia using 16S rRNA gene amplification by polymerase chain reaction.Eur J Clin Microbiol Infect Dis,1998,17(4) : 247-253
[5]Neu J,Douglas-Escobar M,Lopez M.Microbes and the developing gastrointestinal tract.Nutr Clin Pract,2007,22(2) : 174-182
[6]Penders J,Thijs C,Vink C,et al.Factors influencing the composition of the intestinal microbiota in early infancy.Pediatric,2006,118(2) : 511-521
[7]Labenne M,Michaut F,Gouyon B,et al.A population-based observational study of restrictive guidelines for antibiotic therapy in early-onset neonatal infections.Pediatr Infect Dis,2007,26(7) : 593-599
[8]董文辉,余加林.新生儿抗菌药物经验性预防使用.儿科药学杂志,2013,19(10) : 49-53
[9]Greenwood C,Morrow AL,Lagomarcino AJ,et al.Early empiric antibiotic use in preterm infants is associated with lower bacterial diversity and higher relative abundance of Enterobacter.J Pediatr,2014,165(1) : 23-29
[10]Mshvildadze M,Neu J,Shuster J,et al.Intestinal microbial ecology in premature infants assessed with non-culture-based techniques.J Pediatr,2010,156(1) : 20-25
[11]Schwiertz A,Gruhl B,Lobnitz M,et al.Development of the intestinal bacterial composition in hospitalized preterm infants in comparison with breast-fed,full-term infants.Pediatr Res,2003,54(3) : 393-399
[12]唐小丽,余加林,艾青,等.肠道菌群多样性在喂养不耐受新生儿中的作用.第三军医大学学报,2014,36(20) : 2133-2137
[13]Claud E,Walker A.Bacterial colonization,probiotics,and necrotizing enterocolitis.J Clin Gastroenterol,2008,42(2) : S46-52
[14]Butel MJ,Suau A,Campeotto F,et al.Conditions of bifidobacterial colonization in preterm infants: a prospective analysis.J Pediatr Gastroenterol Nutr,2007,44(5) : 577-582
[15]Moles L,Gomez M,Heilig H,et al.Bacterial diversity in meconium of preterm neonates and evolution of their fecal microbiota during the first month of life.PLoS One,2013,8 (6) : 1-13
(本文编辑:丁俊杰)
Effect of initial empirical antibiotic treatment on the intestinal microbiota of preterm infants
ZHU Dan-ping1,DU Li-zhong2,YU Jia-lin1,AI Qing1,XIAO Sa1,CHENG Chen1,ZHANG Yun-hui1,HE Yu1,PAN Yun1,SONG Si-jie1(1 Department of Neonatology,Children' s Hospital of Chongqing Medical University; Ministry of Education Key Laboratory of Child Development and Disorders; Key Laboratory of Pediatrics in Chongqing; Chongqing International Science and Technology Cooperation Base of Child Development and Critical Disorders,Chongqing 410014,China; 2 The Children's Hospital of Zhejiang University School of Medicine,Hangzhou 310003,China)
Corresponding Author: YU Jia-lin,E-mail: yujialin486@126.com
AbstractObjective To analyze the effect of empirical antibiotic therapy on the intestinal microbiota of preterm infants and its dynamic change by 16S rDNA PCR-denaturing gradient gel electrophoresis(DGGE).Methods In the period from January 2014 to January 2015,twenty-four hospitalized preterm infants in Children's Hospital of Chongqing Medical University were enrolled and divided into piperacillin-tazobactam treatment (PT) group and antibiotic free (AF) group.The meconium and fecal samples on d3,d5 and d7 were collected during the first week of life.After DNA extraction and PCR amplification,the microbial community diversity was analyzed through DGGE fingerprints.The distributions of common dominant bacteria were investigated by TA cloning and sequencing.Results A total of 96 fecal samples were analyzed.The amplification of bacterial DNA from 24 meconium(<12 h) was failed and DGGE analysis was not performed.①The median (P(25)-P(75)) of Shannon index of PT group on d3,5 and 7 was 1.64 (1.16-1.92)、1.97 (1.69-2.20) and 1.22 (0.69-2.1) respectively,and that of AF group at the same time point was 1.39 (0.94-1.94)、2.24 (2.07-2.49) and 2.38 (2.07-2.61).On d3 and d5 of postnatal life,PT and AF infants did not differ in the diversity index of the fecal bacterial community,but on d7,the Shannon index of PT group was significantly lower than that of the AF group(P<0.05).②The result of DGGE at all the 3 time points showed that the Shannon index of AF group gradually increased during the first week of life,while the Shannon index of PT group had a tendency of decrease.③The bacterial composition on day 7 from DGGE fingerprint showed that Klebsiella sp.was dominant (35.5% and 42.4%) and the proportion of lactobacillus sp.was low (1.6% and 0.8%) in both groups.The proportions of Enterococcus sp.and Streptococcus sp.in PT group were higher (21.0% vs 7.2%,25.8% vs 4.0%),while the proportion of Enterobacter sp.was lower than that of AF group (3.2% vs 12.8%).Veillonella sp.and Clostridium sp.could only be detected in the AF group.Conclusion The gutbook=27,ebook=30microbiota of preterms has a simple structure.The antibiotic therapy can reduce the diversity.
Key wordsPreterm infant; Gut microbiota; Antibiotic; Denaturing gel gradient electrophoresis
(收稿日期:2015-10-30修回日期: 2016-01-16)
通讯作者余加林,E-mail: yujialin486@126.com
基金项目国家自然科学基金: 81370744,81571483;“十二五”国家科技支撑计划项目之课题五: 2012BAI04B05
DOI:10.3969/j.issn.1673-5501.2016.01.007
