2,6-二硝基-3,7-二硝亚胺基-2,4,6,8-四氮杂双环[3.3.0]辛烷的合成及性能
2016-05-08王长英胡炳成金兴辉
王长英, 胡炳成, 金兴辉
(南京理工大学化学与化工学院, 江苏 南京 210094)
1 引 言
含能材料是武器装备的重要能源,研发高能量、低感度的高能量密度化合物(HEDC)[1]是含能材料领域的永恒主题。近年来,新型HEDC层出不穷,如四硝基甘脲(TNGU)[2-3]、八硝基立方烷(ONC)[4]、六硝基六氮杂异伍兹烷(CL-20)[5]、1,3,3-三硝基氮杂环丁烷(TNAZ)[6]等,能量高,密度大,具有良好的氧平衡、热稳定性和环境友好性,得到了广泛关注[7-9]。但是,这些化合物也存在一些缺陷,如感度较高、水解稳定性较差、合成步骤复杂、成本较高等。如TNGU的爆轰性能(爆速,8.8 km·s-1; 爆压,37.8 GPa)[10-11]接近HMX(爆速,9.1 km·s-1; 爆压,39.0 GPa)[12],但是TNGU分子中含有两个羰基官能团,受其双侧强吸电性的硝基官能团的影响,容易水解成小分子的硝基化合物,导致该化合物在潮湿环境下极不稳定,严重制约了其应用范围[13-14]。理论研究表明[15],将TNGU分子中的羰基置换成硝亚胺基可以改善化合物的水解稳定性,并提高其爆轰性能。
基于此,本研究根据TNGU的结构,设计出新型HEDC分子2,6-二硝基-3,7-二硝亚胺基-2,4,6,8-四氮杂双环[3.3.0]辛烷(四硝基甘胍,TNGG,Scheme 1),并以二硝基甘胍、乙酸酐为原料,经酰化及硝化反应合成得到TNGG。通过核磁共振、红外光谱及质谱对TNGG及其中间体的结构进行了表征; 考察了反应时间、反应温度和不同硝化体系对目标产物产率的影响,确定了最佳反应条件; 采用热重分析仪(TG)和差示扫描量热仪(DSC)考察了TNGG的热性能。
2 实验部分
2.1 仪器及试剂
药品及试剂: 五氧化二磷、无水硫酸镁、乙酸乙酯、N,N-二甲基甲酰胺(DMF)、乙酸酐、丙酮、98%的发烟硝酸,均为市售分析纯; 二硝基甘胍,参考文献[16]方法合成。
仪器: 500 MHz核磁共振仪,瑞士Bruker公司; Finnigan TSQ Quantum ultra AM型质谱仪,美国Thermal公司; IR-435型红外光谱仪,日本岛津; STA449C型热重分析仪,德国NETZSCH公司; DSC823e差示扫描热仪,瑞士METTLER TOLED公司。
2.2 合成路线
合成路线见Scheme 1。

Scheme1Synthetic route of TNGG
2.3 实验步骤
2.3.1 2,6-二乙酰基-3,7-二硝亚氨基-2,4,6,8-四氮杂双环[3.3.0]辛烷(1)的合成
称取2.30 g (0.01 mol) 二硝基甘胍置于装有温度计和磁力搅拌器的三口烧瓶中,加入30 mL DMF并逐渐升温至100 ℃,待原料完全溶解后向反应体系中缓慢加入10倍当量的乙酸酐,此时溶液由乳白色变为黑褐色,反应4 h。反应完毕后冷却至室温,将反应液倒入过量的冰水中。乙酸乙酯萃取(6×100 mL),合并有机相,无水硫酸镁干燥,旋蒸除去溶剂,粗品在乙酸乙酯/丙酮混合溶剂中重结晶得化合物1的白色晶体2.01 g,产率65.5%。
1H NMR (500 MHz, DMSO-d6)δ: 2.48 (s, 6H), 6.14 (s, 2H), 9.94 (s, 2H);13C NMR (125 MHz, DMSO-d6)δ: 26.11, 67.97, 156.67, 170.08; IR (KBr,ν/cm-1): 3430, 3246, 2141, 1728, 1701, 1581, 1512, 1454, 1362, 1212, 1029, 950, 890, 777, 721, 658, 573; ESI-MS (m/z): 313 [M-H]-。
2.3.2 TNGG的合成
取10 mL 98%的发烟硝酸于装有温度计和磁力搅拌器的三口烧瓶中,并将其置于-10~-15 ℃盐浴中。剧烈搅拌下将适量P2O5分批加入三口烧瓶中并搅拌至糊状。然后将3.14 g (0.01 mol)化合物1分批加入上述HNO3/P2O5硝化体系中。加毕,撤去盐浴,室温反应15 min。反应完毕,将反应液倒入过量的冰水中。乙酸乙酯萃取(6×100 mL),合并有机相,无水硫酸镁干燥,旋蒸除去溶剂得淡黄色固体。粗品在乙酸乙酯中重结晶得化合物TNGG的白色固体1.0 g,产率31.3%。
1H NMR (500 MHz, DMSO-d6)δ: 6.41 (s, 2H), 10.09 (s, 2H);13C NMR (125 MHz, DMSO-d6)δ: 67.68, 162.68; IR (KBr,ν/cm-1): 3396, 1817, 1588, 1536, 1469, 1273, 1134, 1056, 962, 887, 759, 700; ESI-MS (m/z): 319 [M-H]-。
3 结果与讨论
3.1 反应时间对TNGG产率的影响
在98%发烟硝酸/P2O5硝化体系,室温下,考察反应时间对TNGG产率的影响。结果如图1所示。从图1可知,随着反应时间的增加,TNGG的产率先增加后减少,当反应时间为15 min时,产率最高,为31.3%。随着时间的延长,产率下降,这可能是因为五元氮杂环破裂,副产物产生。
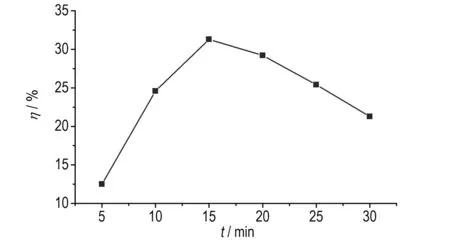
图1反应时间对TNGG产率的影响
Fig.1Effect of the reaction time on the yield of TNGG
3.2 反应温度对TNGG产率的影响
在反应时间为15 min,98%的发烟硝酸/P2O5硝化体系下,考察反应温度对TNGG产率的影响。结果如图2所示。从图2可知,随着反应温度的增加,目标化合物的产率也逐渐增加。当反应温度为室温(25 ℃)时,目标化合物的产率最大,温度持续升高,产率下降,这可能是因为温度过高导致TNGG分解。
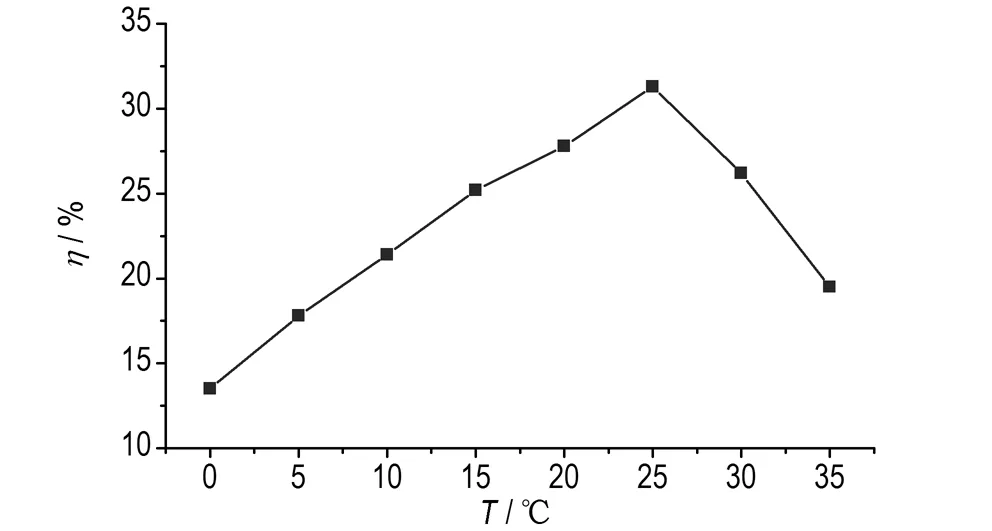
图2反应温度对TNGG产率的影响
Fig.2Effect of the reaction temperature on the yield of TNGG
3.3 不同硝化体系对硝化反应的影响
在反应时间15 min,室温条件下,采用不同的硝化体系对2,6-二乙酰基-3,7-二硝亚胺基-2,4,6,8-四氮杂双环[3.3.0]辛烷进行了硝化,结果见表1。由表1可知,采用98%发烟硝酸/P2O5作为硝化体系效果最好,这可能是因为该硝化体系既保证了足够的硝化能力,又能在P2O5的作用下及时除去反应过程生成的水,使反应朝着有利于产物的方向进行。100%硝酸硝化结果不好,可能是因为纯硝酸硝化能力较弱; 98%发烟硝酸/100%纯硝酸体系下得到粘稠状固体,难以分离检测; 98%发烟硝酸/发烟硫酸混酸硝化能力大、酸度太强,可能导致五元氮杂环的破裂,因此,硝化效果也不好。
表1不同硝化体系对硝化反应的影响
Table1Effect of different nitrification system on nitration reaction

nitrificationsystemproductfumingnitricacidrawmaterialsandlittleproduct100%HNO3rawmaterialsandlittleproduct98%HNO3/oleumviscoussolid98%fumingnitricacid/P2O5targetcompound,whitepowder
3.4 热性能
为了考察TNGG的热分解性能,采用TG和DSC对其热分解进行了测试(样品2.00 mg,升温速率15 ℃·min-1,温度范围50~800 ℃,高纯氮气30 mL·min-1)。结果如图3所示。

图3TNGG的TG-DSC曲线
Fig.3TG-DSC curves of TNGG
由图3可知,TNGG两个失重阶段: 第一阶段的失重起始温度为141.8 ℃,失重约为60%且失重较为迅速; 第二失重阶段的温度范围比较宽泛(245~700 ℃),整个过程失重约为100%,化合物完全分解。DSC曲线表明,该化合物不存在熔融峰,只在182.6 ℃附近存在一个尖锐的放热峰,曲线积分计算得其放热量为2820.0 J·g-1。
3.5 爆压、爆速和爆热
采用Kamlet-Jacobs公式[17]计算目标化合物爆速、爆压和爆热。

采用比重瓶[18]法,测得TNGG密度为1.96 g·cm-3。通过设计等键反应[19]计算获得的标准生成焓为733.9 kJ·mo-1。基于密度得到的TNGG的爆速为9.76 km·s-1,爆压为44.0 GPa,其爆轰性能明显优于HMX(密度,1.91 g·cm-3; 爆速,9.1 km·s-1; 爆压,39.0 GPa)[12],符合高能量密度化合物的特性。
3.6 水解稳定性
TNGG的结构与TNGU的结构非常相似,且密度和爆轰性能均超过TNGU(密度,2.00 g·cm-3; 爆速,8.8 km·s-1; 爆压,37.8 GPa)[10-11]。采用Gaussian 03[20]程序包,在B3LYP/6-31G(d,p)水平下分别计算了TNGU和TNGG两种化合物中端位C原子的正电荷分布情况(如图4所示)。由图4可见,TNGU分子中端位C原子的正电荷数为0.830,TNGG分子中端位C原子的正电荷数为0.628,说明TNGG分子端位C原子缺电子性较TNGU有所降低,因此,TNGG与水等亲核试剂反应的活性低于TNGU; 另一方面,TNGG分子中—CN—NO2官能团的体积大于TNGU分子中—CO官能团,从空间效应来看有效阻止了水分子的“进攻”。综合上述两方面的原因,TNGG具有比TNGU更好的水解稳定性。
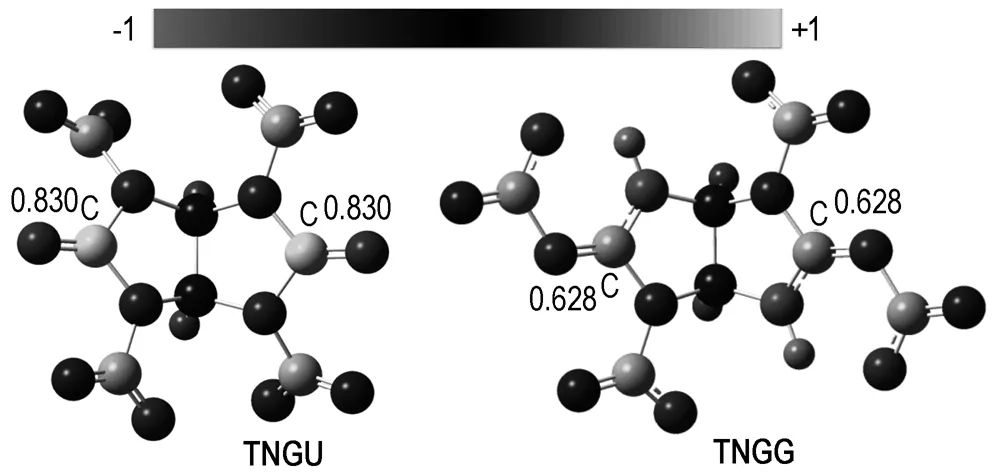
图4TNGU和TNGG分子的端位C原子电荷
Fig.4The charges of top carbon atoms of TNGU and TNGG
4 结 论
(1) 以二硝基甘胍为原料,乙酸酐为酰化试剂,经酰化及硝化反应合成一种新型化合物: TNGG,最佳工艺条件: 反应时间为15 min,反应温度为25 ℃,98%发烟硝酸/P2O5的硝化体系。该化合物合成步骤简单且原料易得,有望得到广泛应用。
(2) TNGG的热分解过程在700 ℃内完成,整个过程失重约为100%,182.6 ℃附近存在一个尖锐的放热峰,表明其具有较好的热稳定性。
(3) 理论计算结果表明,TNGG水解稳定性优于TNGU。TNGG的生成焓733.9 kJ·mol-1,理论爆速为9.76 km·s-1,爆压为44.0 GPa,优于RDX和HMX,是一种性能优良的高能量密度化合物。
参考文献:
[1] 欧育湘,刘进全. 高能量密度化合物[M]. 北京: 国防工业出版社,2005: 15-19.
OU Yu-xiang, LIU Jin-quan. High energy density compounds[M]. Beijing: National Defence Industry Press, 2005: 15-19.
[2] 彭忠吉, 万道正. 四硝基甘脲及其水解产物的合成研究[J]. 兵工学报,1980, 18(2): 23-27.
PENG Zhong-ji, WAN Dao-zheng. The synthetic study of tetranitroglycoluril and its hydrolyzed product[J].ActaArmamentarii, 1980, 18(2): 23-27.
[3] Bioleau J, Emeury J L, Kehren J. Tetranitroglycoluril and method of preparation thereof:US4487938[P],1984-12-11.
[4] Zhang J, Xiao H. Computational studies on the infrared vibrational spectra, thermodynamic properties, detonation properties and pyrolysismechanism of octanitrocubane[J].TheJournalofChemicalPhysics, 2002, 116(24): 10674-10683.
[5] Mandal A K, Pant C S, Kasar S M,et al. Process optimization for synthesis of CL-20[J].JournalofEnergeticMaterials, 2009, 27(4): 231-246.
[6] 熊存良, 贾思媛, 刘愆, 等. 硝解N-叔丁基-3,3,-二硝基氮杂环丁烷硝酸盐制备TNAZ[J]. 含能材料, 2010, 18(2): 139-142.
XIONG Cun-liang, JIA Si-yuan, LIU Qian, et al. Preparation of TNAZ from nitrolysis ofN-tertbuty[3,3]dinitrozetidinium nitrate[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2010, 18(2): 139-142.
[7] Jochen Kerth, Stefan Löbbeckke. Synthesis and characterization of 3,3′-azobis(6-amino-1,2,4,5-tetrazine)DAAT: a new promising nitrogen-rich compound[J].Propellants,Explosives,Pyrotechnics, 2002, 27(3): 111-118.
[8] Hiskey M A, Goldman N, Stine J R. High-nitrogen energetic materials derived from azoretrazolate[J].JEnergMater, 1998, 16(2/3): 119-127.
[9] Zhang J G, Liang Y H, Xie S H,et al. Novel high -nitrogen energetic compound based on semicarbazide-substituted tetrazine[J].ChemicalResearchinChineseUniversties, 2012, 28(6): 931-935.
[10] Bioleau J, Emeury J L, Kehren J. Tetranitroglycoluril.Herstellungsverfahren dafuer und verwendung als explosivesivstoff:DE2435651[P].1975-02-06.
[11] Bioleau J, Emeury J L, Kehren J. Explosivstoffe auf der basis von dinitroglycoluril:DE2462330[P].1976-12-02.
[12] 欧育湘. 炸药学[M]. 北京: 北京理工大学出版社, 2006: 199-200.
OU Yu-xiang. Explosives[M]. Beijing: Beijing Institute of Technology Press, 2006: 199-200.
[13] Fang Y G, Wu G H. Synthesis and properties of 1,4-dinitro-3,6-bis(trinitroethyl)glycoluril[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 1997, 5(1): 9-14.
[14] 董树安,章国贞,陈博仁,等. 四硝基半甘脲的水解及其水解产物的稳定性[J] . 火炸药性学报,1997, 20(2): 60-61.
DONG Shu-an, ZHANG Guo-zhen, CHEN Bo-ren, et al. Hydrolysis of tetranitro-hemi-glycoluril and stability of the product[J].ChineseJournalofExplosive&Propellants, 1997, 20(2): 60-61.
[15] 金兴辉, 胡炳成, 贾欢庆, 等. 3,7-二硝亚胺基-2,4,6,8-四硝基-2,4,6,8-四氮杂双环[3.3.0]辛烷结构与性能的量子化学研究[J]. 高等学校化学学报,2013, 34(7): 1685-1690.
JIN Xing-hui, HU Bing-cheng, JIA Huan-qing, et al. Studies of quantum chemistry of structure and properties of 3,7-bis(nitroimino)-2,4,6,8-tetranitro-2,4,6,8-tetraazabicyclo[3.3.0] octane[J].ChemicalJournalofChineseUniversties, 2013, 34(7): 1685-1690.
[16] 贾欢庆. 1,2-二硝基胍、多硝基甘胍及其衍生物的合成研究[D]. 南京: 南京理工大学,2014.
JIA Huan-qing. Synthesis of 1, 2-dinitroguanidine, multi-nitroacetyleneguanidine and theirs derivatives[D]. Nanjing: Nanjing University of Science & Technology, 2014.
[17] Kamlet-Jacobs M J, Jacobs S J. A sample method for calculating detonation properties of CHNO explosives[J].JournalofPhysicalChemistry, 1968, 48(1): 23-25.
[18] 倪成锦. 比重瓶法测物质密度[J]. 鞍山师范学院学报,1991, 12(3): 51-53.
NI Cheng-jin. The material density by pycnometer method[J].JournalofAnshanNormalUniversity, 1991, 12(3): 51-53.
[19] Wang F, Wang G X, Du H C,et al. Theoretical studies on the heats of formation,detonation properties,and pyrolysis mechanisms of energetic cyclic nitramines[J].JPhysChemA, 2011, 115(47): 13858-13864.
[20] Frisch M J, Trucks G W, Schlegel H B,et al. Gaussian 03[CP]; Gaussian, Inc.: Wallingford, CT, 2003.
