蜈蚣提取物抗肺癌活性的体内外实验研究
2016-05-07陈园艾小佳王志琪田莎周青裴刚田雪飞
陈园 艾小佳 王志琪 田莎 周青 裴刚 田雪飞
摘要:目的 探讨蜈蚣提取物对人肺癌A549细胞的增殖抑制、凋亡诱导及裸小鼠皮下移植瘤生长的抑制作用。方法 采用酶解法合丙酮沉淀法分离纯化蜈蚣提取物处理人肺癌A549细胞,MTT法检测细胞增殖抑制并计算半数抑制率(IC50),流式细胞术检测细胞凋亡和细胞周期变化,Hoechst荧光染色观察细胞凋亡的形态变化。制备人肺癌细胞裸小鼠皮下移植瘤模型,随机分为模型组、对照组和蜈蚣提取物组,每组10只,观察裸小鼠皮下移植瘤瘤体体积、质量及抑瘤率变化。结果 体外实验结果显示,蜈蚣提取物对人肺癌A549细胞有明显的增殖抑制作用,IC50为0.603 mg/mL;蜈蚣提取物作用48 h后,细胞周期表现为G0/G1期细胞比例下降,S期与G2/M期细胞比例均升高,与对照组比较差异有统计学意义(P<0.01);Hoechst荧光染色可观察到明显的凋亡细胞及凋亡特征性的形态学改变;动物体内抑瘤实验结果发现,经蜈蚣提取物治疗后,瘤体质量与体积显著减少,与模型组比较差异有统计学意义(P<0.01)。结论 蜈蚣提取物对人肺癌A549细胞具有浓度依赖性增殖抑制作用,可诱导细胞凋亡,使A549细胞停滞于G2/M期,并能有效抑制人肺癌裸小鼠皮下移植瘤的生长。
关键词:蜈蚣提取物;肺癌;细胞凋亡;移植瘤;小鼠
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2016)05-0061-03
Study on Anti-lung Cancer Efficiency of Centipede Extracts in Vitro and Vivo Experiments CHEN Yuan1, AI Xiao-jia1, WANG Zhi-qi1, TIAN Sha1, ZHOU Qing2, PEI Gang1, TIAN Xue-fei1 (1. Hunan University of Chinese Medicine, Changsha 410208, China; 2. The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha 410007, China)
Abstract: Objective To investigate efficiency of centipede extracts on apoptosis induction, proliferation inhibition to Human A549 cell line and growth suppression of subcutaneous transplanted sarcoma in nude mice. Methods Centipede extracts prepared by enzymolysis and acetone precipitation methods were used to treat human lung cancer A549 cell line. Proliferation inhibition was evaluated by MTT assay and half inhibit concentration (IC50) was calculated. Cell morphological change and apoptosis were detected by flow cytometry and Hoechst stain. The subcutaneous transplanted sarcoma models were prepared with nude mice and randomly divided into model group, control group and centipede extracts group, with 10 mice in each group. Changes of tumor volume, quality and anti-tumor rate were observed. Results In vitro experiment, proliferation of A549 cells was inhibited with dose-dependency and IC50 value was 0.603 mg/mL. The G0/G1 phase of cells was down regulated and G2/M and S phase cells were up-regulated. The apoptotic character cells were been found by Hoechst stain. In vivo experiment, the tumor weight and volume decreased significantly compared with model control group, with statistical significance (P<0.01). Conclusion The centipede extracts shows dose-dependent anti-proliferative effect on A549 cells, which can induce apoptosis by arresting A549 cells at G2/M phase and suppressing growth of subcutaneous transplanted sarcoma of lung cancer in nude mice.
Key words: centipede extracts; lung cancer; apoptosis; implanted tumor;mice
基金项目:国家自然科学基金(81473617);湖南省自然科学基金重点项目(13JJ2032);湖南省教育厅重点资助项目(10A089)
通讯作者:田雪飞,E-mail:windsame@163.com
肺癌已成为全球严重威胁人类健康与生命的恶性肿瘤,其发病率和病死率位居首位[1]。肺癌属中医“肺积”“咳嗽”“积聚”等范畴。徐振晔认为本病最基本的病理机制是癌毒痰瘀胶结于肺部,实证多为毒聚、痰凝、气滞、血瘀[2]。刘伟胜提出肺癌发病基础是正虚,直接因素是癌毒,治宜扶正配以软坚散结、清化瘤毒[3]。胡国良认为,凡肿瘤皆邪气密结不散,属实证,主张攻补兼施,攻以峻猛攻毒散结,补以甘温补益[4]。虫类药抗肿瘤作用一直颇受关注,蜈蚣作为一种重要的虫类药物,其攻毒散结的功效在临床治疗肺癌中药复方配伍中应用广泛[5-6]。本实验对蜈蚣有效成分的分离纯化、抗肺癌活性进行了研究,现报道如下。
1 材料与方法
1.1 动物
SPF级纯系BALB/C-nu/nu雄性裸小鼠30只,4~6周龄,体质量(20±3)g,重庆斯莱康动物药业有限公司,许可证号SCXK(湘)2009-0004。饲养于湖南中医药大学动物实验中心SPF级实验室。
1.2 细胞株
人肺癌A549细胞株,购于湘雅医学院细胞中心。用含12%胎牛血清(FBS)的高糖DMEM培养基,置37 ℃、5%CO2饱和湿度的恒温孵育箱中培养。
1.3 药物及制备
少棘蜈蚣,湖南中医药大学第一附属医院药剂科,提取物制备参照文献[7]方法改进。蜈蚣超微粉末2 g,55 ℃蛋白酶酶解后,99 ℃水浴中灭活10 min,4 ℃、5000 r/min离心10 min,取上清液,2倍体积预冷丙酮沉淀,4℃、5000 r/min离心10 min,取沉淀,超纯水充分溶解沉淀,重复2次。收集最后沉淀,超纯水溶解,加2倍体积预冷丙酮,取沉淀,30 ℃真空干燥成粉末,-20 ℃冻存备用。顺铂,齐鲁制药有限公司,批号5110351DB。
1.4 主要试剂及仪器
高糖DMEM培养基(美国GIBCO公司),FBS(美国INVITROGEN公司),磷酸盐缓冲液(PBS,武汉博士德有限公司),二甲基亚砜(DMSO,美国AMRESCO公司),噻唑蓝(MTT)、Hoechst33342荧光染料(美国SIGMA公司)。CO2培养箱(美国Therrmo公司),Elx808型酶标仪(美国BioTek公司),BX20型荧光显微镜摄像机(日本Olympus公司),FACScan型流式细胞仪(美国BD公司)。
1.5 细胞增殖抑制率测定
取对数生长期A549细胞制成单细胞悬液,调整浓度为5×104个/mL,接种于96孔板,每孔200 μL,蜈蚣提取物干预设置7个浓度梯度(2.500、1.250、0.625、0.313、0.15、0.078、0.039 mg/mL),同时设对照组和空白组(调零孔),均设5个复孔,其中对照组接种细胞加入完全培养基,空白组只加入完全培养基。MTT法检测参照说明进行,计算细胞生长抑制率(%)[1-(OD值药物组÷对照组OD值)]×100%,采用直线回归方程计算半数抑制率(IC50)。
1.6 细胞凋亡及细胞周期检测
取对数生长期A549细胞,浓度为1×105个/mL,接种于6孔培养板中,设置蜈蚣提取物组和对照组,其中蜈蚣提取物组加入IC50浓度药液处理,对照组加入等量完全培养基,每孔2 mL。蜈蚣提取物处理48 h后流式细胞术检测细胞凋亡率和细胞周期。Hoechst荧光染色观察细胞凋亡形态。
1.7 人肺癌裸小鼠皮下移植瘤模型制备
取对数生长期A549细胞,浓度为1×107个/mL,接种于裸小鼠背部皮下,每只0.2 mL,接种后第7日成瘤。将30只裸小鼠随机分为模型组、蜈蚣提取物组、顺铂组,每组10只。接种后第8日给予药物灌胃,动物给药量按人和动物体表面积折算为成人5倍剂量。取蜈蚣提取物12 mg加入生理盐水至8 mL,配成含0.06 g原药材/mL药液,每次灌胃0.4 mL/只,2次/d;顺铂组予2 mg/kg剂量腹腔内注射,1次/3 d;模型组予等剂量生理盐水灌胃。连续18 d。各组小鼠治疗后第19日脱颈处死。实验过程中观察动物一般的状况,绘制肿瘤体积增长曲线并计算其抑瘤率。抑瘤率(%)=(模型组平均瘤质量-治疗组平均瘤质量)÷模型组平均瘤质量×100%。
1.8 统计学方法
采用SPSS19.0统计软件进行分析。实验数据以—x±s表示,2组间比较采用成组t检验;多组比较采用方差分析,组间比较采用SNK法。P<0.05表示差异有统计学意义。
2 结果
2.1 一般情况
蜈蚣提取物组动物给药期间饮食、精神可,对外界刺激反应灵敏,大小便正常;顺铂组给药后第4日出现饮食减少,精神尚可,对外界刺激反应尚灵敏,大便稍溏,小便正常;模型组第3日后开始出现消瘦,精神欠佳,对外界刺激反应不灵敏,饮食饮水量减少,大便溏,小便正常。
2.2 蜈蚣提取物对人肺癌A549细胞增殖抑制、细胞周期及诱导凋亡的影响
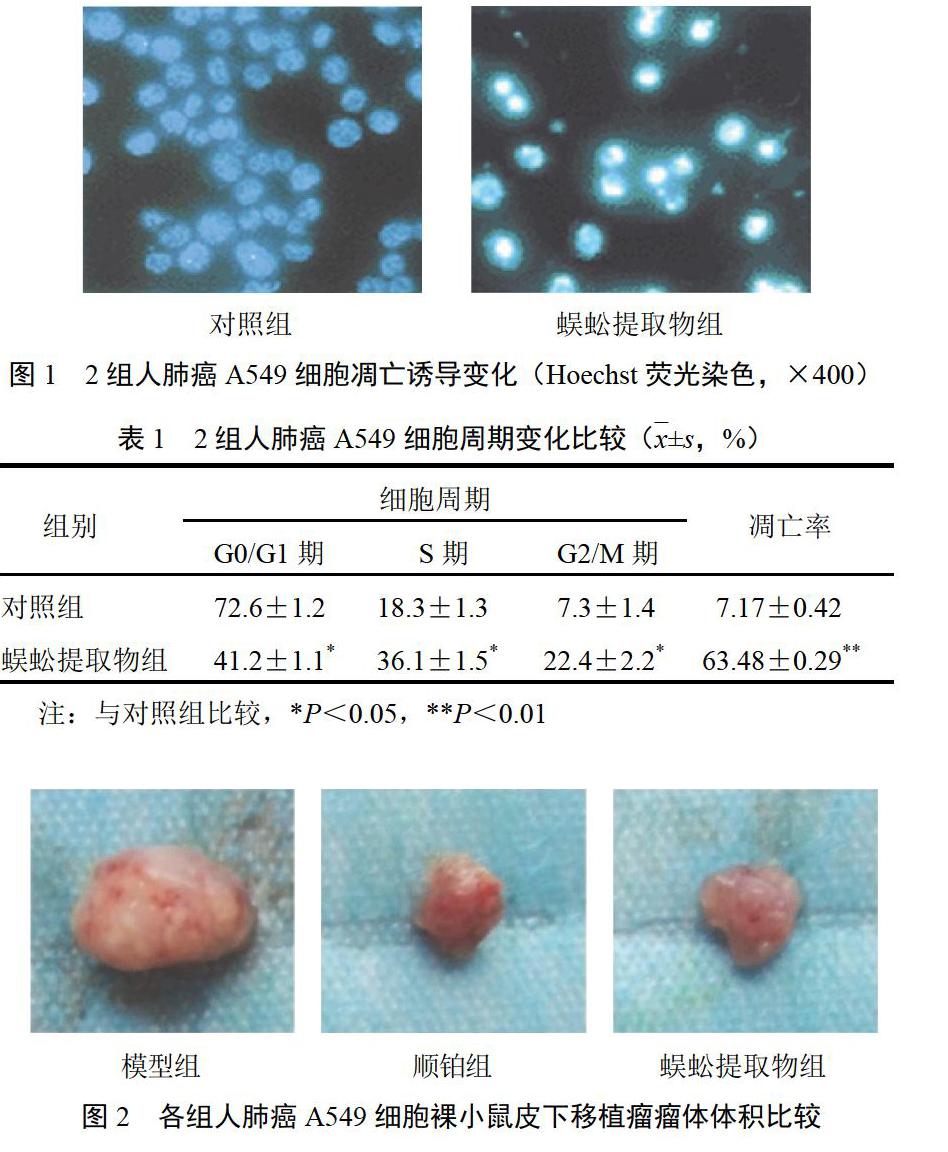
MTT法检测结果显示,蜈蚣提取物对人肺癌A549细胞增殖有明显抑制作用(P<0.05),呈剂量依赖性。蜈蚣提取物增殖抑制率回归方程为:Y=24.807X+35.174。经计算IC50为0.603 mg/mL。以IC50浓度蜈蚣提取物作用于人肺癌A549细胞48 h后,与对照组比较,G0/G1期细胞百分含量下降,S期与G2/M期细胞比例均升高(P<0.05)。Hoechst荧光染色结果显示,蜈蚣提取物处理后A549细胞出现核染色质浓缩、凝聚,密度升高,细胞核被致密浓染,出现颜色发白等特征性凋亡表现,见图1。流式细胞仪检测结果显示,蜈蚣提取物组可见大量细胞凋亡,凋亡率达63.48%。结果见表1。
2.3 蜈蚣提取物对人肺癌A549细胞裸小鼠皮下移植瘤瘤体体积、质量及抑瘤率的影响
灌胃过程中测量皮下移植瘤第8、16、25日体积,蜈蚣提取物组分别为(126.0±11.2)、(171.5±13.3)、(196.0±20.8)mm3,顺铂组分别为(113.7±8.9)、(134.5±9.1)、(183.8±13.5)mm3,模型组分别为(320.0±24.6)、(786.5±31.1)、(1912.5±56.4)mm3,蜈蚣提取物组和顺铂组皮下移植瘤体积生长速度较模型组明显减慢(P<0.01),见图2。给药18 d后,蜈蚣提取物组皮下移植瘤瘤体质量为(2.94±0.76)g明显低于模型组[(4.65±0.91)g](P<0.05);与顺铂组[(2.52±0.69)g]比较无明显差异;蜈蚣提取物组抑瘤率为36.77%较顺铂组45.81%比无明显差异。
3 讨论
蜈蚣是我国传统名贵中药材,现代药理研究显示,蜈蚣具有降低血黏度、抗炎、抗菌、镇痛、抗惊厥等多种作用[8]。蜈蚣具有“攻毒散结”的功效特点,以复方配伍的形式应用于恶性肿瘤的临床治疗[9-12]。
本研究对蜈蚣抗肺癌活性进行系列体内外实验,结果表明,蜈蚣提取物呈剂量依赖性抑制人肺癌A549细胞增殖,对肺癌细胞周期的影响主要表现为明显的G2/M期阻滞作用,使细胞有丝分裂受阻,阻碍DNA合成,促使其凋亡。体内裸小鼠皮下移植瘤实验结果也提示,蜈蚣提取物能减缓肿瘤生长速度,抑瘤率达36.77%,其疗效与顺铂45.81%比较差异无统计学意义。
综上所述,蜈蚣提取物体外可抑制肺癌细胞A549的增殖并诱导其凋亡,体内可抑制皮下移植瘤的生长速度,显示蜈蚣具有良好的抗肺癌活性。
参考文献:
[1] DIMOU A, PAPADIMITRAKOPOULOU V. Non-small cell lung cancer beyond biomarkers:the evolving landscape of clinical trial design[J]. J Pers Med,2014,4(3):386-401.
[2] 邓海滨,王中奇.徐振晔辨治肺癌经验[J].四川中医,2002,20(6):1-2.
[3] 金智慧.刘伟胜教授治疗肺癌的临床经验及用药规律研究[D].广州:广州中医药大学,2013.
[4] 陈延武,樊惠连.胡国良老中医临证经验总结[J].湖南中医杂志, 1998,14(3):27-28.
[5] 陈劲智,刘志霞,涂思义.补肺通络解毒汤联合西药治疗肺癌随机平行对照研究[J].实用中医内科杂志,2014,28(9):68-70.
[6] 吴心力,贾英丽,宋彩红.白金消积胶囊对肺癌小鼠血小板活化作用的影响[J].中国中医药科技,2014,21(2):156.
[7] 孙婧,田雪飞.四味归肝经虫类中药对肝癌HepG2细胞增殖抑制作用对比研究[J].中国中医药现代远程教育,2010,8(16):161-162.
[8] WENHUA R, SHUANGQUALL Z, DAXIALLG S, et al. Induction, purification and charecterization of all antibacterial peptide Scolopendrilans[J]. Indian J Biochem Biophys,2006,43(2):88-93.
[9] 靳冬民.自拟肺癌方治疗晚期肺癌临床研究[J].中医学报,2013, 28(10):1440-1442.
[10] 唐静雯,裴俊文,田同德,等.疏肝解毒活血汤联合西药治疗中晚期原发性肝癌31例[J].中医研究,2014,27(7):26-28.
[11] 朴钟元,金昇谦,陶盟.中药配合化疗治疗晚期胃癌92例[J].光明中医,2013,28(11):2359-2360.
[12] 周世明.重用全蝎蜈蚣治疗难治性疼痛[J].中国中医药咨讯,2010, 2(7):91.
