二氢青蒿素抑制胰腺癌PANC-1细胞GLUT1表达的实验研究*
2016-05-07温桂海王涛朱涛
温桂海 王涛 朱涛
二氢青蒿素抑制胰腺癌PANC-1细胞GLUT1表达的实验研究*
温桂海1王涛1朱涛2
(1.邯郸市中心医院普外一科, 河北 邯郸 056001;2.四川大学华西医院, 成都 四川 610041)
目的 研究二氢青蒿素对胰腺癌PANC-1细胞的抑制作用和对GLUT1表达的调节作用及相关的信号通路。方法 使用不同浓度的二氢青蒿素(0μM、10μM和60μM)对胰腺癌PANC-1细胞进行干预。在不同时间点(0 h、24h和48h)使用MTT法对PANC-1细胞活性进行测定。在干预48h后,使用qPCR对二氢青蒿素干预的PANC-1细胞GLUT1 mRNA的表达水平进行测定。使用western blot对二氢青蒿素干预的PANC-1细胞GLUT1蛋白表达水平以及PI3K和Akt磷酸化水平进行测定。结果 使用不同浓度二氢青蒿素(0μM、10μM和60μM)对胰腺癌PANC-1细胞进行干预后,细胞活性呈时间依赖性和浓度依赖性下降,差异均有统计学意义(P均<0.05)。二氢青蒿素干预48h后,胰腺癌PANC-1细胞GLUT1 mRNA和蛋白的表达水平以及PI3K和Akt磷酸化水平水平呈浓度依赖性的下降,差异均存在统计学意义(P均<0.05)。结论 本基础研究提示二氢青蒿素可以通过调控PI3K/Akt信号通路的活化水平下调胰腺癌PANC-1细胞GLUT1 mRNA和蛋白的表达,并对肿瘤细胞的增殖有显著抑制作用。该实验结果为进一步二氢青蒿素应用于胰腺癌等肿瘤的临床治疗奠定了一定的基础。
二氢青蒿素; 胰腺癌; PANC-1细胞; 葡萄糖转运蛋白1; PI3K; Akt
胰腺癌(pancreatic cancer)是最常见的消化系统恶性肿瘤之一,约占人类肿瘤发病率的2%左右,其中以导管细胞腺癌(duct cell carcinoma)最为常见[1-5]。由于胰腺解剖位置较深不易直接触及和发现,致使大多数胰腺癌患者就诊时已处于肿瘤的中晚期,多数以丧失根治性手术的时机。流行病学调查研究显示胰腺癌的5年生存率仅在15%~25%[1-5]。同时近期的临床研究发现由于人口老龄化及吸烟等环境因素,致使我国胰腺癌的发病率呈逐年上升趋势[1-5]。二氢青蒿素(dihydroartemisinin, DHA)是抗疟疾药青蒿素(Artemisinin)的衍生物,其同样具有显著的抗疟疾的药理价值。近期的研究发现除抗疟外二氢青蒿素还具有抑制炎症反应、抑制肿瘤增殖、分化、浸润以及促进肿瘤细胞凋亡和自噬的生物活性[6-10]。同时进一步的研究显示二氢青蒿素的抗肿瘤活性与调控PI3K/Akt信号通路密切相关[11-13]。本基础研究的目的是探讨二氢青蒿素对于胰腺癌PANC-1细胞增殖的影响及其相关的信号通路和分子机制。
1 材料和方法
1.1 主要试剂和材料 PCR试剂盒购自北京百泰克生物技术有限公司;鼠抗人GLUT1抗体、鼠抗人phospho-PI3K抗体、鼠抗人PI3K抗体、鼠抗人phospho-Akt抗体、鼠抗人Akt抗体和鼠抗人β-actin抗体购于美国Santa Cruz公司;二氢青蒿素购买于美国Sigma-Aldrich公司;DMEM培养基购买于美国Gibco公司;小牛血清购买于美国Hyclone公司;MTT试剂盒购买于美国Promega公司。
1.2 细胞培养 胰腺癌PANC-1细胞常规接种在含10% FBS、100g/L 青霉素、100 g/L链霉素的DMEM培养液中,置于37℃、95%空气、5% CO2孵箱内培养。每48 h换液、传代1次,取对数生长期细胞用于实验。
1.3 细胞活性检测 取对数生长期细胞消化制成单细胞悬液,接种于96 孔培养板中,每孔接种100 μL约含5×103个细胞。贴壁后无血清培养细胞16h至24h,使细胞同步化。加入不同终浓度(0μM、10μM和60μM)的二氢青蒿素,在37℃,5% CO2条件下培养细胞,0μM二氢青蒿素干预组细胞作为对照组(Control组)。使用MTT比色试验对不同时间点(0h、24h和48 h)的细胞生长状态进行测定,实验重复4次。对应时间点的细胞活性(%)=(OD干预组/OD对照组)×100 (%)[14]。
1.4 细胞GLUT1 mRNA表达检测 按照试剂盒说明书提取细胞总RNA,反转录为cDNA,以cDNA为模板进行qPCR反应。GLUT1正义 5′-CTTTG TGGCCTTCT TTGAAGT-3′,反义5′-CCACAC AGTTG CTCCACAT-3′;β-actin正义:5′-TGGCA TTGCCG ACAG GAT-3′,反义:5′-GCTCAGGAG GAGCAAT GATCT-3′。使用β-actin作为内参基因,使用2-ΔΔCT公式计算目的基因相对表达量。ΔΔCt= (Ct,目标-Ct,β-actin)干预组-(Ct,目标-Ct,-actin)对照组[15]。
1.5 Western blot法检测细胞GLUT1蛋白表达水平以及PI3K和Akt磷酸化水平 按照试剂盒操作要求,首先提取细胞总蛋白,并进行聚丙烯酰胺凝胶电泳(SDS-PAGE),然后转移至硝酸纤维素滤膜上,用脱脂奶粉封闭1h,分别加入鼠抗人GLUT1抗体、鼠抗人phospho-PI3K抗体、鼠抗人PI3K抗体、鼠抗人phospho-Akt抗体、鼠抗人Akt抗体和鼠抗人β-actin抗体,4℃孵育过夜,洗膜后加入相应的辣根过氧化物酶标记的二抗(1: 2000),用ECL进行显色,用凝胶成像分析系统进行扫描。
1.6 统计学方法 计量资料以均数±标准差表示。采用SPSS 21.0进行单因素方差分析,两样本均数多重比较采用LSD法,P<0.05为差异有统计学意义。
2 结果
2.1 MTT法结果分析 在不同浓度(0μM、10μM和60μM)二氢青蒿素(DHA)干预后,使用MTT法对不同时间点(0h、24h和48h)胰腺癌PANC-1细胞活性进行测定。发现与未干预细胞(0μM DHA)相比较,给予二氢青蒿素干预的胰腺癌PANC-1细胞活性呈浓度依赖性和时间依赖性下降,差异均有统计学意义(P均<0.05),见表1。
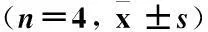
表1 MTT比色法测定PANC-1细胞活性
注:对应时间点与0μM相比较 ①P<0.05;#对应时间点与10μM相比较 ②P<0.05
2.2 GLUT1 mRNA和蛋白的表达 在给予胰腺癌PANC-1细胞不同浓度(0μM、10μM和60μM)二氢青蒿素(DHA)干预48h后,使用qPCR和western blot法对PANC-1细胞GLUT1 mRNA和蛋白的表达进行检测。与未干预细胞(0μM DHA)相比较,给予DHA干预的PANC-1细胞GLUT1 mRNA和蛋白表达水平呈浓度依赖性下降,差异均有统计学意义(P均<0.05),见表2和图1。

表2 胰腺癌PANC-1细胞GLUT1 mRNA和蛋白表达水平以及PI3K和Akt磷酸化水平
注:与0μM相比较 ①P<0.05;与10μM相比较 ②P<0.05

图1 胰腺癌PANC-1细胞GLUT1蛋白表达的western blot结果
Figure 1 Western blot result of the protein expression of GLUT1 in pancreatic cancer PANC-1 cells
2.3 PI3K磷酸化水平 在给予胰腺癌PANC-1细胞不同浓度(0μM、10μM和60μM)二氢青蒿素(DHA)干预48h后,使用western blot法对细胞PI3K磷酸化水平(phospho-PI3K/total PI3K)进行检测。与未干预细胞(0μM DHA)相比较,给予DHA干预后的PANC-1细胞PI3K磷酸化水平呈剂量依赖性降低,差异均有统计学意义(P均<0.05),见图2和表2。
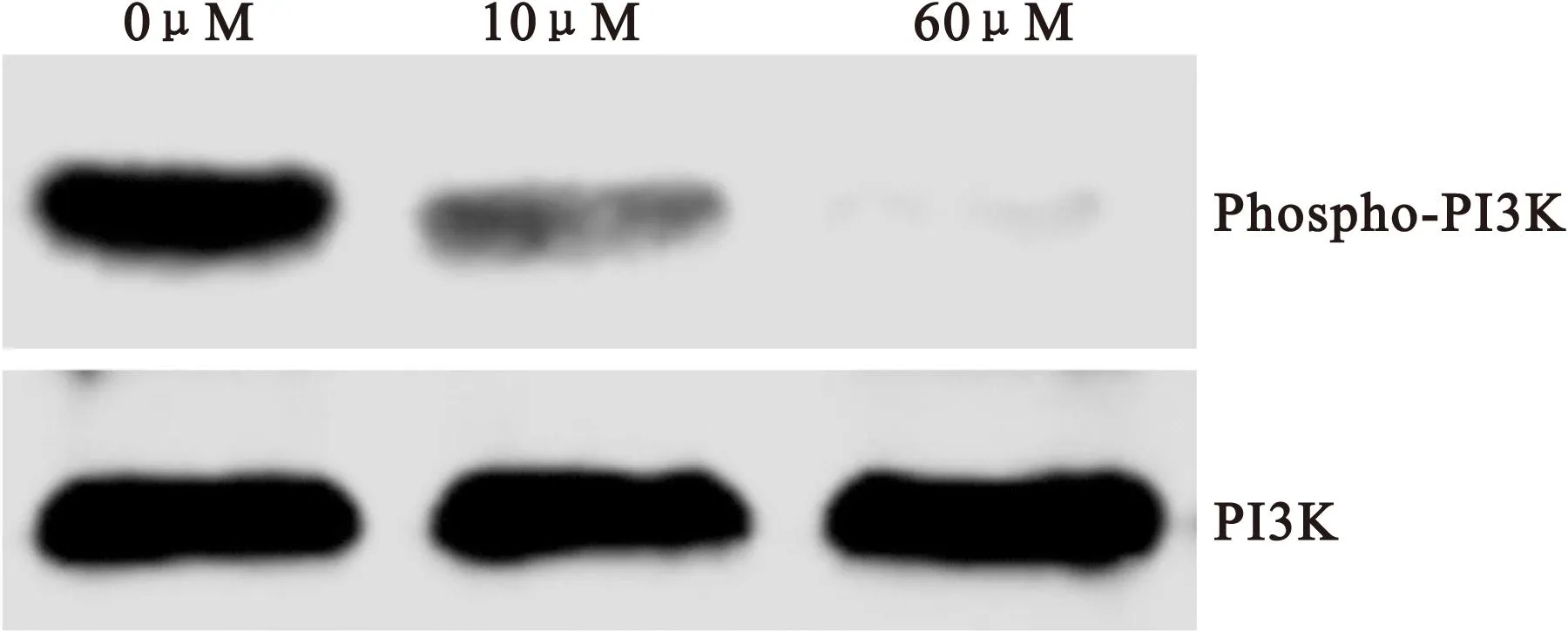
图2 胰腺癌PANC-1细胞PI3K磷酸化的western blot结果
Figure 2 Western blot result of the phosphorylation of PI3K in pancreatic cancer PANC-1 cells
2.4 Akt磷酸化水平 在给予胰腺癌PANC-1细胞不同浓度(0μM、10μM和60μM)二氢青蒿素(DHA)干预48h后,使用western blot法对细胞Akt磷酸化水平(phospho-Akt/total Akt)进行检测。与未干预细胞(0μM DHA)相比较,给予DHA干预后的PANC-1细胞Akt磷酸化水平呈剂量依赖性降低,差异均有统计学意义(P均<0.05)。见图3和表2。
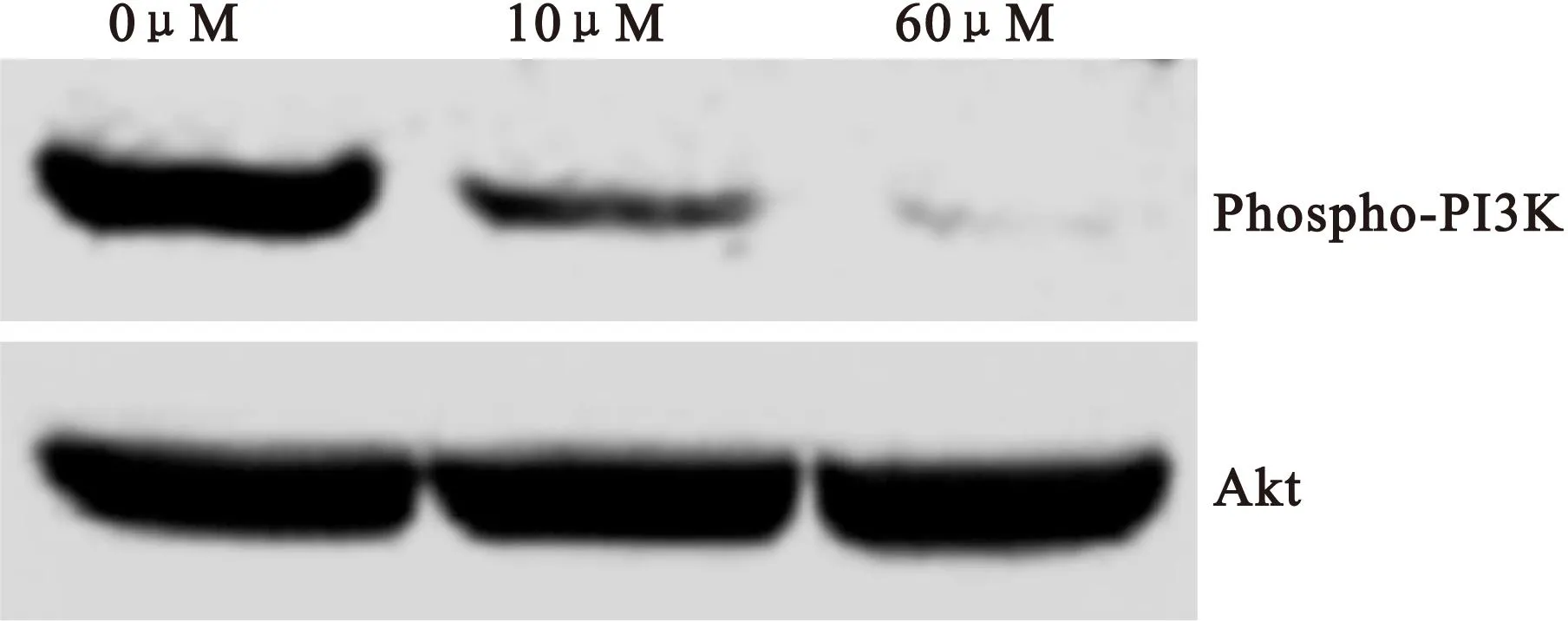
图3 胰腺癌PANC-1细胞Akt磷酸化的western blot结果
Figure 3 Western blot result of the phosphorylation of Akt in pancreatic cancer PANC-1 cells
3 讨论
胰腺癌(pancreatic cancer)是消化系统常见的恶性肿瘤类型之一。据2008年世界卫生组织(WHO)的数据显示胰腺癌的全球新发病例约为28万例,发病率约为3.9/10万人,其发病率占总恶性肿瘤新发病例的2.2%[1-5, 16]。虽然胰腺癌的发病率仅位居恶性肿瘤发病率的第13位,但与此相对应的是每年约3.7/10万的病死率,其占恶性肿瘤总死亡人数的3.5%,位居第8位[1-5, 16]。我国的流行病学数据显示胰腺癌的发病率呈逐渐上升趋势[1-5, 16]。调查发现1990至2000年10年间我国的胰腺癌标准化死亡率从1.46/10万增加至2.38/10万[16]。且数据显示胰腺癌的5年生存率仅15%~25%[1-5, 16]。同时研究表明胰腺癌的发病率上升与人口老龄化以及吸烟有显著的相关性[1-5, 16]。另一方面由于胰腺器官解剖位置位于腹腔深部不易被触及且胰腺癌缺乏特异性症状致使患者就诊时多以处于疾病的发展期,多数已不适合根治性手术的治疗。同时胰腺癌多数病理类型对于放化疗的敏感性不佳。故发现一种新的治疗药物和方法对于胰腺癌的临床治疗将会有重要的价值和意义。
青蒿素(Artemisinin)是中草药黄花蒿(Artemisia annua L)的主要药理活性物质,其化学结构为一种内过氧化基团的倍半萜内酯化合物[17]。目前青蒿素及其衍生物包括二氢青蒿素(dihydroartemisinin, DHA)主要用于疟疾的临床治疗和预防。但近期的大量研究发现二氢青蒿素还具有抑制炎症反应、调节细胞免疫、抑制肿瘤细胞增殖、分化和侵袭、抑制肿瘤血管生成、促进肿瘤细胞凋亡和自噬以及抑制器官纤维化等多种生物活性[18-20]。二氢青蒿素可以有效的抑制博莱霉素诱导的大鼠肺组织炎症反应和纤维化过程[18];通过活化caspase-3有效的促进凋亡诱导胶质瘤干细胞(glioma stem cells, GSCs)的凋亡,抑制胶质瘤的增殖[19];可以通过抑制肿瘤细胞的糖代谢过程抑制非小细胞肺癌A549细胞和PC-9细胞的增殖[20]。我们使用MTT法对细胞活性进行检测后发现发现与未干预细胞(0μM DHA)相比较,给予二氢青蒿素干预的胰腺癌PANC-1细胞活性呈浓度依赖性和时间依赖性下降,差异均有统计学意义(P均<0.05)。该结果表明二氢青蒿素对于胰腺癌PANC-1细胞的增殖过程有显著的抑制作用。
近期的部分研究发现青蒿素等衍生物的抗炎症和抗肿瘤等药理活性与调控PI3K/Akt信号通路密切相关[11-13, 21]。Tan SS等的研究证实青蒿琥酯(Artesunate)可以通过下调PI3K/Akt信号通路有效抑制支气管哮喘气道平滑肌细胞的增殖[21]。钟轩等的研究发现二氢青蒿素可以通过下调PI3K/Akt信号通路抑制胃癌SGC7901细胞的增殖和Cyclin D1的表达水平[13]。我们的研究发现在给予胰腺癌PANC-1细胞不同浓度(0μM、10μM和60μM)二氢青蒿素干预48h后,与未干预细胞(0μM DHA)相比较,给予二氢青蒿素干预后的PANC-1细胞PI3K和Akt磷酸化水平呈剂量依赖性降低,差异均有统计学意义(P均<0.05)。同时由于PI3K/Akt信号通路对于肿瘤细胞糖代谢密切相关的葡萄糖转运蛋白1 (GLUT1)的表达具有关键的调节意义,且GLUT1的表达水平与肿瘤的增殖密切相关[22]。我们对GLUT1的表达进行分析后发现与未干预细胞(0μM DHA)相比较,给予二氢青蒿素干预的胰腺癌PANC-1细胞GLUT1 mRNA和蛋白表达水平呈浓度依赖性下降,差异均有统计学意义(P均<0.05)。该实验结果表明二氢青蒿素可以通过下调PI3K/Akt信号通路有效抑制胰腺癌PANC-1细胞GLUT1的合成。
4 结论
二氢青蒿素可以通过调控PI3K/Akt信号通路的活化水平下调胰腺癌PANC-1细胞GLUT1 mRNA和蛋白的表达,并对肿瘤细胞的增殖有显著抑制作用。该实验结果为进一步探讨将二氢青蒿素应用于胰腺癌等肿瘤的临床治疗奠定了一定的基础。
[1]何满西, 田伯乐, 胡伟明, 等. RNAi抑制胰腺癌细胞survivin表达的实验研究[J]. 西部医学, 2009, 21(09): 1460-1463.
[2]朱世凯, 张宇; 杨洪吉, 等. 联合肠系膜上静脉/门静脉切除的胰十二指肠切除术的临床价值[J]. 西部医学, 2013, 25(11): 1683-1685.
[3]胡欣, 李光明, 付曦, 等. 卡培他滨联合放疗治疗胰腺癌的临床观察[J]. 西部医学, 2010, 22(07): 1221-1223.
[4]吕文超, 崔云甫. 胰腺癌流行病学和病因学研究进展[J]. 世界华人消化杂志, 2011, 19(27): 2805-2809.
[5]Shaib YH, Davila JA, El-Serag HB. The epidemiology of pancreatic cancer in the United States: changes below the surface [J]. Aliment Pharmacol Ther, 2006, 24(1): 87-94.
[6]Chen SS, Hu W, Wang Z,etal. p8 attenuates the apoptosis induced by dihydroartemisinin in cancer cells through promoting autophagy [J]. Cancer Biol Ther, 2015, 16(5): 770-779.
[7]Lucibello M, Adanti S, Antelmi E,etal. Phospho-TCTP as a therapeutic target of Dihydroartemisinin for aggressive breast cancer cells [J]. Oncotarget, 2015, 6(7):5275-5291.
[8]Dong F, Zhou X, Li C,etal. Dihydroartemisinin targets VEGFR2 via the NF-κB pathway in endothelial cells to inhibit angiogenesis [J]. Cancer Biol Ther, 2014, 15(11):1479-1488.
[9]Huang X, Xie Z, Liu F,etal. Dihydroartemisinin inhibits activation of the Toll-like receptor 4 signaling pathway and production of type I interferon in spleen cells from lupus-prone MRL/lpr mice [J]. Int Immunopharmacol, 2014, 22(1):266-272.
[10] Zhao C, Qin G, Gao W,etal. Potent proapoptotic actions of dihydroartemisinin in gemcitabine-resistant A549 cells [J]. Cell Signal, 2014, 26(10):2223-2233.
[11] Liao K, Li J, Wang Z. Dihydroartemisinin inhibits cell proliferation via AKT/GSK3β/cyclinD1 pathway and induces apoptosis in A549 lung cancer cells [J]. Int J Clin Exp Pathol, 2014, 7(12): 8684-8691.
[12] 钟轩, 王爱军; 王红钰, 等. 二氢青蒿素通过PTEN/PI3K/Akt通路抑制胃癌细胞的增殖[J]. 中国肿瘤临床, 2013,25(04): 190-194.
[13] 王红钰, 王爱军, 郑宝军, 等. 二氢青蒿素诱导胃癌SGC7901细胞体外自噬研究[J]. 广东医学, 2012, 33(22): 3394-3397.
[14] 尹鹏, 胡君, 储著凌, 等. 替米沙坦通过上调 PPAR-γ促进结肠癌SW480细胞TIMP-1表达的实验研究[J]. 西部医学, 2014, 26(2): 160-162.
[15] Zhu T, Wu XL, Zhang W,etal. Glucagon Like Peptide-1 (GLP-1) Modulates OVA-Induced Airway Inflammation and Mucus Secretion Involving a Protein Kinase A (PKA)-Dependent Nuclear Factor-κB (NF-κB) Signaling Pathway in Mice [J]. Int J Mol Sci, 2015, 16(9): 20195-20211.
[16] Wang L, Yang GH, Lu XH,etal. Pancreatic cancer mortality in China (1991-2000) [J]. World J Gastroenterol. 2003, 9: 1819-1823.
[17] Ho WE, Peh HY, Chan TK,etal. Artemisinins: pharmacological actions beyond anti-malarial [J]. Pharmacol Ther, 2014, 142(1): 126-139.
[18] Yang D, Yuan W, Lv C,etal. Dihydroartemisinin supresses inflammation and fibrosis in bleomycine-induced pulmonary fibrosis in rats [J]. Int J Clin Exp Pathol, 2015, 8(2): 1270-1281.
[19] Cao L, Duanmu W, Yin Y,etal. Dihydroartemisinin exhibits anti-glioma stem cell activity through inhibiting p-AKT and activating caspase-3 [J]. Pharmazie, 2014, 69(10): 752-758.
[20] Mi YJ, Geng GJ, Zou ZZ,etal. Dihydroartemisinin inhibits glucose uptake and cooperates with glycolysis inhibitor to induce apoptosis in non-small cell lung carcinoma cells [J]. PLoS One, 2015, 10(3): e0120426.
[21] Tan SS, Ong B, Cheng C,etal. The antimalarial drug artesunate inhibits primary human cultured airway smooth muscle cell proliferation [J]. Am J Respir Cell Mol Biol, 2014, 50 (2): 451-458.
[22] Fang J, Zhou SH, Fan J,etal. Roles of glucose transporter-1 and the phosphatidylinositol 3-kinase/protein kinase B pathway in cancer radioresistance (review) [J]. Mol Med Rep, 2015, 11 (3): 1573-1581.
Dihydroartemisinin suppresses expression of GLUT1 through PI3K/Akt signal pathway in pancreatic cancer PANC-1 cells
WEN Guihai1, WANG Tao1, ZHU Tao2
(1.DepartmentofTheFirstGeneralSurgery,HandanCentralHospital,Handan056001,Hebei,China;2.TheFirstAffiliatedHospitalofChengduMedicalCollage,Chengdu610000,China)
Objective To study the anti-tumor role of dihydroartemisinin (DHA) in pancreatic cancer PANC-1 cells and its involving signal pathway. Methods Three different concentrations (0μM, 10μM and 60μM) of DHA were obtained in our study. At different time points (0h, 24h and 48h), MTT assay was performed to analyze the cell viabilities of PANC-1 cells. QPCR was used to detect the mRNA expression of GLUT1. The protein expression of GLUT1 and activation (phosphorylation) of PI3K and Akt were explored by western blot. Results The cell viabilities of pancreatic cancer PANC-1 cells were concentration-dependently and time-dependently suppressed by DHA. Then, after 48 hours of interventions, we found that the mRNA and protein expression of GLUT1 and the phosphorylation of PI3K and Akt were all concentration-dependently attenuated by DHA in pancreatic cancer PANC-1 cells. Conclusion Dihydroartemisinin (DHA) could inhibit the tumor proliferation and reduce the expression of GLUT1 possibly by inactivation of PI3K/Akt signal pathway in pancreatic cancer PANC-1 cells.
Dihydroartemisinin; Pancreatic cancer; PANC-1 cells; GLUT1; PI3K; Akt
中国博士后科学基金(2014M552369)
R 73-34
A
10.3969/j.issn.1672-3511.2016.02.008
2015-09-17; 编辑: 张文秀)
