miR-21调控PTEN/Akt信号通路抑制肝癌HepG2细胞增殖的实验研究*
2016-05-07王涛温桂海张桂东李恩君武向鹏苑昭奖朱涛
王涛 温桂海 张桂东 李恩君 武向鹏 苑昭奖 朱涛
miR-21调控PTEN/Akt信号通路抑制肝癌HepG2细胞增殖的实验研究*
王涛1温桂海1张桂东1李恩君1武向鹏1苑昭奖1朱涛2
(1.邯郸市中心医院普外一科, 河北 邯郸 056001; 2.四川大学华西医院, 成都 四川 610041)
目的 探讨miR-21对于肝癌HepG2细胞增殖的调控作用及其相关的信号通路。方法 分别采用miR-21 mimic和miR-21 inhibitor上调和下调肝癌HepG2细胞中miR-21的表达量。在不同时间点(0h、24h和48h)对肝癌HepG2细胞的增殖水平使用MTT法进行检测。在干预4h后,使用qPCR法对细胞中miR-21和PTEN mRNA水平进行检测;并对PTEN和Akt蛋白水平及Akt磷酸化(phospho-Akt)水平使用western blot进行检测。结果 与对照组相比较,给予miR-21 mimic干预的HepG2细胞活性呈时间依赖性增加,差异均有统计学意义(P均<0.05)。与对照组相比较,给予miR-21 inhibitor干预的HepG2细胞活性呈时间依赖性降低,差异均有统计学意义(P均<0.05)。在干预4h后与对照组相比较,miR-21 mimic干预的HepG2细胞miR-21 mRNA和Akt磷酸化水平明显增加而PTEN mRNA和蛋白表达水平明显降低,差异均有统计学意义(P均<0.05);同时与对照组相比较,miR-21 inhibitor干预的HepG2细胞miR-21 mRNA和Akt磷酸化水平明显降低而PTEN mRNA和蛋白表达水平明显增加,差异均有统计学意义(P均<0.05)。 结论 该基础研究表明miR-21可能可以通过PTEN/Akt信号通路对肝癌HepG2细胞的增殖产生关键性的调控作用。并通过抑制miR-21的表达具有抗肝脏肿瘤的价值,为进一步肿瘤临床治疗提供思路。
miR-21; PTEN; Akt; HepG2细胞
肝细胞癌(hepatocellular carcinoma, HCC)是最常见的消化系统肿瘤之一,以恶性程度高、转移能力强和患者生存时间短著称[1-3]。故进一步揭示肝细胞癌的发生机制和探寻新的的治疗方法将具有重要的临床意义。MicroRNAs (miRNA)是真核细胞内一类具有调控对应mRNA翻译的非编码RNA。目前发现miRNA在肿瘤发生和肿瘤细胞增殖、分化、转移以及凋亡等多个过程中扮演着重要的角色[4-6]。近期的部分研究显示miR-21对于调控包括非小细胞肺癌A549细胞、结肠癌HCT116细胞以及食道癌Eca109等肿瘤细胞增殖和分化具有重要的价值[7-9]。进一步的研究显示miR-21对于肿瘤的增殖和分化作用与PTEN/Akt信号通路密切相关[7, 10, 11]。故本研究是探讨miR-21对于肝癌HepG2细胞增殖的调控旨作用及其相关的信号通路。
1 材料和方法
1.1 主要试剂和材料 miR-21 mimic和miR-21 inhibitor采购于上海吉玛制药技术有限公司;Lipofectamine 2000和OPTI-MEN减血清培养基均购买于美国Invitrogen公司;RNA提取试剂盒和qPCR试剂盒均购自德国Qiagen公司;鼠抗人PTEN抗体、鼠抗人phospho-Akt抗体、鼠抗人Akt抗体和鼠抗人β-actin抗体均购自美国Santa Cruz公司;DMEM培养基购自美国Gibco公司;小牛血清购自澳大利亚Gibco公司;MTT试剂盒购自美国Promega公司;其余试剂均为分析纯。
1.2 细胞培养 肝癌HepG2细胞常规接种在含10%胎牛血清、100g/L青霉素、100g/L链霉素的DMEM培养液中,置于37℃、95%空气、5% CO2孵箱内培养。每48 h换液、传代1次,取对数生长期细胞用于实验。实验时将细胞置于OPTI-MEN减血清培养基培养,利用Lipofectamine 2000将终浓度为50nM的miR-control (阴性对照)、miR-21 mimic和miR-21 inhibitor对细胞进行转染,4h后换为完全培养基继续培养。
1.3 细胞活性检测 取对数生长期细胞消化制成单细胞悬液,接种于96孔培养板中,每孔接种100μL约含5×103个细胞。使用MTT比色试验对转染后后不同时间点(0h、24h和48h)的细胞生长状态进行测定,实验重复4次。细胞活性(%)=(OD干预组/OD 对照组0h)×100(%)[12]。
1.4 qPCR法检测细胞中miR-21和PTEN mRNA表达检测 干预4h后,按照qPCR试剂盒说明书提取细胞总RNA。U6作为miR-21的内参照;β-actin作为PTEN的内参照。引物:miR-21正义5′-ACGTT GTGTAGCTTAT CAGACTG-3′,反义5′-AATGGT TGTTCTCCA CACTCTC-3′;U6正义5′-ATTGG AACGATA CAGAG AAGATT-3′,反义5′-GGAAC GCTTCACG AATTTG-3′;PTEN正义 5′-TGGAT TCGAC TTAGACT TGACCT-3′,反义 5′-TGG CGGTGTCAT AATGTC TTTC-3′;β-actin正义:5′-CATGTAC GTTGCTAT CCAGGC-3′,反义:5′-CTCCTTAATG TCACGCACGAT-3′。按照试剂盒说明书介绍进行反转录和扩增实验。使用2-ΔΔCt法对miR-21和PTEN mRNA表达水平进行测定,ΔΔCt= (Ct,目标-Ct,内参照)干预组-(Ct,目标-Ct,内参照)对照组[13]。
1.5 Western blot法检测细胞中PTEN蛋白表达水平及磷酸化Akt水平 干预4h后,按照试剂盒操作要求,首先提取细胞总蛋白,并进行聚丙烯酰胺凝胶电泳(SDS-PAGE),然后转移至硝酸纤维素滤膜上,用脱脂奶粉封闭1 h,分别加入鼠抗人PTEN (1∶800)、Akt (1∶1000)、phospho-Akt (1∶1000)和β-actin (1∶1200),4℃孵育过夜,洗膜后加入相应的辣根过氧化物酶标记的二抗(1: 2000),用ECL进行显色,用凝胶成像分析系统进行扫描。
1.6 统计学方法 计量资料以均数±标准差表示。采用SPSS 17.0进行单因素方差分析,两样本均数多重比较采用LSD法,P<0.05为差异有统计学意义。
2 结果
2.1 MTT法结果 使用MTT法对不同时间点(0h、24h和48h)的肝癌HepG2细胞活性进行测定。与对照组相比较,给予miR-21 mimic干预的HepG2细胞活性呈时间依赖性增加,差异均有显著统计学意义(P均<0.05)。与对照组相比较,给予miR-21 inhibitor干预的HepG2细胞活性呈时间依赖性降低,差异均有显著统计学意义(P均<0.05),见图1。

Table 1 Cell viabilities of HepG2 cells at different time points (0 h, 24h and 48h)

分组 0h24h48hmiR-con组100100100miR-mimic组103.17±3.02①124.62±3.51①141.54±4.09①miR-inhibitor组98.87±2.74①②69.4±2.39①②47.17±1.59①②
注:对应时间点与对照组相比较 ①P<0.05;对应时间点与miR-mimic组相比较 ②P<0.05。
2.2 miR-21 mRNA的表达水平 在干预4h后,使用qPCR对HepG2细胞miR-21 mRNA的表达水平进行检测。在干预4h后与对照组相比较,miR-21 mimic干预的HepG2细胞miR-21 mRNA表达水平明显增加,差异均有统计学意义(P<0.05);同时与对照组比较,miR-21 inhibitor干预的HepG2细胞miR-21 mRNA明显降低,差异均有统计学意义(P均<0.05),见表2。
2.3 PTEN mRNA和蛋白表达水平 在干预4h后,使用qPCR和western blot对HepG2细胞PTEN mRNA和蛋白的表达水平进行检测。在干预4h后与对照组相比较,miR-21 mimic干预的HepG2细胞PTEN mRNA和蛋白的表达水平明显下降,差异均有统计学意义(P<0.05);同时与对照组相比较,miR-21 inhibitor干预的HepG2细胞PTEN mRNA和蛋白表达水平明显增加,差异均有统计学意义(P均<0.05),见表2和图1。

表2 HepG2细胞miR-21和PTEN的表达水平及Akt磷酸化水平
注:与对照组相比较 ①P<0.05;与miR-mimic组相比较 ②P<0.05。
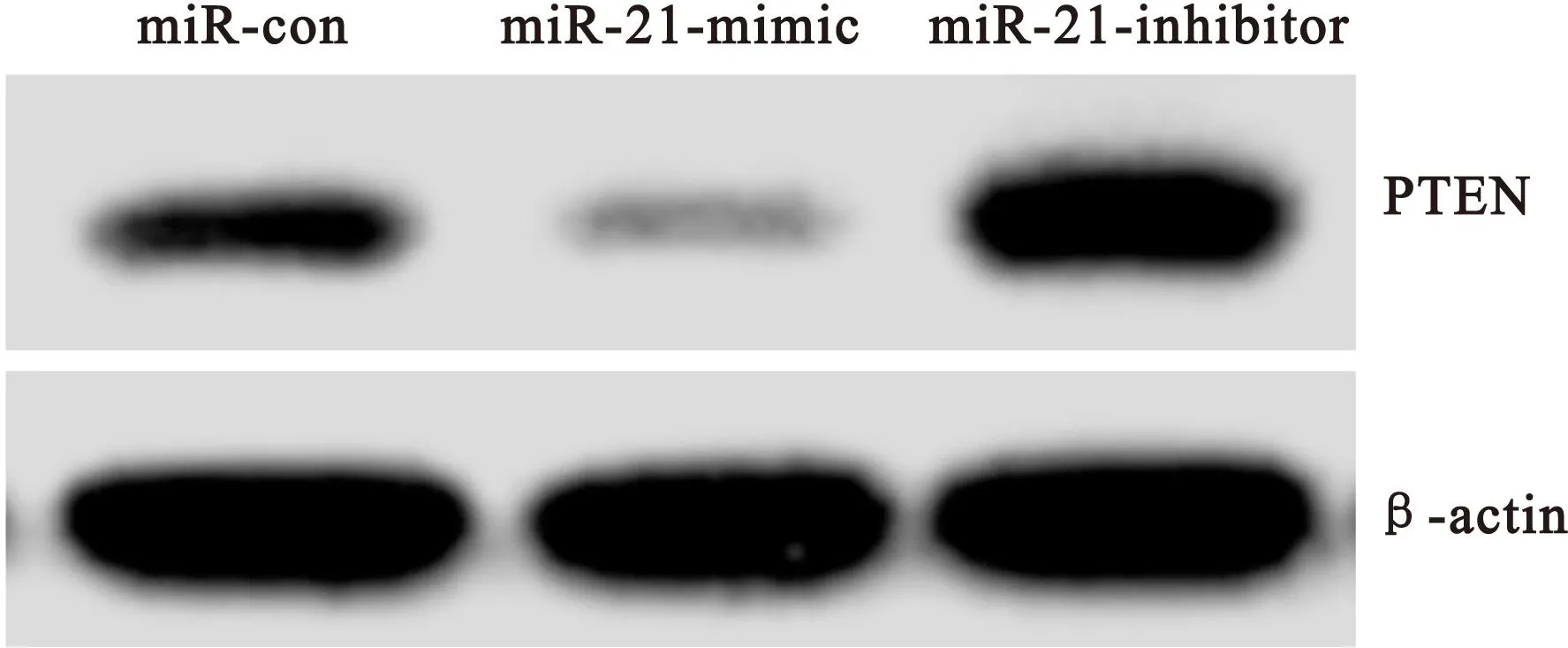
图1 HepG2细胞PTEN蛋白表达的western blot结果
Figure 1 The western blot results of PTEN expression in HepG2 cells
2.4 Akt磷酸化水平 在干预4h后,使用western blot对HepG2细胞Akt磷酸化水平水平进行检测。在干预4h后与对照组相比较,miR-21 mimic干预的HepG2细胞Akt磷酸化水平明显升高,差异均有统计学意义(P<0.05);同时与对照组相比较,miR-21 inhibitor干预的HepG2细胞Akt磷酸化水平明显降低,差异均有统计学意义(P均<0.05),见表2和图2。
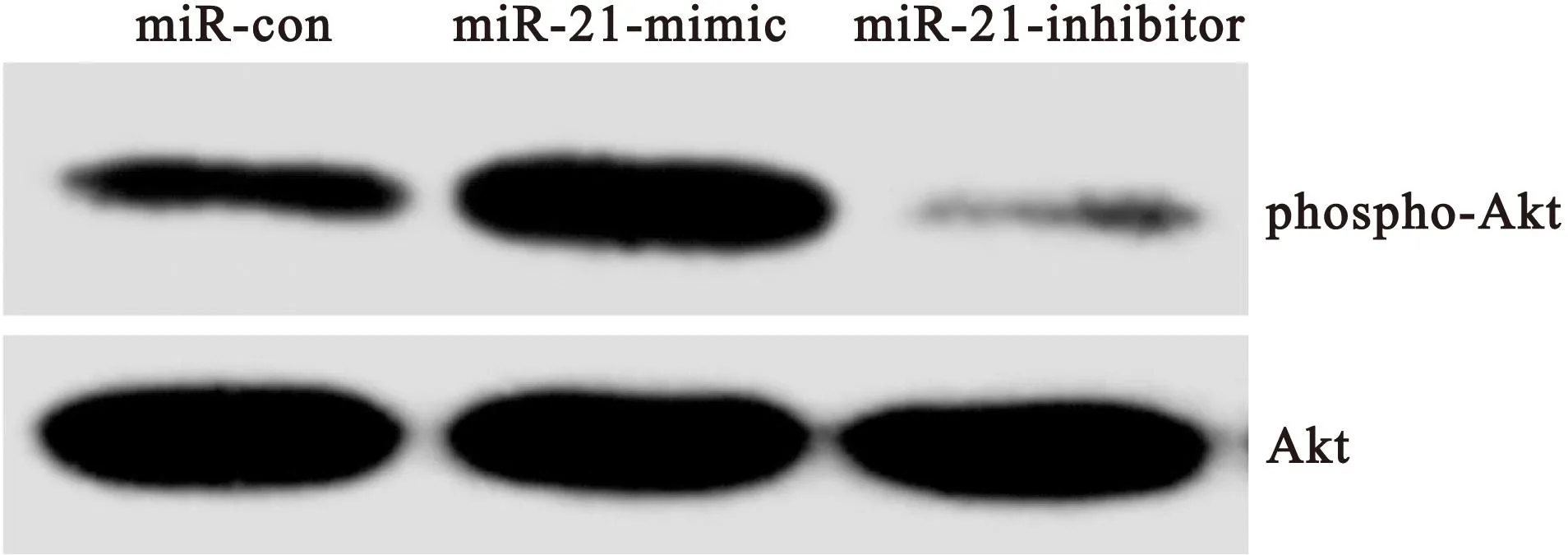
图2 HepG2细胞PTEN蛋白表达的western blot结果
Figure 2 The western blot results of the phosphorylation of Akt in HepG2 cells
3 讨论
根据2011年的调查研究显示肝细胞癌(hepatocellular carcinoma, HCC)作为中国最常见的消化系统恶性肿瘤之一,其发病率约为250.28/10万人,死亡率约为156.83/10万人;与国外相比较,我国的肝癌的发病率和死亡率均处于较高水平[1-3, 14]。故进一步的揭示肝癌的发病机制及探寻新的治疗药物和方法将具有重要的价值和意义。
MicroRNAs (miRNA)是真核细胞内的一类约为18~25个碱基构成的非编码的单链RNA,其能够通过特异性的与特定基因(靶基因)转录的mRNA 3′ UTR区结合,并在RNA诱导的沉默复合体(RNA-induced silencing complex, RISC)的作用下完全的或部分的抑制靶基因的表达[4-6]。大量的研究表明miRNA广泛的参与了生物的生长、发育、衰老、损伤修复、免疫反应、炎症反应以及肿瘤生成分化等生理和病理过程[4-6]。近期的研究分析显示人类miRNA基因数估计大于1000个,其可以调控约超过30%的蛋白编码基因的翻译过程[4-6]。目前研究发现miR-21对于非小细胞肺癌A549细胞、结肠癌HCT116细胞以及食道癌Eca109细胞等多种肿瘤细胞的增殖、分化、转移、侵袭、凋亡以及肿瘤血管生成过程有重要的调控作用[7-9, 15]。Liu T等人的研究发现miR-21对于调节移植瘤小鼠肿瘤组织内的食道鳞状细胞癌Eca109细胞的增殖有重要作用[15]。Tao YJ等的实验证实通过反义核苷(antisense oligonucleotides)技术抑制miR-21表达后可以通过调控PTEN/Akt信号通路有效抑制人结肠癌HCT116细胞的增殖和转移[9]。同时Yang Z等的研究显示抑制miR-21的表达可以通过PTEN相关的信号通路增加非小细胞肺癌A549细胞对于化疗药物顺铂(cisplatin)的敏感性[7]。此外还有研究表明miR-21在肿瘤组织中的表达水平与肿瘤的分期以及患者的预后存在密切的相关性[16]。在本研究中我们首先使用MTT法对不同时间点(0h、24h和48h)的肝癌HepG2细胞活性进行测定后发现与对照组相比较,给予miR-21 mimic干预的HepG2细胞活性呈时间依赖性增加,差异均有显著统计学意义(P均<0.05)。与对照组相比较,给予miR-21 inhibitor干预的HepG2细胞活性呈时间依赖性降低,差异均有显著统计学意义(P均<0.05)。该实验结果表明miR-21对于肝癌HepG2细胞增殖的具有重要的调控作用。
PTEN (phosphatase and tensin homolog deleted on chromosome ten)作为一种抑癌基因产物对于细胞的增殖和分化以及凋亡过程均具有重要的调控作用[17-19]。研究发现PTEN具有双特异磷酸酶活性,可通过去除磷酸基修饰其他蛋白质和脂肪[17-19]。其主要底物包括PI3K和Akt等重要的信号通路蛋白激酶[17-19]。目前研究表明PTEN表达缺失和突变在包括肝细胞癌、胰腺癌和非小细胞肺癌等多种肿瘤的生长、增殖、转移和浸润等过程中均扮演着重要的角色[17-19]。如Wang L等对56例肝细胞肝癌患者切除的肿瘤组织进行分析发现肿瘤组织中PTEN表达阳性率仅为42.9%,而癌周组织PTEN表达阳性率为100%;同时发现肿瘤组织中的PTEN突变率为100%,PTEN基因启动子部位甲基化率为16.1%[19]。目前研究表明miR-21对于PTEN/Akt信号通路有重要的调控作用[10]。Xu J等研究发现上调miR-21的表达可以通过抑制PTEN的生物活性促进宫颈癌细胞的增殖、浸润和转移能力[10, 20]。本研究显示在干预4h后与对照组相比较,miR-21 mimic干预的HepG2细胞miR-21 mRNA和Akt磷酸化水平明显增加而PTEN mRNA和蛋白表达水平明显降低,差异均有统计学意义(P均<0.05);同时与对照组相比较,miR-21 inhibitor干预的HepG2细胞miR-21 mRNA和Akt磷酸化水平明显降低而PTEN mRNA和蛋白表达水平明显增加,差异均有统计学意义(P均<0.05)。该结果表明在肝癌HepG2细胞中miR-21对PTEN/Akt信号通路具有重要的调控作用。
4 结论
研究结果表明miR-21可能可以通过PTEN/Akt信号通路对肝癌HepG2细胞的增殖产生关键性的调控作用。并提示通过抑制miR-21的表达具有抗肝脏肿瘤的价值,此为进一步的肿瘤临床治疗提供了思路。
[1]杨学刚. 青年人原发性肝癌诊断的研究进展[J]. 西部医学, 2012, 24(07): 1412-1414.
[2]陈京来, 郎锦义. 原发性肝细胞癌的早期诊断[J]. 西部医学, 2006, 18(04): 491-493.
[3]杨红春, 李永, 马海. TP、VEGF在原发性肝细胞癌中的表达及与肝癌血管生成的相关性研究[J]. 西部医学, 2012, 24(07): 1265-1267.
[4]Orellana EA, Kasinski AL. MicroRNAs in Cancer: A Historical Perspective on the Path from Discovery to Therapy [J]. Cancers (Basel), 2015, 7(3):1388-1405.
[5]Bertoli G, Cava C, Castiglioni I. MicroRNAs: New Biomarkers for Diagnosis, Prognosis, Therapy Prediction and Therapeutic Tools for Breast Cancer [J]. Theranostics, 2015, 5(10):1122-1143.
[6]刘梅, 贺平, 罗志华, 等. MiRNA与肿瘤[J]. 西部医学, 2012, 24(05): 1022-1024.
[7]Yang Z, Fang S, Di Y,etal. Modulation of NF-κB/miR-21/PTEN pathway sensitizes non-small cell lung cancer to cisplatin [J]. PLoS One, 2015, 10(3):e0121547.
[8]Bandopadhyay M, Banerjee A, Sarkar N,etal. MicroRNA-21 promotes cell growth and migration by targeting programmed cell death 4 gene in Kazakh′s esophageal squamous cell carcinoma [J]. BMC Cancer, 2014, 14:721.
[9]Tao YJ, Li YJ, Zheng W,etal. Antisense oligonucleotides against microRNA-21 reduced the proliferation and migration of human colon carcinoma cells [J]. Cancer Cell Int, 2015, 15:77.
[10] Xu J, Zhang W, Lv Q, Zhu D. Overexpression of miR-21 promotes the proliferation and migration of cervical cancer cells via the inhibition of PTEN [J]. Oncol Rep, 2015, 33(6):3108-3116.
[11] Yang X, Cheng Y, Li P,etal. A lentiviral sponge for miRNA-21 diminishes aerobic glycolysis in bladder cancer T24 cells via the PTEN/PI3K/AKT/mTOR axis [J]. Tumour Biol, 2015, 36(1):383-391.
[12] Wei D, Peng J J, Gao H,etal. Digoxin Downregulates NDRG1 and VEGF through the Inhibition of HIF-1α under Hypoxic Conditions in Human Lung Adenocarcinoma A549 Cells [J]. Int J Mol Sci, 2013, 14(4): 7273-7285.
[13] 尹鹏, 胡君, 储著凌, 等. 替米沙坦通过上调PPAR-γ促进结肠癌SW480细胞TIMP-1表达的实验研究[J]. 西部医学, 2014, 26(02): 160-162.
[14] Chen W, Zheng R, Zeng H,etal. Annual report on status of cancer in China, 2011 [J]. Chin J Cancer Res, 2015, 27(1):2-12.
[15] Liu T, Liu Q, Zheng S,etal. MicroRNA-21 promotes cell growth and migration by targeting programmed cell death 4 gene in Kazakh′s esophageal squamous cell carcinoma [J]. Dis Markers, 2014, 2014:232837.
[16] Zhu W, Xu B. MicroRNA-21 identified as predictor of cancer outcome: a meta-analysis [J]. PLoS One, 2014, 9(8):e103373.
[17] Carnero A, Paramio JM. The PTEN/PI3K/AKT Pathway in vivo, Cancer Mouse Models [J]. Front Oncol, 2014, 4:252.
[18] Milella M, Falcone I, Conciatori F,etal. PTEN: Multiple Functions in Human Malignant Tumors [J]. Front Oncol, 2015, 5:24.
[19] Wang L, Wang WL, Zhang Y,etal. Epigenetic and genetic alterations of PTEN in hepatocellular carcinoma [J]. Hepatol Res, 2007, 37(5):389-396.
[20] Xiong B, Cheng Y, Ma L,etal. MiR-21 regulates biological behavior through the PTEN/PI-3 K/Akt signaling pathway in human colorectal cancer cells [J]. Int J Oncol, 2013, 42(1):219-228.
miR-21 regulates tumor cells proliferation through PTEN/Akt signaling pathway in hepatocellular carcinoma HepG2 cells
WANG Tao1, WEN Guihai1, ZHANG Guidong1,etal
(1DepartmentofTheFirstGeneralSurgery,HandanCentralHospital,Handan056001,Hebei,China;2TheFirstAffiliatedHospitalofChengduMedicalCollage,Chengdu610000,China)
Objective To explore the value of miR-21 on the regulation of hepatocellular carcinoma HepG2 cells proliferation and its signaling pathway.Methods miR-21 mimic and miR-21 inhibitor were used to up-regulate and down-regulate the expression of miR-21 in hepatocellular carcinoma HepG2 cells. Then, MTT was performed to evaluate HepG2 cells viabilities. And qPCR was included to analyze the mRNA expression of miR-21 and PTEN. Meanwhile, the protein expression of PTEN and the phosphorylation of Akt were detected by western blot. Results Our data showed that the cell viabilities of HepG2 cells were time-dependently increased by miR-21 mimic, and, time-dependently decreased by miR-21 inhibitor. And after 4h of interventions, miR-21 mimic up-regulated and miR-21 inhibitor down-regulated the mRNA of miR-21 and the phosphorylation of Akt, respectively. Meanwhile, the mRNA and protein expression of PTEN was inhibited by miR-21 mimic and promoted by miR-21 inhibitor. Conclusion These results indicate that miR-21 could mediate the tumor proliferation possibly through PTEN/Akt signaling pathway in hepatocellular carcinoma HepG2 cells.
miR-21; PTEN; Akt; HepG2 cells
中国博士后科学基金(2014M552369)
R 735.7
A
10.3969/j.issn.1672-3511.2016.02.007
2015-08-28; 编辑: 张文秀)
