石榴果肉PgF3′5′H基因克隆及不同温度处理下的表达分析
2016-05-06关晓弯涂佳丽张水明
关晓弯,陈 磊,涂佳丽,张水明
(安徽农业大学 园艺学院,合肥 230036)
石榴果肉PgF3′5′H基因克隆及不同温度处理下的表达分析
关晓弯,陈磊,涂佳丽,张水明*
(安徽农业大学 园艺学院,合肥 230036)
摘要:为探讨不同温度处理对采后石榴果肉花青苷含量的影响及花青苷合成相关基因(F3′5′H)在石榴果肉花青苷生物合成途径中的作用,该研究以“玉石籽”石榴为试材,于不同温度(0 ℃、5 ℃、10 ℃、15 ℃)处理下测定石榴果肉花青苷含量,同时利用RACE技术克隆了石榴果肉花青苷合成相关基因,命名为PgF3′5′H,GenBank登录号为KU058892;并利用RT-PCR技术分析PgF3′5′H基因在不同贮期温度下石榴果肉中的表达特性。结果表明:(1)不同温度处理下,石榴果肉花青苷含量随着贮藏时间(0~56 d)的增长呈上升趋势;在整个贮藏过程中,15 ℃条件下,花青苷含量最高,10 ℃次之,5 ℃和0 ℃则处于较低水平;15 ℃时花青苷含量在14 d后表现不稳定。(2)PgF3′5′H基因全长cDNA为1 199 bp,开放阅读框918 bp,编码305个氨基酸,在N端36~39处含有细胞色素P450家族基因的特征保守氨基酸序列(CYP基序“PPGP”);生物信息学分析表明,该基因编码的氨基酸序列与巨桉的EgF3′5′H2、麻风树的JcF3′5′H2和荷花的NnF3′5′H2氨基酸序列一致性分别高达86%、82%和81%。(3)在0 ℃、5 ℃、10 ℃处理条件下,石榴果肉PgF3′5′H基因表达量随着贮藏时间(0~56 d)的延长均呈上升趋势,15 ℃处理下,石榴果肉PgF3′5′H基因表达量不稳定;石榴果肉PgF3′5′H基因表达与花青苷含量呈显著正相关关系。研究结果为深入探讨采后石榴果肉花青苷的含量变化奠定了基础。
关键词:石榴果肉;花青苷;温度;PgF3′5′H;RACE;RT-PCR
石榴(PunicagranatumL.)属于石榴科石榴属,为多年生落叶乔木或灌木,是最早发现的可食用水果之一[1]。近年来,由于石榴具有多种医疗保健作用受到人们越来越多的重视[2]。石榴果肉中含有丰富的花青苷,花青苷是自然界一类广泛存在于植物中的水溶性天然色素,主要存在于彩色植物叶片、花或种子的叶肉细胞和表皮细胞的液泡中[3]。花青苷具有显著的抗氧化、抗炎、抑菌、防止肝脂肪积聚及变性、防治心血管疾病、抑制多种癌细胞生长等多种生理活性,在食品、医药、化妆等领域有着广泛的应用前景[4]。但花青苷是一类不稳定的物质,其生物合成和积累易受环境因子的调节[5-6],温度是其中的一个主要的环境因子,不仅能影响花青苷生物合成的速率,而且可以对其积累量和稳定性产生作用[7],这在葡萄[8]、长叶车前[9]、马铃薯[10]等研究中已得到证实。而温度对采后石榴果肉中花青苷含量的影响方面的研究还未见报道。
花青苷合成代谢涉及多个结构基因、调节基因的相互作用,基因编码的酶决定了花青苷合成的种类[11]。花青苷的生物合成主要由苯丙氨酸解氨酶(PAL)、查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、黄烷酮3-羟化酶(F3H)、类黄酮3′羟基化酶(F3′H)、类黄酮3′,5′羟基化酶(F3′5′H)、二羟基黄酮醇还原酶(DFR)、花青苷合成酶(ANS)以及类黄酮3-O-糖基转移酶(UFGT)等多种酶基因调控[12-13]。其中CHS、CHI、F3H、DFR、ANS和UFGT等基因已在石榴中克隆[1],而在石榴中尚未见到关于花青苷合成相关基因(F3′5′H)的研究报道。国内外研究表明,F3′5′H基因在仙客来[14]、马铃薯[15]等很多植物中已经克隆,通过调节花青苷的生物合成途径,从而影响花青苷的种类和含量。
本研究以安徽怀远“玉石籽”石榴为试材,研究采后不同贮藏温度(0 ℃、5 ℃、10 ℃、15 ℃)对石榴果肉花青苷含量的影响。同时利用RACE技术克隆花青苷合成相关基因(PgF3′5′H)cDNA全长,然后利用RT-PCR技术分析该基因在不同贮期温度石榴果肉中的表达特性,为深入研究采后石榴果肉花青苷的含量变化奠定基础。
1材料和方法
1.1实验材料
供试材料为‘玉石籽’的成熟果实,于2014年9月16日采自安徽省蚌埠市怀远县,选择成熟度相同、果形匀称、大小一致(约300 g)和无机械伤的果实,置于4 ℃条件下预冷72 h后,将果实分成4批分别置于0 ℃、5 ℃、10 ℃和15 ℃条件下。定期(0、14、28、42和56 d)取样,并模拟货架期,置于20 ℃恒温环境条件下7 d后,剥取籽粒,液氮速冻后,于-80 ℃超低温冰箱中保存。
1.2花青素苷含量的测定
采用pH示差法[16]分别对不同贮藏温度不同贮藏期石榴果肉的花青苷含量进行测定:取混合石榴籽粒解冻,冰上研磨后,迅速转移至离心管称重,7 000 r/min离心10 min,收集上清液,记录上清液体积;取上清液1 mL,分别用0.4 mol/L KCl-HCl缓冲溶液(pH 1.0)和0.4 mol/L醋酸钠缓冲溶液(pH 4.5)稀释至5 mL,混匀,室温放置20 min;用蒸馏水作对照,在510和700 nm下测定光密度值,重复3次。
石榴果肉中花青苷含量(mg/g)=△A×M×DF×V×100/(m×ε×L),其中:A=(A510 nm-A700 nm)pH 1.0-(A510 nm-A700 nm)pH 4.5;M为矢车菊素-3-葡萄糖苷的相对分子质量(449.2 g/mol);DF为稀释因子;V为石榴汁体积(mL);m为称取的石榴果肉质量(g);ε为矢车菊素-3-葡萄糖苷的摩尔比吸收系数(26 900 L·mol-1·cm-1)],L为光程,1 cm。
1.3PgF3′5′H基因cDNA全长克隆
1.3.1PgF3′5′H基因中间片段的获得依据GenBank中已经登录的其他植物F3′5′H基因的DNA结合结构域保守区,使用软件Primer Premier 5.0设计目的片段的扩增引物F3′5′H-F和F3′5′H-R(表1),获取基因同源片段。利用艾德莱RNA试剂盒(北京艾德莱生物科技有限公司)提取“玉石籽”石榴果肉总RNA,用M-MLV反转录酶(Promega公司)合成cDNA,以其为模板进行PCR反应。反应条件为:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min,PCR产物用1.0%琼脂糖凝胶电泳检测。将PCR产物进行回收并连接至PGEM-Teasy载体(Promega)上,转化大肠杆菌DH5α(上海康润生物公司)进行克隆,挑取阳性单菌落进行测序。
1.3.2PgF3′5′H基因末端扩增及全长cDNA拼接根据获得的F3′5′H中间片段核苷酸序列,设计用于3′端和5′端克隆的基因特异性引物(表1)。参照SMARTerTMRACE cDNA扩增试剂盒(Clontech公司)说明书,以3′-CDS Primer A为接头,反转录得到3′-RACE-Ready cDNA,以5′-CDS Primer和BD SMART Ⅱ A oligo为接头,反转录得到5′-RACE-Ready cDNA。
采用巢式PCR法进行5′端扩增,F3′5′H-5′GSP1外特异性引物与UPM-Long作为第1轮扩增引物,以此PCR产物为模板,F3′5′H-5′GSP2内特异性引物与NUP作为引物进行第2轮扩增,获得F3′5′H基因的5′端序列,两轮扩增程序相同,退火温度分别为55 ℃和60 ℃。回收扩增产物并连接至PGEM-Teasy载体,转化大肠杆菌DH5α进行克隆,筛选阳性单菌落进行测序。分别用特异性引物F3′5′H-3′GPS1、F3′5′H-3′GPS2和通用引物UPM-Long和NUP,进行3′端扩增,两轮退火温度分别为55 ℃和58 ℃,扩增方法参照5′端扩增。将所得的5′端序列、3′端序列和目的片段进行拼接,获得PgF3′5′H基因的全长序列。
1.4PgF3′5′H基因的生物信息学分析
将PgF3′5′H基因序列在NCBI数据库中运用Blast工具进行序列比对和同源性分析;运用Finder软件(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)查找并翻译开放阅读框;运用ExPASy-Protparam Tool(http://web.expasy.org/protparam/)分析蛋白质的理化性质;运用NCBI(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行蛋白质保守结构域搜索;运用Claustalx和GENEDOC软件进行氨基酸序列比对和相似性分析;运用MEGA5软件构建系统进化树。
1.5石榴果肉PgF3′5′H基因在不同贮期温度的表达分析
利用艾德莱RNA试剂盒提取不同温度(0 ℃、5 ℃、10 ℃、15 ℃)处理石榴果肉的总RNA,采用Takara公司的PrimeScript®RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒将总RNA
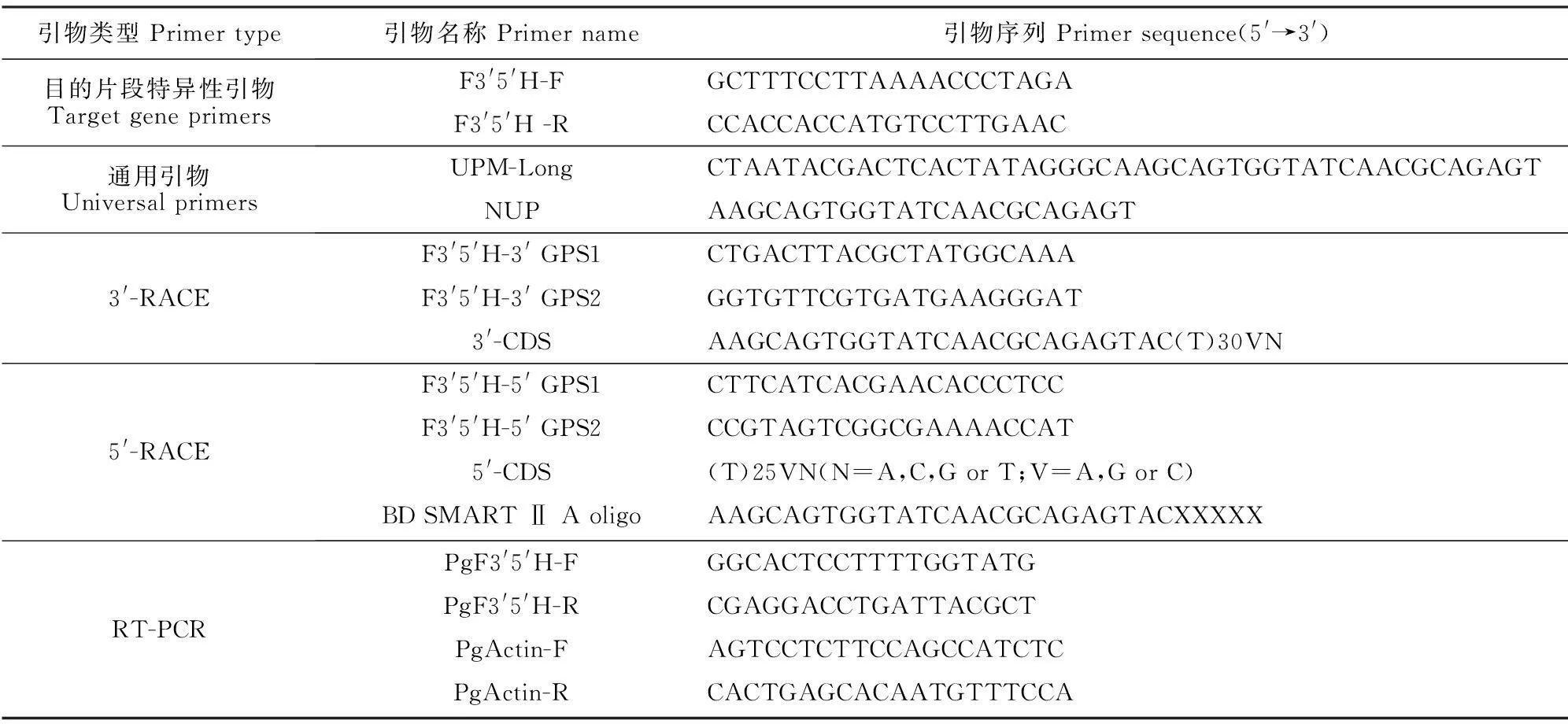
表1 本实验相关引物序列
反转录为cDNA。根据PgF3′5′H基因的全长序列,使用软件Primer Premier 5.0设计荧光定量PCR引物PgF3′5′H-F/PgF3′5′H-R(表1)。分别以不同处理的cDNA为模板,采用Actin基因作为内标对样品的cDNA模板量进行校准,进行特异性表达分析。反应体系按TaKaRa SYBR Premix ExTaq试剂盒步骤进行操作:SYBR Premix ExTaq(2×)为10 μL,ROX Peference Dye(50×)为0.4 μL,模板为2 μL,正反向引物(10 μmol/L)各0.8 μL,ddH2O为6.4 μL,总体系为20 μL。PCR扩增反应程序为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸1 min,共40个循环。每个样品各设置4个重复,以ROX作为荧光校正,使用2-△△Ct法进行相对表达量分析。
2结果和分析
2.1不同温度处理石榴果肉花青苷含量分析
采用pH示差法测得不同温度不同贮藏期石榴果肉的花青苷含量(图1)。在0℃和5℃贮藏条件下,石榴果肉花青苷含量在贮藏0~14 d过程中快速升高,花青苷含量差异均达到显著水平;贮藏14~42 d期间,花青苷含量处于一个比较稳定的阶段;贮藏42~56 d期间,花青苷含量急剧上升,达到最大值,分别为0 d的2.03和2.88倍。在10 ℃条件下,贮藏0~42 d期间,花青苷含量呈快速上升趋势,到42 d时达到高峰,为0 d的3.25倍,且各个阶段花青苷含量差异性均达到显著水平;到56 d时,花青苷含量开始缓慢下降,仅次于42 d。在15 ℃条件下,贮藏0~14 d花青苷含量快速上升,达到第一个高峰,为0 d的3.19倍;贮藏14~28 d开始缓慢下降,28~56 d又开始回升,到56 d时达到最高峰,为0 d的4.17倍,花青苷含量虽一直处于最高水平,但不稳定。结果表明:不同温度(0℃、5℃、10℃、15 ℃)处理条件下,石榴果肉花青苷含量随着贮藏时间(0~56 d)的增长均呈不断上升趋势;在整个贮藏过程中,15 ℃处理条件下,花青苷含量一直处于最高水平,10 ℃次之,5 ℃和0 ℃则处于较低水平。
2.2石榴PgF3′5′H基因的克隆
根据基因特异引物F3′5′H-F/F3′5′H-R扩增石榴果肉中F3′5′H基因目的片段,电泳回收后进行连接转化,筛选阳性克隆,测序得到一个367 bp的核酸片段(图2,A)。测序结果在NCBI网站的Blast中进行比较,发现该片段序列与锦绣杜鹃(Rhododendron×pulchrum)的RpF3′5′H(AB289598.1)的序列一致性高达80%,初步判断该片段为石榴F3′5′H基因序列片段。
5′端扩增得到一个486 bp的片段(图2,B),其5′端发现起始密码子ATG。NCBI序列对比结果显示,该片段序列与巨桉(Eucalyptusgrandis)的EgF3′5′H2-like(XM_010046774.1)的序列一致性高达83%,说明已克隆到石榴F3′5′H基因cDNA的5′端序列。3′端扩增得到一个503 bp的片段(图2,C),其3′端发现终止密码子TAA和PolyA尾巴,说明已到达3′末端。NCBI序列对比结果显示,该片段序列与山字草(Clarkiaarcuata)的CaF3′5′H1(KC019237.1)的序列一致性高达81%,分析确定为石榴F3′5′H基因的3′序列。将获得的3′段序列、5′段序列和目的片段序列进行拼接,得到一个长1 199 bp的cDNA序列。

小写字母表示同一温度不同贮期

M.DL2000;A.PgF3′5′H;B.5′-RACE;C.3′-RACE
2.3PgF3′5′H基因生物信息学分析
通过NCBI的ORF Finder分析,PgF3′5′H基因全长cDNA为1 199 bp,其中包含5′非编码区115 bp,3′非编码区166 bp和开放阅读框918 bp,编码一个含有305个氨基酸的蛋白质,起始密码子为ATG,终止密码子为TAA(图3)。将其命名为PgF3′5′H,GenBank登录号为KU058892。
Protparam分析其理化性质,推测该蛋白分子式为C1546H2477N419O404S23,相对分子量为34 135.6,等电点为9.89,理论推导其半衰期大约为30 h,不稳定参数为42.85,蛋白质性质不稳定(40以下为稳定蛋白);该蛋白中相对含量较多的氨基酸是亮氨酸Leu(10.5 %,32个)和丙氨酸Ala(9.2%,28个),含量较少的是半胱氨酸Cys(1.0%,3)和色氨酸Trp(1.3%,4个);总的带负电荷残基(Asp + Glu)为25,总的带正电荷残基(Arg + Lys)为41;脂肪族氨基酸指数为94.33,总平均疏水指数(GRAVY)为0.097,该蛋白为疏水性蛋白。
将PgF3′5′H基因编码的氨基酸序列进行同源性分析(图4),结果发现,该氨基酸序列与巨桉EgF3′5′H2、麻风树JcF3′5′H2和荷花NnF3′5′H2的氨基酸一致性较高,均达到80%以上。NCBI保守结构域搜索结果显示,PgF3′5′H氨基酸序列含有细胞色素P450家族基因的特征保守氨基酸序列:N端36~39处的CYP基序“PPGP”,为连接膜的锚定位点和酶蛋白的球体部分,在不同的物种中是高度保守区[17]。将PgF3′5′H推导的氨基酸序列与其它植物中调控花青苷合成代谢的F3′5′H氨基酸序列进行比对,并构建系统进化树(图5),发现PgF3′5′H与巨桉EgF3′5′H2(Accession:XP_010045081.1)的进化关系相对较近。

方框中碱基序列ATG表示起始密码子;*表示终止密码子TAA

图中从上至下依次代表的是石榴、巨桉、荷花、黑果茶藨、麻风树、甜橙、可可、

节点数字表示Bootstrap验证中基于1 000次重复的可信度(大于30%显示);标尺代表遗传距离;括号内编号为氨基酸登录号
2.4不同温度处理石榴果肉PgF3′5′H基因的差异表达分析
应用RT-PCR技术分析PgF3′5′H基因在不同贮期温度石榴果肉中的表达特性(图6)。在0 ℃贮藏条件下,0~14 d期间,PgF3′5′H基因表达量一直处于一个较低水平;14~42 d,PgF3′5′H基因表达量快速上升,达到高峰,为0 d基因表达量的3.54倍,且各阶段基因表达量差异显著;56 d又开始下降,仅次于42 d。在5 ℃和10 ℃条件下,PgF3′5′H基因表达量均呈现快速上升趋势,到56 d时,基因表达量分别为0 d的5.51和4.02倍;在15 ℃贮藏条件下,0~14 d期间,PgF3′5′H基因表达量急剧上升,14 d时达到第一个高峰,为0 d基因表达量的3.99倍;14~42 d期间,基因表达量急剧下降,下降了2.48倍,且各个阶段基因表达量差异显著;到56 d时,基因表达量又急剧上升,达到最大值,为0 d基因表达量的5.26倍。结果表明:在0 ℃、5 ℃、10 ℃处理条件下,石榴果肉PgF3′5′H基因表达量随着贮藏时间(0~56 d)的增长呈不断上升趋势;在15 ℃处理条件下,石榴果肉PgF3′5′H基因表达量14 d后表现不稳定。
用SPSS软件对不同温度处理石榴果肉PgF3′5′H基因表达量与花青苷含量(图1)进行相关性比较分析可知,PgF3′5′H基因表达与花青苷含量呈显著正相关(r=0.742,P<0.05)。

小写字母表示同一温度不同贮期相对表达量0.05水平差异显著性
3讨论
本研究通过分析不同温度贮期石榴果肉的花青苷含量发现:适当的低温(10 ℃)促进花青苷含量增长,这在许多植物中已经得到证实。如Yamane等[18]对葡萄、谢兴斌[19]对苹果、李智[20]对茶树的研究表明,适当的低温条件促进葡萄皮、苹果皮、茶树芽叶花青苷积累。而在较低温度(0 ℃和5 ℃)贮期下,石榴果肉花青苷含量增长缓慢,张学英等[21]对李的研究表明,李果实在0 ℃低温下的花青苷含量积累缓慢,说明促进植物花青苷积累的低温也是有一定阈值范围的,非常低的温度不利于花青苷的合成。温度稍高(15 ℃)时,石榴果肉花青苷含量不稳定。Huh等[22]对菊花、Poudel等[23]对葡萄的研究表明,高温(30 ℃左右)会影响花青苷的稳定性,也就是说当温度升高时,花青苷的合成速率会减慢,降解速率却增加,进而导致花青苷的积累量降低,至于高温对采后石榴果肉花青苷积累及稳定性的影响,还有待进一步研究。可见,温度不仅影响采后石榴果肉花青苷积累,还影响其稳定性。
经过F3′5′H氨基酸多序列比对发现,PgF3′5′H含有与其他F3′5′H相似的保守区,不同物种F3′5′H氨基酸序列的主要差异存在于N端约31个氨基酸,这段序列主要含有疏水氨基酸残基,是膜插入点的信号序列[24]。F3′5′H属于细胞色素P450家族的单加氧酶[11],细胞色素P450家族基因含有3个特征保守氨基酸序列:N端CYP基序“PPGP”、I螺旋基序“AGTDT”和血红素(HBR)结合区域序列“FGAGRRICAG”[17]。PgF3′5′H仅含有CYP基序,缺少I螺旋基序和HBR结合区域序列,这与矮牵牛(Petunia×hybrida)的PhF3′5′H氨基酸序列(BAF64483.1)相一致。至于这些基序的缺乏对石榴果肉花青苷的生物合成有什么具体影响,还需要进一步验证。
通过RT-PCR技术分析发现,不同温度贮期石榴果肉PgF3′5′H基因的相对表达量存在差异:适当的低温(5 ℃和10 ℃)促进PgF3′5′H基因的表达;而在较低温度(0 ℃)下,PgF3′5′H基因的表达量增长缓慢;温度稍高(15 ℃)时,石榴果肉PgF3′5′H基因的表达量虽然显著上升,但不稳定。可见,温度影响PgF3′5′H基因的表达。另外,不同贮期温度石榴果肉PgF3′5′H基因表达与花青苷含量呈显著正相关,推测PgF3′5′H基因促进石榴果肉花青苷的合成。这与近年来国内外许多研究结果相一致,如葡萄(Vitisvinifera)VvF3′5′H[25]和月季(Rosahybrida)RhF3′5′H[26]基因的表达有助于花青苷含量的增长。另外,通过转基因技术引入外源F3′5′H基因来改变植物花青苷积累,已在多种植物上获得成功,如风铃草(Campanulamedium)的CmF3′5′H基因[27]和野茶树(Camelliasinensis)的CsF3′5′H基因[28]转化烟草,转化株系中均提高了花青苷含量。花青苷是影响石榴品质的一个重要因子,由于花青苷生物合成途径复杂,至于其他结构基因、调节基因和环境因子对采后石榴果肉花青苷积累的影响,还有待进一步研究。
参考文献:
[1]ZHAO X Q,YUAN Z H,FENG L J,etal.Cloning and expression of anthocyanin biosynthetic genes in red and white pomegranate[J].JournalofPlantResearch,2015,128:687-696.
[2]冯玉增,胡清波.无公害农产品高效生产技术丛书:石榴[M].北京:中国农业大学出版社,2007:5-6.
[3]冯立娟,尹燕雷,苑兆和,等.不同发育期石榴果实果汁中花青苷含量及品质指标的变化[J].中国农学通报,2010,26(3):179-183.
FENG L J,YIN Y L,YUAN Z H,etal.Change of anthocyanin content and quality index in pomegranate fruits during different developmental period[J].ChineseAgriculturalScienceBulletin,2010,26(3):179-183.
[4]赵贝塔.不同石榴品种花色苷的提取、纯化工艺及抗氧化活性研究[D].陕西杨凌:西北农林科技大学,2014.
[5]郭松年,董周永,孙海燕,等.石榴汁花色苷热稳定性及其降解动力学研究[J].农业工程学报,2008,24(3):256-259.
GUO S N,DONG Z Y,SUN H Y,etal.Stability of anthocyanin in pomegranate juice and its degradation kinetics[J].TransactionsoftheChineseSocietyofAgriculturalEngineering,2008,24(3):256-259.
[6]胡可,韩科厅,戴思兰.环境因子调控植物花青素苷合成及呈色的机理[J].植物学报,2010,45(3):307-317.
HU K,HAN K T,DAI S L.Regulation of plant anthocyanin synthesis and pigmentation by environmental factors[J].ChineseBulletinofBotany,2010,45(3):307-317.
[7]李秀芳,杨拉弟,韩叶,等.温度对采后‘红富士’苹果果皮色泽、色素及其相关酶活性变化的影响[J].西北农业学报,2014,23(5):97-103.
LI X F,YANG L D,HAN Y,etal.Effects of temperature on peel color,pigments and activities of related enzymes of ‘Red Fuji’ apple during post-harvest storage[J].ActaAgriculturaeBoreali-OccidentalisSinica,2014,23(5):97-103.
[8]MORI K,GOTO-YAMAMOTO N,KITAYAMA M,etal.Loss of anthocyanins in red-wine grape under high temperature[J].JournalofExperimentalBotany,2007,58:1 935-1 945.
[9]STILES E A,CECH N B,DEE S M,etal.Temperature-sensitive anthocyanin production in flowers ofPlantagolanceolata[J].PhysiologiaPlantarum,2007,129:756-765.
[10]卢其能.马铃薯花色苷及其生物合成的主要关键酶基因的克隆与表达分析[D].南京:南京农业大学,2006.
[11]刘晓芬,李方,殷学仁,等.花青苷生物合成转录调控研究进展[J].园艺学报,2013,40(11):2 295-2 306.
LIU X F,LI F,YIN X R,etal.Recent advances in the transcriptional regulation of anthocyanin biosynthesis[J].ActaHorticulturaeSinica,2013,40(11):2 295-2 306.
[12]张龙,李卫华,姜淑梅,等,花色素苷生物合成与分子调控研究进展[J].园艺学报,2008,35(6):909-916.
ZHANG L,LI W H,JIANG S M,etal.Progress of molecular basis of biosynthesis and transcriptional regulation of anthocyanins [J].ActaHorticulturaeSinica,2008,35(6):909-916.
[13]李霞,王欣,刘亚菊,等.甘薯花青苷生物合成调控研究进展[J].分子植物育种,2014,12(3):567-576.
LI X,WANG X,LIU Y J,etal.Progress on anthocyanin biosynthesis of sweetpotato[J].MolecularPlantBreeding,2014,12(3):567-576.
[14]BOASE M R,LEWIS D H,DAVIES K M,etal.Isolation and antisense suppression of flavonoid 3′,5′-hydroxylase modifies flower pigments and colour in cyclamen[J].BMCPlantBiology,2010,10:107.
[15]JUNG C S,GRIFFITHS H M,DE JONG D M,etal.The potato P locus codes for flavonoid 3′,5′-hydroxylase[J].TheoreticalandAppliedGenetics,2005,110:269-275.
[16]杨兆艳.pH示差法测定桑葚红色素中花青苷含量研究[J].食品科技,2007,(4):201-203.
YANG Z Y.Anthocyanin content in mulberry red pigment by pH-differential spectrophotometry[J].FoodScienceandTechnology,2007,(4):201-203.
[17]田新惠.彩色棉GhF3′H和GhF3′5′H基因的克隆、鉴定及四种类黄酮物质的HPLC分析[D].新疆石河子:石河子大学,2010.
[18]YAMANE Y,JEONG ST,GOTO-YAMAMOTO N,etal.Effects of temperature on anthocyanin biosynthesis in grape berry skins[J].AmericanJournalofEnologyandViticulture,2006,(57):54-59.
[19]谢兴斌.苹果 bHLH 转录因子MdTTL1对低温诱导花青苷合成和果实着色的多途径调控[D].山东泰安:山东农业大学,2011.
[20]李智.不同环境因子调控茶树紫色芽叶形成的分子机制研究[D].山东泰安:山东农业大学,2014.
[21]张学英,张上隆,秦永华,等.温度对李果实采后花色素苷合成的影响,园艺学报,2005,32(6):1 073-1 076.
ZHANG X Y,ZHANG S L,QIN Y H,etal.Effects of temperature on anthocyanin synthesis of postharvest plum fruit[J].ActaHorticulturaeSinica,2005,32(6):1 073-1 076.
[22]HUH E J,SHIN H K,CHOI S Y,etal.Thermosusceptible developmental stage in anthocyanin accumulation and color response to high temperature in red chrysanthemum cultivars[J].KoreanJournalofHorticulturalScience&Technology,2008,26:357-361.
[23]POUDEL P R,MOCHIOKA R,BEPPU K,etal.Influence of temperature on berry composition of interspecific hybrid wine grape ‘Kadainou R-1’ (Vitisficifoliavar.ganebu×V.vinifera‘Muscat of Alexandria’)[J].JournaloftheJapaneseSocietyforHorticulturalScience,2009,78:169-174.
[24]孟丽,戴思兰.瓜叶菊F3′5′H基因cDNA的克隆、序列分析及其原核表达[J],分子植物育种,2005,3(6):780-786.
MENG L,DAI S L.Cloning,sequencing and prokaryotic expression ofF3′5′HcDNA fromPericalliscruentia(L.) Herit.[J].MolecularPlantBreeding,2005,3(6):780-786.
[25]CASTELLARIN S D,GASPERO G D,MARCONI R,etal.Colour variation in red grapevines (VitisviniferaL.):genomic organization,expression of flavonoid 3′-hydroxylase,flavonoid 3′,5′-hydroxylase genes and related metabolite profiling of red cyanidin-/blue delphinidin-based anthocyanins in berry skin[J].BMCGenomics,2006,7:12.
[26]KATSUMOTO Y,FUKUCHI-MIZUTANI M,FUKUI Y,etal.Engineering of the rose flavonoid biosynthetic pathway successfully generated blue-hued flowers accumulating delphinidin[J].PlantandCellPhysiology,2007,48:1 589-1 600.
[27]OKINAKA Y,SHIMADA Y,NAKANO-SHIMADA R,etal.Selective accumulation of delphinidin derivatives in tobacco using a putative flavonoid 3′,5′-hydroxylase cDNA fromCampanulamedium[J].BioscienceBiotechnologyandBiochemistry,2003,67:161-165.
[28 ]WANG Y S,XU Y J,GAO L P,etal.Functional analysis of flavonoid 3′,5′-hydroxylase from tea plant (Camelliasinensis):critical role in the accumulation of catechins[J].BMCPlantBiology,2014,14:347.
(编辑:宋亚珍)
Clone ofPgF3′5′HGene in Pomegranate Pulp and Its Expression under Different Temperature Treatments
GUAN Xiaowan,CHEN Lei,TU Jiali,ZHANG Shuiming*
(College of Horticulture,Anhui Agricultural University,Hefei 230036,China)
Abstract:To explore the effects of different temperature treatments on anthocyanin contents of postharvest pomegranate pulp,and the function of anthocyanin biosynthesis-related gene (F3′5′H) in anthocyanin biosynthesis pathway of pomegranate pulp,taking pomegranate cultivar ‘Yushizi’ as test materials,we measured anthocyanin contents of pomegranate pulp under different temperature (0 ℃,5 ℃,10 ℃,15 ℃) treatments.At the same time a anthocyanin biosynthesis-related gene was cloned from pomegranate pulp by RACE,named PgF3′5′H(GenBank accession:KU058892).The expression levels of PgF3′5′H in pomegranate pulp during different temperature storage periods were analyzed by RT-PCR.The results showed that:(1)under different temperature treatments,anthocyanin contents of pomegranate pulp showed a rising trend as the storage time (0-56 d) went on;In the whole storage time,anthocyanin contents were the highest under 15 ℃ treatments,secondly 10 ℃,5 ℃ and 0 ℃ at lower levels;Anthocyanin contents under 15 ℃ were unstable after 14 d.(2)The full-length cDNA of PgF3′5′H was 1 199 bp with an open reading frame of 918 bp encoding 305 amino acids.The 36th to 39th amino acids of the N-terminus of PgF3′5′H contained the characteristic conserved sequences (CYP motif “PPGP”) of the cytochrome P450 family genes;Bioinformatics showed that the amino acid sequences of PgF3′5′H had high consistency with Eucalyptus grandis EgF3′5′H2,Jatropha curcas JcF3′5′H2 and Nelumbo nucifera NnF3′5′H2 as 86%,82% and 81%,respectively.(3)The expression levels of PgF3′5′H showed a rising trend as the storage time (0-56 d) went on under 0 ℃,5 ℃ and 10 ℃ treatments,being unstable under 15 ℃;The relative expression of PgF3′5′H was significantly positively correlated with anthocyanin contents of pomegranate pulp.The research results laid the foundation for exploring the changes of anthocyanin contents in postharvest pomegranate pulp.
Key words:pomegranate pulp;anthocyanin;temperature;PgF3′5′H;RACE;RT-PCR
中图分类号:Q785;Q786
文献标志码:A
作者简介:关晓弯(1989-),女,在读硕士研究生,主要研究果树资源与生物技术育种。E-mail:15256564232@163.com*通信作者:张水明,博士,副教授,主要从事园艺植物种质资源与生物技术育种研究。E-mail:zhangshm893@sohu.com
基金项目:国家自然科学基金(30900971)
收稿日期:2015-12-26;修改稿收到日期:2016-02-01
文章编号:1000-4025(2016)03-0435-09
doi:10.7606/j.issn.1000-4025.2016.03.0435
