化学平衡常数的应用分析
2016-04-28王明果
化学平衡常数的应用分析
◇陕西王明果
化学平衡常数是高中化学中十分重要的基础理论,在近些年的高考试题中,对化学平衡常数相关知识的考查稳中有升,因此,需要加强化学平衡常数相关知识的教学,提升学生对“化学平衡常数”的实际应用能力.
1化学平衡常数相关知识
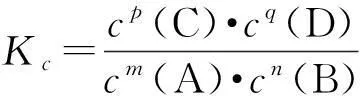
在利用化学平衡常数进行相关问题解答时,需要注意4个方面的问题.
1) 稀溶液中的水分子浓度可忽略不计,因为稀溶液的密度十分接近1 g·mL-1.在化学反应的发生过程中,水量多少的改变对溶液浓度变化影响并不大,因此可以将其看作常数.对于溶剂不是水的溶液,其溶剂浓度的处理方式和水溶液相同.
2) 如果化学反应有固体物质参与,主要是在固体表面进行,固体摩尔浓度对化学反应平衡和速率不会产生影响.所以,在化学反应中,固体浓度也是常数,在化学平衡常数方程中可以省略.
3) 化学方程式书写不一样,化学反应中各种物质的计量数也不一样,这就会导致平衡常数发生变化.
4) 化学平衡体系不一样,平衡常数是不一样的.平衡常数越大,说明生成物的平衡浓度越大,化学反应越彻底.因此,可以根据化学平衡常数的大小判断化学反应的程度.一般来说,若K>105,说明反应完全,且不可逆;若K<10-5,说明反应不进行.
2化学平衡常数的应用
2.1在基础题目中的应用

2NO2(g)+NaCl(s)⟺NaNO3(s)+ClNO(g),K1,ΔH<0;
2NO(g)+Cl2(g)⟺2ClNO(g),K2,ΔH<0.
试求: (1) 4NO2(g)+2NaCl(s)⟺2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K.
(2) 为了在不同条件下对第2个反应的影响进行研究,用2 L的容器进行反应,并向其加入0.1 mol Cl2, 以及0.2 mol NO,通过10 min反应达到平衡,测出v(ClNO)=7.5×10-3mol·L-1·min-1,在反应达到平衡之后Cl2的物质的量和NO的转化率为多少?如果其他条件不变,该反应在恒压条件下NO的转化率与恒压之前的转化率相比孰大孰小?
分析对于第(1)问,将第1个反应乘以2,再减去第2个反应,就可以得出4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g),因此可以求出其化学平衡常数为对于第(2)问,转化的n(Cl2)=1/2×7.5×10-3mol·L-1·min-1×2 L×10 min=7.5×10-2mol,在反应达到平衡后,n(Cl2)=2.5×10-2mol;转化的n(NO)=0.15 mol,则NO的转化率为%;在恒压条件下,由于分子数在不断减少,因此需要不断缩小反应体积,相当于对反应过程加压,可以提升化学反应程度,即促使转化率a2增大.此处可以更深入一步探究,在温度不变的条件下,由于反应放热,会促使反应左移,导致转化率减小.
2.2在电离水解中的应用
在电离水解的相关题目中,对化学平衡常数的考查也比较深入.

A水电离程度不断增大;
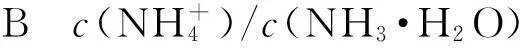
Cc(CH3COO-)和c(CH3COOH)的和一直为固定值;


(作者单位:陕西省咸阳中学)
