13个藜麦材料在甘肃临夏旱作区适应性的初步评价
2016-04-27黄杰杨发荣李敏权魏玉明顾娴漆永红
黄杰,杨发荣*,李敏权,魏玉明,顾娴,漆永红
(1.甘肃省农业科学院畜草与绿色农业研究所,甘肃 兰州 730070;2.甘肃省农业科学院,甘肃 兰州 730070;
3.甘肃省农业科学院植物保护研究所,甘肃 兰州 730070)
13个藜麦材料在甘肃临夏旱作区适应性的初步评价
黄杰1,杨发荣1*,李敏权2,魏玉明1,顾娴1,漆永红3
(1.甘肃省农业科学院畜草与绿色农业研究所,甘肃 兰州 730070;2.甘肃省农业科学院,甘肃 兰州 730070;
3.甘肃省农业科学院植物保护研究所,甘肃 兰州 730070)
摘要:本研究以13个藜麦引选品种为材料,测定记录其出苗率、物候期、植物学特征、产量、品质及抗性等指标,并应用聚类分析法对其主要性状的相关性进行评价,探究供试品种在甘肃临夏旱作区的适应性表现。结果表明,13个藜麦供试品种在试验区域均可以成熟,并且这些品种在株高、分枝数、有效分枝率、主枝穗长度、主枝穗直径、千粒重、产量、粗蛋白、粗纤维含量等指标上差异显著;通过聚类分析发现品种Q7、Q8属于矮化早熟品种,品种Q9经济性状最好,产量达4246.6 kg/hm2,较对照增产1252.1 kg/hm2,品种Q1、Q7、Q8、Q9、Q(10)均属于抗病品种;不同藜麦品种表型性状与产量性状、品质性状无显著相关性,但产量和品质呈负相关。综合产量性状、品质性状和抗性评价,品种Q9的经济性状最优,具有在甘肃临夏旱作区大面积推广种植的潜力。
关键词:藜麦品种;农艺性状;品质性状;抗病性
藜麦(Chenopodiumquinoa)属双子叶一年生藜科植物,是一种安全的碱性食物,蛋白质含量高达14%~22%,其品质可与奶粉、肉类相媲美[1-3]。由于不含胆固醇、低脂(6%)、低热量(1276 J/100 g)、低糖[升糖指数(Glycemic index,GI)值35],以及完美的氨基酸组成和丰富的矿物质营养[4],已成为三高人群、糖尿病患者、孕婴的理想食品[5-6]。联合国粮农组织(FAO)认为藜麦是唯一一种含有完全蛋白且可满足人体基本营养需求的单体植物[7-8]。相比国外,我国对藜麦的相关研究较少,20世纪80年代,西藏将藜麦首次引入中国,并对藜麦进行苗期霜冻抗性研究[9-10]、生物学特性评价[11]、藜麦品质分析[12]及病害防治[13]等研究工作,但由于藜麦在西藏地区产量不高,且病虫害时有发生,未能进行大面积推广。近年来,随着人们对藜麦的关注和认知[14-15],前人研究结果显示藜麦具有良好的抗寒、抗旱、耐盐碱等特性[16-23],我省气候干旱,土壤偏碱性,贫瘠,昼夜温差大,与其他作物相比,种植藜麦更具有良好的生态适应性[24-25]。
目前,国内也开展了藜麦引种栽培和分子等方面的初步研究,成明锁等[26]总结了藜麦的种植和栽培技术;周海涛等[27]研究了藜麦在张家口地区的试种效果,结果表明藜麦的品质特性及增产能力等特性能够充分表现,说明适宜在此地区种植;马文彪[28]论述了藜麦在山西吕梁山北段高寒山区的高产栽培技术;陆敏佳等[29]利用SSR(simple sequence repeats)标记技术对搜集的41个藜麦种植的多态性及其亲缘关系进行了分析,结果表明来源于不同地区的藜麦种质遗传距离较远,遗传基础较广泛。由于藜麦品种对温度、日照时长及光周期反应敏感[30-31],因此,本研究通过对引选的13个藜麦品种在甘肃临夏旱作区进行农艺性状、产量性状、品质性状及抗性鉴定,并进行综合适应性评价,筛选适宜甘肃旱作区高产栽培的藜麦品种,为藜麦的推广种植提供依据。
1材料与方法
1.1试验区概况
试验区位于甘肃省临夏州永靖县三塬镇下塬村,地处甘肃省中部黄河上游,典型的旱作农业区,地理位置为E 103°15′31″,N 35°53′31″,海拔1816 m,地势平缓,年均气温10℃左右,最高气温35℃,最低气温-23℃,年均降水量260 mm左右,蒸发量1500 mm,平均日照时数2534.6 h,无霜期145 d,土壤有机质含量为9.02 g/kg,全氮含量为0.6 g/kg,全磷含量为0.35 g/kg,全钾含量为25.85 g/kg,碱解氮含量为53.00 mg/kg,速效钾含量为151.00 mg/kg,速效磷含量为13.19 mg/kg,鲜土样水分含量为9.45%,土壤呈碱性,pH值为8.64。
1.2试验材料
供试的藜麦种质材料见表1,试验所用的肥料为磷酸二铵(云南三环中化美盛化肥有限公司,总养分≥64.0%,N、P、K有效含量为18%,46%,0)、黄腐酸钾(山旺生物科技有限公生产,有效成分≥52%)、尿素[甘肃刘化(集团)有限责任公司生产,总氮≥46.4%];播种前施底肥(磷酸二铵375 kg/hm2、黄腐酸钾150 kg/hm2),对土地精细旋耕,镇压和耙耱,做到土质绵软,墒足平整。
1.3试验设计
试验于2014年5月4日播种,以山西大面积种植的藜麦品种为对照(CK),随机区组设计,小区面积为18 m2,开沟点播,每穴点3粒种子,播种深度2 cm,行距50 cm,株距30 cm,播种量9 kg/hm2,重复3次, 4~6叶期间苗,每穴留苗一株,每hm2保苗66690株,同时及时除草,第2次中耕除草时,在藜麦根部追肥(尿素75 kg/hm2)并培土。
1.4测定内容与方法
1.4.1苗情观测于出苗期统计每份材料每个小区的出苗数,计算出苗率,重复3次,取平均值。
出苗率=出苗穴数/播种总穴数×100%
1.4.2农艺性状1) 物候期观测:从播种当年开始记载各个材料的出苗期、分枝期、初花期、成熟期。
2) 株高:每份材料每个小区选取5株,于收获期测其自然高度,从地面量至植株生长的最高部位,取平均值,重复3次。
3) 分枝数、有效分枝数:成熟期从最贴近地面处数每株分枝数,将其记为总分枝数,其中结实的分枝记为有效分枝数,每份材料每小区随机选5株,重复3次,取平均值,并计算有效分枝率。

表1 藜麦品种来源及特性
注:所引选的材料品种名称均以代号表示。下同。
Note: The lead name chosen materials are expressed as a symbol. The same below.
有效分枝率=单株有效分枝数/单株总分枝数×100%
4) 主枝穗长度、直径:于成熟期测藜麦植株主穗长度,从主穗基部量至主穗顶端,每份材料每个小区取5株,取平均值,重复3次。
5) 分枝穗长度、直径:于成熟期测藜麦植株分枝穗长度,从植株分枝夹角处量至分枝穗顶部,每份材料每个小区取5株,取平均值,重复3次。
6) 千粒重:每份材料随机选取1000粒种子,进行称重,重复3次,取平均值。
7) 产量:将成熟期的种子收获后脱粒、晒干扬净,进行称重,重复3次,取平均值。
8) 倒伏率:于成熟期统计每份材料每个小区倒伏株数,包括根倒伏和茎倒伏,计算倒伏率,重复3次,取平均值。
倒伏率=小区倒伏株数/小区总株数×100%
1.4.3品质分析粗蛋白测定用凯氏定氮法[32],粗脂肪测定用索氏抽提法[33]。
1.4.4病害调查分别于藜麦的幼苗期和灌浆期调查霜霉病和叶斑病,每个小区随机调查10株,自上而下调查全部叶片,参照表2记录各级病叶数和总叶数,病情指数=100×∑(各级病叶数×各级代表值)/(调查总叶数×最高级代表值)。
1.5数据处理与分析
采用Microsoft Excel 2010 进行数据处理,结果以“平均值±标准误”表示, 利用SPSS 19.0和DPS 7.05版软件对数据进行差异显著性分析、欧式最近距离法聚类分析以及系统法相关性分析。
2结果与分析
2.1不同藜麦品种出苗率分析
不同藜麦品种的出苗率不同,除了Q7和Q8品种,其余的11个藜麦品种出苗率均达到100%,Q7、Q8的出苗率分别为94%,91%。这和种子本身的发芽率低有关,导致Q7、Q8出苗率低下。
2.2不同藜麦品种农艺性状分析
2.2.1不同藜麦品种物候期分析如表3所示,不同藜麦品种出苗期和分枝期(四叶期)趋势一致,Q7和Q8品种出苗期均晚于其他品种2 d,分别需要14 d;Q4品种分枝最早,需要32 d,较CK分枝期提前了3 d,其次是Q3、Q5、Q6品种,分枝需要33 d,较CK分枝期提前2 d;不同藜麦品种初花期均有所不同,开花最早的Q4和Q10品种,初花期需要61 d,较CK提前了2 d,Q3、Q6品种与CK初花期相同,需要63 d,开花最晚的Q9品种初花期需要68 d,较CK晚了5 d;不同藜麦品种的生育期长短差异明显,生育期最长的CK为134 d,生育期最短的Q8为115 d,生育期长短的顺序为:CK>Q2=Q11=Q12>Q10>Q1>Q9>Q3=Q5=Q6>Q4>Q7>Q8。
2.2.2不同藜麦品种植物学性状分析不同藜麦品种植物学性状差异显著 (表4)。不同藜麦品种的株高有差异,品种CK、Q1、Q2、Q11、Q12与品种Q7、Q8株高差异显著(P<0.05),而品种Q3、Q4、Q5、Q6、Q8、Q9、Q10间株高差异不显著;不同品种间分枝数差异不显著,分枝数最多的Q1为24.3个,分枝数最少的Q6为22.2个;不同品种间有效分枝率差异显著(P<0.05),品种Q7较Q2有效分枝率差异显著(P<0.05),Q7有效分枝率最高,为74.5%,Q2有效分枝率最低,仅为49.8%;不同品种间主枝穗长度和侧枝穗长度均差异显著(P<0.05),品种Q8较CK、Q11主枝穗长度差异显著(P<0.05),主枝穗长度最长的Q11达58.7 cm,CK、Q9、Q10品种较Q2、Q6品种侧枝穗长度差异显著(P<0.05),Q3、Q5、Q8、Q11品种间侧枝穗长度差异不显著,品种Q2较CK、Q1、Q3、Q4、Q5、Q6、Q7、Q8、Q9侧枝穗长度差异显著(P<0.05),Q10、Q11、Q12品种间侧枝穗长度差异显著(P<0.05),CK、Q1、Q3、Q4、Q5、Q6、Q7、Q8、Q9品种间侧枝穗长度差异不显著;Q4、Q8、Q10、Q11品种间主枝穗直径差异不显著,主枝穗直径最大的Q9品种为15.6 cm,品种CK、Q9较Q2、Q5、Q6、Q12主枝穗直径差异显著(P<0.05),侧枝穗直径最大的Q7品种为4.0 cm;不同藜麦品种的茎秆和穗在成熟期时颜色有所差异,品种Q1、Q4、Q5、Q9的茎秆在成熟期呈显红色,其余品种呈显黄色,品种Q2、Q5、Q9、Q10的穗部在成熟期呈显红色,其余品种呈显黄色;供试的13个藜麦品种在该地区株型均呈现出紧凑特性。

表2 病害分级标准

表3 不同藜麦品种物候期对比
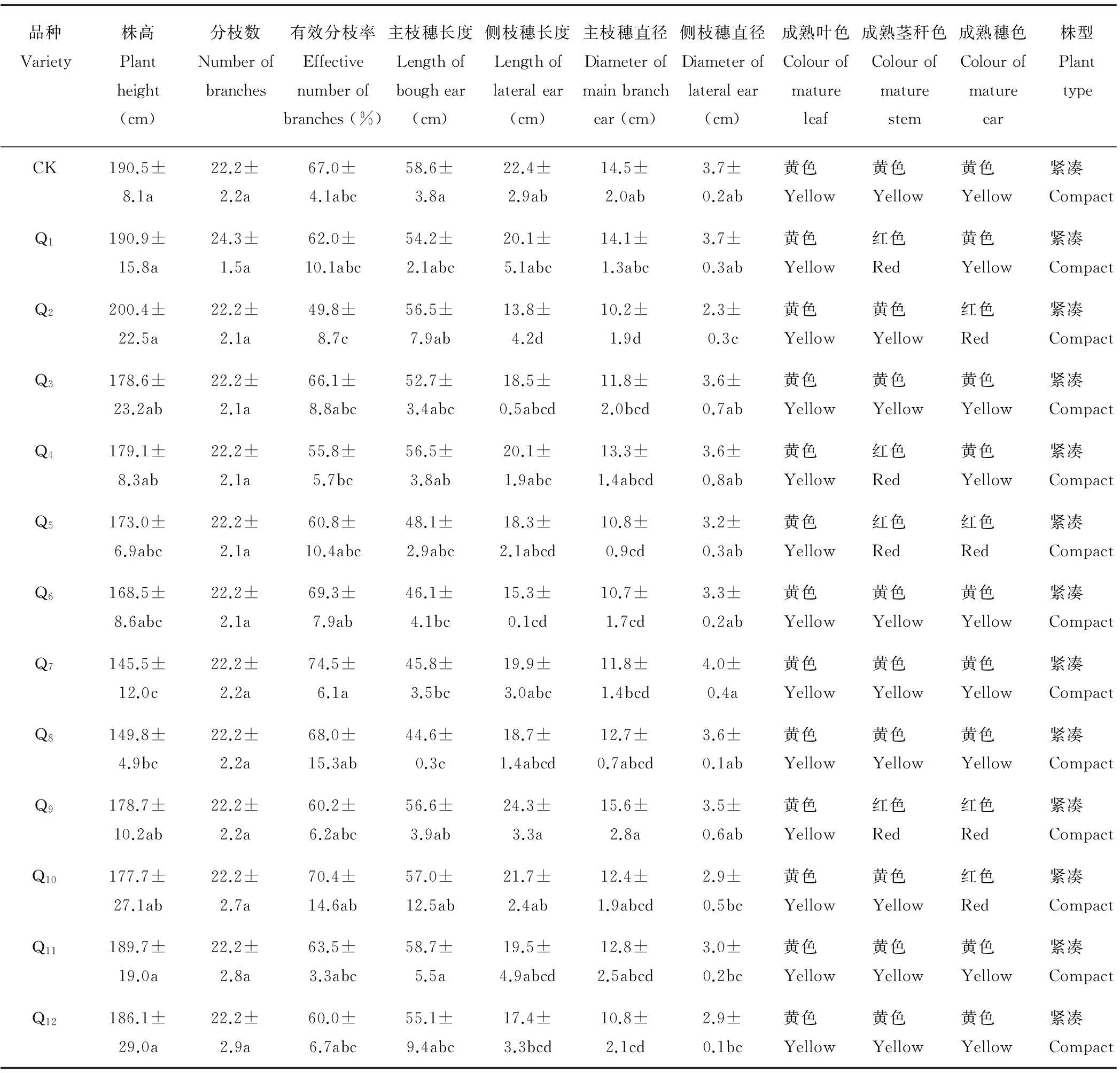
表4 不同藜麦品种的植物学性状分析
注:同列不同小写字母表示0.05水平差异显著,下同。
Note: The different small letters in the same column stand for significant difference at 0.05 level. The same below.
2.2.3不同藜麦品种的产量性状分析如图1所示,不同藜麦品种的生产性能有一定差异,品种Q9是引选品种中产量最高的,产量达4246.6 kg/hm2,较对照增产1252.1 kg/hm2,且与品种CK、Q1、Q2、Q7、Q8、Q12间差异显著;品种Q8是引选品种中产量最低的,只有2185.9 kg/hm2,较CK减产808.6 kg/hm2,与品种Q4、Q5、Q6、Q9、Q10、Q11间差异显著;引选的藜麦品种产量排序为Q9>Q4>Q6>Q5>Q11>Q10>Q3>Q1>Q2>Q7>CK>Q12>Q8。
2.3不同藜麦品种品质性状分析
千粒重、粗蛋白、粗脂肪是藜麦品质分级的主要性状。如表5所示,在试验区域内,不同藜麦品种的千粒重有一定差异,其中品种Q1、Q2、Q5千粒重均高于CK,较CK分别高出0.5,0.6和0.1 g,除Q4外其余品种千粒重均小于CK。
引选的各品种粗蛋白含量差异不显著,其中Q2、Q7、Q11、Q12的粗蛋白含量均高于CK;不同品种间的粗脂肪含量存在差异,品种Q9粗脂肪含量最高,达6.99%,与品种Q10粗脂肪含量差异不显著,与其他各品种粗脂肪含量差异达显著水平,粗脂肪含量最低的品种为Q2,含量仅为4.03%,分别较CK和Q9粗脂肪含量低2.05和2.96个百分点,且与各品种粗脂肪含量差异显著。
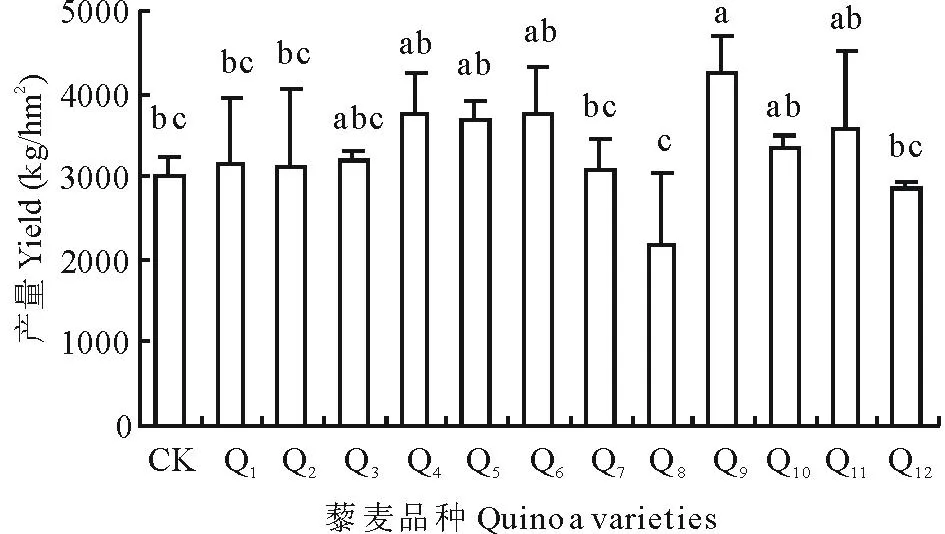
图1 不同藜麦品种产量性状分析 Fig.1 The analyze of yield trait of different quinoa varieties 柱上不同小写字母表明不同品种之间存在显著差异(P<0.05),下同。Different letters above bars indicate significant differences among different varieties at P<0.05. The same below.
2.4不同藜麦品种抗性分析
2.4.1不同藜麦品种的抗倒伏分析不同藜麦品种根倒伏率有差异(图2)。根倒伏率最高的为品种Q4,达3.1%,与CK、Q6、Q8、Q9、Q10根倒伏率差异显著,Q1、Q2、Q5、Q7、Q11、Q12与其他品种根倒伏率差异均不显著,品种Q9抗根倒伏性最强,根倒伏率最低,仅为0.3%,其次是Q8,根倒伏率为0.4%。不同品种茎倒伏率也有差异,如图3所示,Q9茎倒伏率最低,仅为1.2%,其次是Q8,茎倒伏率为2.2%;茎倒伏率最高的是Q6,达19.6%,其次是Q4,达18.8%;品种Q3、Q4、Q6茎倒伏率差异不显著,品种Q1、Q2、Q5、Q7、Q8、Q9、Q10、Q11、Q12之间茎倒伏率差异不显著,且分别与Q4、Q6茎倒伏率差异显著;品种Q3与Q8、Q9茎倒伏率差异显著,与其他各品种之间茎倒伏率差异不显著。综合不同藜麦品种根倒伏率和茎倒伏率,品种Q8和Q9的根倒伏率与茎倒伏率均比较小,属于抗倒伏藜麦品种。
2.4.2不同藜麦品种抗病性分析霜霉病和叶斑病是危害藜麦的主要病害。如图4所示,不同藜麦品种对霜霉病的抗性表现出明显的差异。13个品种霜霉病病情指数由大到小排序为:Q11>Q6>Q3>Q2>Q12>CK>Q5>Q4>Q1>Q8>Q10>Q9>Q7,抗霜霉病最好的Q7品种, 病情指数仅为3.4,其次是Q9, 病情指数为5.8,抗霜霉病最差的品种是Q11,病情指数为39.3,抗霜霉病优于CK的品种有7个品种,分别是Q7、Q9、Q10、Q8、Q1、Q4、Q5。

表5 不同藜麦品种的品质特性分析
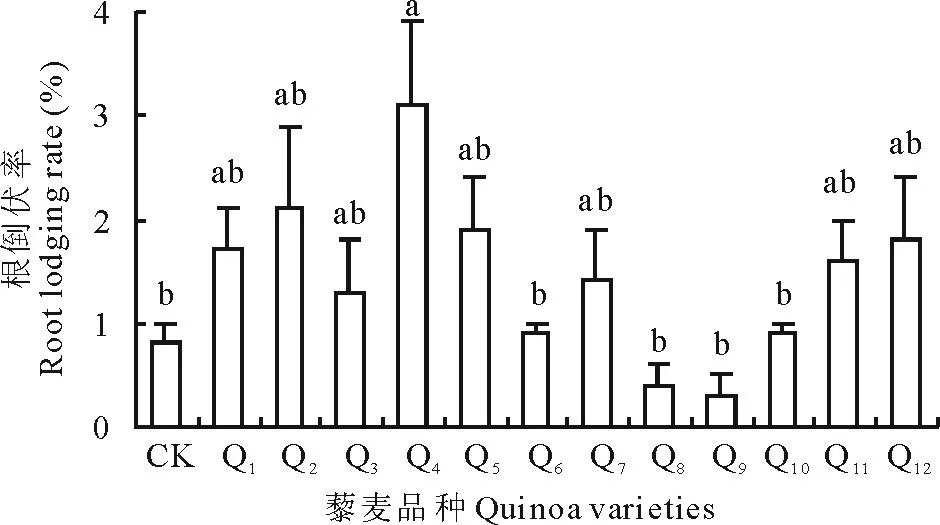
图2 根倒伏率分析Fig.2 The analyze of root lodging rate
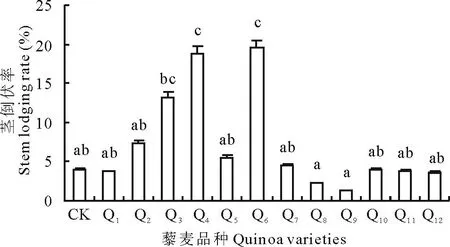
图3 茎倒伏率分析Fig.3 The analyze of stem lodging rate

图4 不同藜麦品种霜霉病及叶斑病分析Fig.4 The analyze of downy mildew and leaf spot disease of different quinoa varieties
不同藜麦品种对叶斑病的抗性也表现出明显的差异。13个藜麦品种叶斑病病情指数由大到小排序为:Q2>Q12>Q11>CK>Q6>Q5>Q3>Q4>Q7>Q8>Q1>Q10>Q9,抗叶斑病最好的Q9品种,病情指数仅为2.8,抗叶斑病最差的品种是Q2,病情指数为31.5,抗叶斑病优于CK的品种有9个,分别是Q9、Q10、Q1、Q8、Q7、Q4、Q3、Q5、Q6。
2.5藜麦性状相关性分析
藜麦的产量和品质性状与其他性状之间均存在一定的相关性。如表6所示,藜麦产量与其他农艺性状的相关程度依次为主枝穗长度>侧枝穗长度>株高=主枝穗直径>侧枝穗直径>分枝数>有效分枝率。
其他农艺性状之间也存在一定的相关性。如株高和有效分枝率呈极显著负相关,而与主枝穗长度呈极显著正相关,和侧枝穗直径呈显著负相关;有效分枝率和侧枝穗直径呈显著正相关;侧枝穗长度分别和主枝穗直径、千粒重呈极显著正相关和显著负相关;产量与粗蛋白含量呈极显著负相关;千粒重与粗脂肪呈极显著负相关。
PH:株高Plant height;NB:分枝数Number of branches;ENB:有效分枝率Effective number of branches;LBE:主枝穗长度Length of bough ear;LLE:侧枝穗长度Length of lateral ear;DMBE:主枝穗直径Diameter of main branch ear;DLE:侧枝穗直径Diameter of lateral ear;Y:产量Yield;W:千粒重1000-kernel weight;CP:粗蛋白Crude protein;CF:粗脂肪Crude fat. *,**分别表示0.05和0.01水平上显著相关。 *, ** correlation is significant at the 0.05 and 0.01 levels respectively.
2.6不同藜麦品种聚类分析
为了解析试验引选的藜麦品种的亲缘关系,对13个藜麦品种间11个性状的不同表现,以欧氏距离为遗传距离,聚类分析采用离差平方和法,在遗传距离11.55处将供试的13个藜麦品种聚为3大类群(图5),第一类群包含Q1、Q11、CK、Q12、Q4、Q9、Q3、Q10、Q5、Q6这10个品种,属于中秆中晚熟品种,其株高及籽粒千粒重介于第二类群和第三类群之间;Q2品种为第二类群,属于高秆晚熟品种,该类群品质性状比较突出,主要特性表现为籽粒千粒重大、高蛋白、低脂等特性;第三类群包含Q7、Q8两个品种,属于低秆早熟品种,该类群生育期115~116 d,主要表现为低秆、早熟、千粒重小等特性。
3讨论
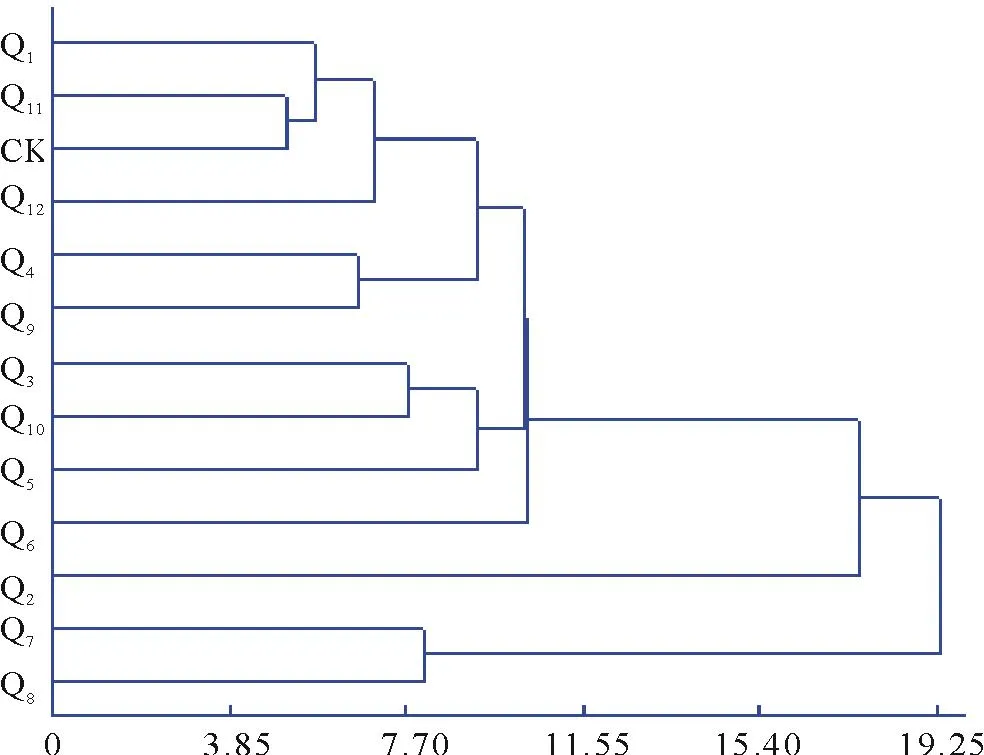
图5 13个藜麦品种11个农艺性状聚类分析Fig.5 Cluster analysis of 11 agronomic traits of different quinoa varieties
种质资源是培育新品种的原始材料,一个新品种的育成,离不开优异种质资源的利用[34]。藜麦作为一个新物种,从国外引进时间较短,虽在内地有一定量的种植,但是种质资源混杂,且未对栽培种进行系统的种质资源研究。本研究对从外省引进的13个藜麦品种进行适应性评价,以期为下一步的品种选育提供原始材料,并对以后品种的推广提供科学依据。外省引进的藜麦品种,由于其所处的地理环境、气候条件和土壤类型不同,因此在形态特征、生产性能和品质方面有差异。本研究结果发现,13个藜麦供试品种在甘肃临夏永靖旱作区均可以成熟,完成其生育过程,但不同的品种在相同的生态因子和栽培条件下,其出苗率和物候期不同,Q7和Q8的出苗率低于其他品种,CK的生育期最长(134 d),而Q8的生育期最短(115 d)。
种质资源的遗传多样性是育种工作的基础[35]。作物农艺性状主要是指其生长发育习性、产量性状以及植物学特征等方面的主要性状,其具有表现直观、便于识别、易于掌握以及与生产直接相关等特点,对于种质资源的合理利用和开发具有重要意义[36]。尽管同工酶标记和DNA分子标记已被广泛应用于植物种质资源的鉴定和分类研究,但是农艺性状的鉴定和描述仍是种质资源研究最基本的方法和途径[37]。李成祖[38]研究发现2个藜麦品种能很好地适应青海格尔木市的环境条件,千粒重达到3.74~3.94 g,平均产量达到3616.5~5577.0 kg/hm2。山西吕梁山北段高寒地区种植的藜麦品种其产量可达到2400.0 kg/hm2[28]。贡布扎西和旺姆[39]研究报道藜麦在西藏地区表现出很好的适应性,产量可达到5250 kg/hm2。本研究对13个藜麦品种的植物学特征、产量及品质性状进行对比分析,结果发现不同的品种其农艺性状差异显著,具有丰富的形态多样性。综合各性状分析结果来看,藜麦品种Q9具有生育期适中(124 d)、植株高大(178.7 cm)、有效分枝率高(60.2%)、主穗长(56.6 cm)、产量高(4254 kg/hm2)、品质好(粗蛋白含量为16.05%,粗纤维含量为6.99%)、抗倒伏以及抗病性好的突出优良特性,具有很大的开发利用价值。
有机藜麦是目前藜麦生产的一个热点,然而抗病性是有机生产的先决条件,本研究发现不同藜麦品种抗病性差异显著,特别是藜麦霜霉病,该病对外界环境比较敏感,一般随着温度和湿度增高而加重,该试验未进行栽培密度和施肥水平对藜麦霜霉病的影响分析,几者之间是否存在相依关系,还待下一步研究论证。
性状间的相关性研究有助于了解性状间的相互制约和协调关系,寻求与目标性状密切相关的指标性状,正确制定筛选方案[40]。本研究中13个藜麦供试品种,其产量性状和品质性状呈负相关,藜麦表型性状之间有一定的相关性,然而表型性状与产量性状、品质性状无显著相关性。藜麦产量性状与藜麦分枝数、有效分枝率及侧枝穗直径存在负相关,这说明藜麦的产量主要积累于主枝穗的大小,故藜麦主枝穗的大小是选育高产藜麦品种的重要指标。
种质资源是控制物种性状的基因载体,是品种选育的物质基础[41],对种质资源的鉴定评价备受关注。20世纪70年代初,Anderberg[42]就将聚类分析应用于育种研究。近年来,聚类分析法已大量应用于育种工作和种质资源的研究[43-45]。聚类分析法直观,结论形式简明[34]。本研究通过对13个藜麦品种资源的主要性状进行聚类分析,将其分为3大类群,每个类群的品种其农艺性状及品质性状等均具有不同特点,应根据藜麦开发的不同用途及市场需求选育不同的品种,如高产、抗倒伏、抗病的藜麦品种Q9,虽属高产品种,但千粒重过小,影响其商品性,为了高效开发,提高附加值,可以作为加工的优势品种,进行藜麦粉或是营养元素提取等优势资源开发;另外,聚类分析表明不同性状的多样性指数在3.85~7.70之间,一般认为遗传多样性指数越高,表明该性状遗传多样性越丰富,而丰富的多样性为育种和遗传改良奠定了基础[43,46];第三,通过聚类分析发现,个别区域的品种聚于同一类群,且品种特性非常相似,由于藜麦具有一定程度的异交率[47],且该研究的供试品种来自于国内不同地区,但均是先后从原产地引入,是否属于同一品种的分离种或杂交种,还需追根溯源,进行遗传谱系判别。
4结论
甘肃临夏旱作区引选的13个藜麦品种均可以正常成熟,综合评价藜麦的品种特性及商品性,可以根据不同用途来选择品种,Q7、Q8品种为矮化早熟品种,可以在无霜期短于试验区的地区进行种植,Q8、Q9为抗倒伏品种,适合在坡地或是易倒伏区域种植;Q1、Q2品种的品质性状比较突出,适合作为高品质原粮开发;Q9品种在试验区域内表现出良好的丰产性、抗倒伏性和抗病性,适合作为高产原粮或是深精加工产品开发;综合产量性状、品质性状和抗性评价,Q9品种具有突出的经济性状,具有在甘肃临夏旱作区大面积推广种植的潜力。
References:
[1]Oshodi A A, Ogungbenle H N, Oladimeji M O. Chemical composition, nutritionally valuable minerals and functional properties of benniseed (Sesamumradiatum), pearl millet (Pennisetumtyphoides) and quinoa (Chenopodiumquinoa) flours. International Journal of Food Sciences and Nutrition, 1999, 50(5): 325-331.
[2]Abugoch L E, Romero N, Tapia C A,etal. Study of some physicochemical and functional properties of quinoa (ChenopodiumquinoaWilld) protein isolates. Journal of Agricultural and Food Chemistry, 2008, 56(12): 4745-4750.
[3]Chen Y Q, Gao A L, Gong B Z X. Studies on quinoa seed proteins. Acta Agriculture Boreali-occidentalis Sinica, 1996, 5(3): 43-48.
[4]Abugoch L. Quinoa (ChenopodiumquinoaWilld): composition, chemistry, nutritional, and functional properties. Advances in Food and Nutrition Research, 2009, 58(1): 1-31.
[5]Meneguetti Q A, Brenzan M A, Batista M R,etal. Biological effects of hydrolyzed quinoa extract from seeds ofChenopodiumquinoaWilld. Journal of Medical Food, 2011, 14(6): 653-657.
[6]Schumacher A B, Brandelli A, Macedo F C,etal. Chemical and sensory evaluation of dark chocolate with addition of quinoa (ChenopodiumquinoaWilld). Food Science and Technology Research, 2010, 47(2): 202-206.
[8]White P, Alvistur E, Diaz C,etal. Nutrient content and protein quality and cafiihua, edible seed products of the Andes mountains. Journal of Agricultural and Food Chemistry, 1995, 3(6): 351-355.
[9]Zhang C X, Gong B Z X, Wang M. Study on frost of quinoa seedling stage. Pratacultural Science, 1994, 11(6): 7-11.
[10]Zhang C X, Zhang X W. Effect of different low temperature intensities onChenopodiumquinoafrost grands in seedling stage. Pratacultural Science, 1997, 14(1): 10-11.
[11]Gong B Z X, Wang M, Zhang C X,etal. Preliminary study of biological characters of quinoa in Tibet. Acta Agriculture Boreali-occidentalis Sinica, 1994, 3(4): 81-86.
[12]Qian J Y, Zhao P C. Characterization of amaranth and quinoa starch. Cereal and Feed Industry, 2000, 3: 43-45.
[13]Wang M, Gong B Z X, Liu Y L,etal. Preliminary research onChenopodiumquinoadisease in Tibet. Journal of Yunnan Agricultural University, 1995, 10(2): 88-91.
[14]Wang C J, Zhao X W, Lu G Q,etal. A review of characteristics and utilization ofChenopodiumquinoa. Journal of Zhejiang Agricultural and Forest University, 2014, 31(2): 296-301.
[15]Wang L M, Ma N, Li S,etal. Nutritional properties of quinoa and its application prospects. Science and Technology of Food Industry, 2014, 35(1): 381-389.
[16]Gonza′lez J A, Bruno M, Valoy M,etal. Genotypic variation of gas exchange parameters and leaf stable carbon and nitrogen isotopes in ten quinoa cultivars grown under drought. Journal of Agronomy and Crop Science, 2012, 197: 81-93.
[17]Maughan P J, Bonifacio A, Jellen E,etal. A genetic linkage map of quinoa (Chenopodiumquinoa) based on AFLP, RAPD and SSR Markers. Theoretical and Application Genetics, 2004, 109: 1188-1189.
[18]Mart′nez E A, Veas E, Jorquera C,etal. Re-introduction of quinoa into arid Chile: cultivation of two lowland races under extremely low irrigation. Journal of Agronomy and Crop Science, 2009, 195: 1-10.
[19]Urcelay C, Acho J, Joffre R,etal. Fungal root symbionts and their relationship with fine root proportion in native plants from the Bolivian Andean highlands above 3,700 m elevation. Mycorrhiza, 2011, 21(5): 323-330.
[20]Adolf V I, Shabala S, Andersen M N,etal. Varietal differences of quinoa’s tolerance to saline conditions. Plant Soil, 2012, 357(1-2): 117-129.
[21]Bois J, Winkel T, Lhomme J,etal. Response of some Andean cultivars of quinoa (ChenopodiumquinoaWilld) to temperature: effects on germination, phenology, growth and freezing. European Journal of Agronomy, 2006, 25: 299-308.
[22]Jacobsen S E, Monteros C, Corcuera L,etal. Frost resistance mechanisms in quinoa (ChenopodiumquinoaWilld). European Journal of Agronomy, 2007, 26: 471-475.
[23]Christiansen J L, Jacobsen S E, Jørgensen S T. Photoperiodic effect on flowering and seed development in quinoa (ChenopodiumquinoaWilld). Acta Agriculturae Scandinavica Section A, 2010, 60(6): 539-544.
[24]Huang J, Li M Q, Pan F M,etal. Effects of different sowing dates on agronomic traits and quality of quinoa. Journal of Irrigation and Drainage, 2015, 34(1): 259-261.
[25]Huang J, Yang F R. Quinoa in the current research situation and prospect of Gansu. Gansu Agricultural Science and Technology, 2015, (1): 49-52.
[26]Chen M S, Liu Z Y, Li Y C. Planting and cultivation techniques of quinoa. Henan Agriculture, 2013, 21(11): 43.
[27]Zhou H T, Liu H, Yao Y,etal. Evaluation of agronomic and quality characters of quinoa cultivated in Zhangjiakou. Journal of Plant Genetic Resources, 2014, 15(1): 222-227.
[28]Ma W B. Quinoa cultivation technology with high yield of Luliang mountains. China Agricultural Information, 2015, 4: 76-77.
[29]Lu M J, Mo X F, Wang Q,etal. Comparison of extraction methods of quinoa genome DNA. Jiangsu Agricultural Sciences, 2014, (4): 42-45.
[30]Bertero H D. Response of developmental processes to temperature and photoperiod in quinoa (ChenopodiumquinoaWilld). Food Reviews International, 2013, 19(1-2): 87-97.
[31]Bendevis M A, Sun Y, Shabala S,etal. Differentiation of photoperiod induced ABA and soluble sugar responses of two quinoa (ChenopodiumquinoaWilld) cultivars. Journal of Plant Growth Regulation, 2014, 33(3): 562-570.
[32]Chen Z H, Shi M, Wang Q X,etal. Determination of protein content in food by using the method of the determination of the nitrogen. Xinjiang Animal Husbandry, 2008, (5): 22-24.
[33]NY/T4-1982, Crude Fat Content of Cereals and Oil Crops[S].
[34]Meng L J, Zhao G Q. Evaluation of the adaptability of imported red clover germplasm in central Gansu. Acta Prataculturae Sinica, 2015, 24(9): 30-42.
[35]Su Z C, Wang Z Q, Li Z G,etal. Cluster analysis of agronomic traits ofParispolyphyllavar.yunnanensisgermplasm resources. Acta Agriculturae Jiangxi, 2015, 27(3): 33-35.
[36]Yang M Q, Liu D H, Shao A J,etal. Diversity and cluster analysis on agronomic traits ofArtemisiaannuagermplasm resources in Yun-Gui plateau. China Journal of Chinese Materia Medics, 2010, 35(23): 3097-3102.
[37]Li R, Xiao B, Song H X,etal. Agronomic traits and cluster analysis of 50 tea germplasm resources. Acta Agriculturae Boreali-occidentalis Sinica, 2011, 20(10): 107-111.
[38]Li C Z. Studies on introduction and cultivation of quinoa in Geermu City. Bulletin of Agricultural Science and Technology, 2015, 6: 94-96.
[39]Gong B Z X, Wang M. Biological characteristics and cultivation technology of quinoa. Tibet’s Science and Technology, 1995, 4: 19-22.
[40]Zhao J, Wu C W, Zhao P F,etal. Principal component analysis and cluster analysis of agronomic and quality traits of exotic sugarcane germplasm. Journal of Hunan Agricultural University (Natural Sciences), 2012, 38(5): 476-481.
[41]Lan Y F, Wang Q W, Tang L N,etal. Cluster analysis based on agronomic traits ofPleurotusostreatusstraits. Acta Edulis Fingi, 2014, 21(4): 10-14.
[42]Anderberg M R. Cluster Analysis for Application[R]. No. OASTR-73-9. Office of the Assistant for Study Support Kirland Afbnmex, 1973.
[43]Yang T T, Yu Z Q, Xia L H,etal. Cluster analysis based on morphological traits of dateplum (Diospyroslotus) germplasm resources. Journal of Fruit Science, 2014, 31(4): 566-573.
[44]Dong Y C, Hao C Y, Wang L F,etal. Evaluation of agronomic traits of 358 wheat varieties introduced from Europe. Journal of Plant Genetic Resources, 2006, 7(2): 129-135.
[45]Wang J, Man S L, Gan W Y,etal. Cluster analysis of ginseng tissue cultures, dynamic change of growth, total saponins, specific oxygen uptake rate in bioreactor and immuno-regulative effect of ginseng adventitious root. Industrial Crops and Products, 2013, 41(4): 57-63.
[46]Zhang X M, Yao Q, Gong Z Y,etal. Development of EST-SSR markers inPleurotusostreatusand contribution of primary core collection. Mycosystema, 2013, 32(1): 64-80.
[47]Bhargava A, Shukla S, Ohri D. Gynomonoecy inChenopodiumquinoa(Chenopodiaceae): variation in inflorescence and floral types in some accessions. Biologia, 2007, 62(2): 19-23.
参考文献:
[3]陈毓荃, 高爱丽, 贡布扎西. 南美藜种子蛋白质研究. 西北农业学报, 1996, 5(3): 43-48.
[9]张崇玺, 贡布扎西, 旺姆. 南美藜苗期霜冻试验研究报告. 草业科学, 1994, 11(6): 7-11.
[10]张崇玺, 张小武. 不同低温强度与次数对南美藜墨引1号苗期霜冻级别的影响. 草业科学, 1997, 14(1): 10-11.
[11]贡布扎西, 旺姆, 张崇玺, 等. 南美藜在西藏的生物学特性研究. 西北农业学报, 1994, 3(4): 81-86.
[12]钱建亚, 赵培城. 苋菜籽和昆诺阿黎籽淀粉的性质. 粮食与饲料工业, 2000, 3: 43-45.
[13]旺姆, 贡布扎西, 刘云龙, 等. 西藏南美藜病害初步研究. 云南农业大学学报, 1995, 10(2): 88-91.
[14]王晨静, 赵习武, 陆国权, 等. 藜麦特性及开发利用研究进展. 浙江农林大学学报, 2014, 31(2): 296-301.
[15]王黎明, 马宁, 李颂, 等. 藜麦的营养价值及其应用前景. 食品工业科技, 2014, 35(1): 381-389.
[24]黄杰, 李敏权, 潘发明, 等. 不同播期对藜麦农艺性状及品质的影响. 灌溉排水学报, 2015, 34: 259-261.
[25]黄杰, 杨发荣. 藜麦在甘肃的研发现状及前景. 甘肃农业科技, 2015, 1: 49-52.
[26]成明锁, 刘增玉, 李玉春. 藜麦的种植与栽培技术. 河南农业, 2013, 21(11): 43.
[27]周海涛, 刘浩, 么杨, 等. 藜麦在张家口地区试种的表现与评价. 植物遗传资源学报, 2014, 15(1): 222-227.
[28]马文彪. 吕梁山北段高寒山区藜麦高产栽培技术. 中国农业信息, 2015, 4: 76-77.
[29]陆敏佳, 莫秀芳, 王勤, 等. 藜麦基因组DNA提取方法的比较. 江苏农业科学, 2014, 4: 42-45.
[32]陈智慧, 史梅, 王秋香, 等. 用凯氏定氮法测定食品中的蛋白质含量. 新疆畜牧业, 2008, (5): 22-24.
[33]NY/T4-1982, 谷类、油料作物种子粗脂肪测定方法[S].
[34]孟丽娟, 赵桂琴. 国外引进红三叶种质在甘肃中部地区的生长特性及生产性能初步评价. 草业学报, 2015, 24(9): 30-42.
[35]苏泽春, 王泽清, 李兆光, 等. 云南滇重楼种质资源农艺性状的聚类分析. 江西农业学报, 2015, 27(3): 33-35.
[36]杨美权, 刘大会, 邵爱娟, 等. 云南高原黄花蒿种质资源农艺性状的多样性和聚类分析. 中国中药杂志, 2010, 35(23): 3097-3102.
[37]李瑞, 肖斌, 宋红霞, 等. 50份茶树种质资源农艺性状及其聚类分析. 西北农业学报, 2011, 20(10): 107-111.
[38]李成祖. 格尔木市藜麦引种栽培技术试验研究. 农业科技通讯, 2015, 6: 94-96.
[39]贡布扎西, 旺姆. 南美藜生物学特性及其栽培技术. 西藏科技, 1995, 4: 19-22.
[40]赵俊, 吴才文, 赵培方, 等. 引进甘蔗种质工艺与农艺性状的相关性及聚类分析. 湖南农业大学学报(自然科学版), 2012, 38(5): 476-481.
[41]兰玉菲, 王庆武, 唐丽娜, 等. 糙皮侧耳种质主要农艺性状的遗传多样性及聚类分析. 食用菌学报, 2014, 21(4): 10-14.
[43]杨婷婷, 于泽群, 夏乐晗, 等. 君迁子(Diospyroslotus)种质资源形态学性状的聚类分析. 果树学报, 2014, 31(4): 566-573.
[44]董玉琛, 郝晨阳, 王兰芬, 等. 358个欧洲小麦品种的农艺性状鉴定与评价. 植物遗传资源学报, 2006, 7(2): 129-135.
[46]张雪梅, 姚强, 宫志远, 等. 粗皮侧耳栽培种EST-SSR分子标记的开发应用及初级核心种质库的构建. 菌物学报, 2013, 32(1): 64-80.
Preliminary evaluation of adaptability of 13 Quinoa varieties in the Linxia Arid region of Gansu Province, China
HUANG Jie1, YANG Fa-Rong1*, LI Min-Quan2, WEI Yu-Ming1, GU Xian1, QI Yong-Hong3
1.PastureandGreenAgriculturalInstituteofGansuAcademyofAgriculturalSciencesAnimalHusbandry,Lanzhou730070,China; 2.GansuAcademyofAgriculturalSciences,Lanzhou730070,China; 3.InstituteofPlantProtectionofGansuAcademyofAgriculturalSciences,Lanzhou730070,China
Abstract:In order to study adaptive performance of quinoa varieties in the Linxia arid region of Gansu province, we tested 13 different quinoa varieties (designated CK, Q1 to Q(12)), to determine seedling emergence rate, phenology, botanical characters, yield, quality and disease resistance. Cluster analysis was applied to evaluate the relationships among selected traits. It was found that all 13 quinoa varieties are able to reach maturity in the test region. There were significant differences among varieties for plant height, branching index, effective branching rate, inflorescence spike length, inflorescence spike diameter, thousand kernel weight, and crude protein and crude fiber content. In addition, cluster analysis revealed Q7 and Q8 are dwarf early varieties, while varieties Q1, Q7, Q8, Q9, Q(10) show disease resistance. Q9 is high yielding (4247 kg/ha, 1252 kg/ha higher than control). There were no phenology characters of obvious relevance to variety choice. Considering all factors measured, Q9 had the best all round performance and could potentially be planted more widely as a crop in the Linxia arid region of Gansu province.
Key words:quinoa; agronomic traits; qualities; resistance
*通信作者
Corresponding author. E-mail: lzyfr08@163.com
作者简介:黄杰(1981-),男,甘肃天水人,助理研究员,硕士。E-mail: huangjie_0808@126.com
基金项目:甘肃省农业科学院中青年基金项目,甘肃省农业科技创新项目,兰州市科技计划项目和甘肃省农业科学院科技创新专项资助。
收稿日期:2015-09-08;改回日期:2015-11-02
DOI:10.11686/cyxb2015423
http://cyxb.lzu.edu.cn
黄杰,杨发荣,李敏权,魏玉明,顾娴,漆永红. 13个藜麦材料在甘肃临夏旱作区适应性的初步评价. 草业学报, 2016, 25(3): 191-201.
HUANG Jie, YANG Fa-Rong, LI Min-Quan, WEI Yu-Ming, GU Xian, QI Yong-Hong. Preliminary evaluation of adaptability of 13 Quinoa varieties in the Linxia Arid region of Gansu Province, China. Acta Prataculturae Sinica, 2016, 25(3): 191-201.
