Ⅱ型弓形虫和血吸虫重叠感染对小鼠肝纤维化作用的实验研究
2016-04-27郭玉娟谢园园储德勇徐元宏沈继龙
郭玉娟,谢园园,储德勇,徐元宏,沈继龙,
Ⅱ型弓形虫和血吸虫重叠感染对小鼠肝纤维化作用的实验研究
郭玉娟1,2,谢园园1,储德勇1,徐元宏3,沈继龙1,3
目的观察Ⅱ型弓形虫和日本血吸虫重叠感染对小鼠肝纤维化的影响,探讨弓形虫感染诱导的抗感染免疫对血吸虫感染致小鼠肝脏纤维化的免疫调节作用。方法BALB/c小鼠建立重叠感染模型:预先感染血吸虫(模型Ⅰ组);预先感染 PRU株弓形虫(模型Ⅱ组);对照:只感染尾蚴组和正常对照组。取上述小鼠血液及肝脏,HE和 Masson胶原纤维染色法观察肝脏虫卵肉芽肿大小和肝纤维化面积;检测纤维化指标透明质酸(HA)和肝脏羟脯氨酸(HYP)含量。结果模型Ⅰ组小鼠肝脏病理及纤维化指标检测与相应对照组未见显著差异;模型Ⅱ组动物血清 HA和肝脏 HYP显著低于相应对照组(P<0.001),肝脏虫卵肉芽肿大小和纤维化面积均显著减小(P<0.001)。结论预先感染Ⅱ型弓形虫可能诱导机体的 Th1型应答的偏移,在此微环境下可负向调控血吸虫肝脏纤维化状态的 Th2应答,从而延缓和减弱肝纤维化的发生和发展。
Ⅱ型弓形虫;日本血吸虫;双重感染;肝纤维化
日本血吸虫病主要由沉积于组织的虫卵内活毛蚴分泌 的 可 溶 性 虫 卵 抗 原 (soluble egg antigens,SEAs)引起的免疫性疾病[1]。在血吸虫感染感染后4~6周,机体以 Th1免疫反应为主;在感染后 6~8周虫卵成熟后,其分泌的 SEA抗原促使 Th2免疫反应加强[1]。最终因促纤维生成和溶解因素不平衡而导致细胞外基质(extracellular matrix,ECM)大量沉积[2],从而继发肝纤维化和肝硬化。刚地弓形虫是一种专性有核细胞内寄生的机会致病性的原虫,血清学调查显示,全球约 30%的人口均有不同程度感染,欧美国家感染率更高[3]。弓形虫感染后,在机体的固有免疫后,机体以持续的 Th1免疫反应为主[4]。感染血吸虫和弓形虫可以介导宿主产生不同的免疫反应,建立重叠感染的小鼠模型,观察先感染血吸虫再感染弓形虫以及先感染弓形虫再感染血吸虫,是否可以导致宿主免疫调节状态发生改变,并观察能否最终减弱日本血吸虫病肝纤维化程度。
1 材料与方法
1.1 实验动物及钉螺SPF级 BALB/c小鼠,雌性6~8周龄,18~20 g,室温 20~22℃,标准饲料及普通自来水喂养,购自北京维通利华实验动物技术有限公司;感染日本血吸虫尾蚴的阳性钉螺,购自江苏省血吸虫病防治研究所。
1.2Ⅱ型弓形虫包囊本实验室长期在小鼠内传代保存的 typeⅡ 型 PRU株 弓 形虫。取口服感 染PRU包囊30 d以上的小鼠,麻醉后无痛处死,酒精消毒后,取出脑组织;将脑组织匀浆,涂片计数包囊备用。
1.3 试剂羟脯氨酸(hydroxyproline,HYP)试剂盒(南京建成生物工程研究所);透明质酸(hyaluronic acid,HA)ELISA试剂盒(武汉华美生物工程有限公司);Masson染色试剂盒(北京索莱宝科技有限公司);甲醛和无水乙醇(上海化学试剂公司)。
1.4 实验仪器Minispin小型离心机和台式冷冻离心机(德国 Eppendorf);电子天平(上海天平仪器厂);隔水式电热培养箱(江苏东台县电器厂);超声细胞粉碎机(宁波科声仪器厂);光学显微镜(日本Nikon公司)。
1.5 实验分组取小鼠84只,随机分成 7组,建立模型Ⅰ和模型Ⅱ重叠感染模型,并设置对照。模型Ⅰ组:预先感染血吸虫,感染血吸虫尾蚴后 16周处死,1%水合氯醛麻醉小鼠后固定,腹部剃毛。尾蚴置玻片计数(15±2)条,贴于小鼠腹部 15 min。分为Ⅰ1组(预先感染尾蚴后 42 d灌胃包囊)、Ⅰ2组(预先感染尾蚴后 56 d灌胃包囊)、Ⅰ3组(尾蚴感染组)、Ⅰ4组(正常鼠对照)。模型Ⅱ组:预先感染弓形虫,感染血吸虫尾蚴后 8周处死,小鼠预先灌胃PRU包囊10个,再感染血吸虫尾蚴(15±2)条。分为Ⅱ1组(口服包囊后35 d感染尾蚴);Ⅱ2组(仅感染尾蚴组)、Ⅱ3组(正常小鼠对照)。
1.6 HA水平测定摘取眼球法收集血液于 1.5 m l EP管,37℃ 孵育 30 min,4 000 r/min离 心 10 min,收集血清。ELISA法检测血清 HA水平,按试剂盒说明操作。
1.7 HYP含量测定称取小鼠肝脏组织 0.1 g,按HYP检测试剂盒说明书操作,测量肝组织中 HYP含量。
1.8 病理学检查
1.8.1病理组织学观察 取每只小鼠相同部位的肝脏组织,4%中性甲醛固定后石蜡包埋,3μm连续切片,贴附于经10%多聚赖氨酸防脱片剂预处理的载玻片上。常规脱蜡,HE染色,脱水、透明、封固。光学显微镜下观察肝组织病理变化及测量肉芽肿大小。同等设置条件下拍照,并利用 Image-Pro Plus软件计算肉芽肿面积,统计分析。
1.8.2胶原纤维染色分析 Masson胶原纤维染色石蜡切片常规脱蜡,Masson复合液 5 min,0.2%醋酸水溶液轻轻洗;5%磷钨酸 5~10 min,0.2%醋酸水溶液洗两次;苯胺蓝染色液 5 min,0.2%醋酸水溶液洗 2次。脱水、透明、中性树脂封固。观察胶原沉积情况并判断肝纤维化程度,同等设置条件下拍照,并利用 Image-Pro Plus软件计算每张图片纤维化面积,统计分析。
1.9 统计学处理采用 SPSS 16.0统计软件进行分析,数据用 ¯x±s表示;两两比较采用 t检验,多组之间两两比较采用方差分析。
2 结果
2.1 小鼠的存活率统计与对照组相比,模型Ⅰ的3个实验组小鼠存活率有差异。重叠感染提高了小鼠的死亡率,后期存活的动物出现竖毛、怠动、发抖、厌食和消瘦等现象明显;模型Ⅱ的2个实验组小鼠存活率无显著差异,后期存活的小鼠精神状态和饮食情况一般。各组小鼠的存活率分别为Ⅰ1组33.3%;Ⅰ2组 41.7%;Ⅰ3组 66.7%;Ⅱ1组 41.7%;Ⅱ2组 50%;正常对照组Ⅰ4组和Ⅱ3组 100%。见图1。
2.2 肝组织病理学变化模型Ⅰ的 3组实验组小鼠肝脏表面布满大量大小不一的肉芽肿结节,质地较硬,肝脏颜色呈深黑褐色,相比于正常肝脏体积缩小。镜下见大量虫卵肉芽肿。肉芽肿周围及汇管区有明显桥样结构,可见大量结节形成,出现肝硬化表现。HE染色结果显示3组小鼠之间肉芽肿大小差异无统计学意义(Levene=0.911,F=0.012),Masson染色结果显示 3组小鼠之间纤维化面积差异无统计学差异(Levene=0.206,F=0.192),见图2、3。模型Ⅱ的2组实验组小鼠肝脏表面布满大量大小不一的颗粒,质地相对于模型Ⅰ要软,肝脏颜色灰褐色,相比于正常肝脏体积增大。镜下见大量虫卵肉芽肿,肉芽肿及汇管区纤维增生明显,大量炎性细胞浸润。但镜下观察可明显发现模型Ⅱ的组Ⅱ1小鼠相比于组Ⅱ2虫卵肉芽肿减少,纤维化程度降低,见图4、5。模型Ⅱ两组小鼠 HE染色显示,Ⅱ1组相比于Ⅱ2组小鼠虫卵肉芽肿减少,差异有统计学意义(F=1.065,P<0.001);Masson染色显示Ⅱ1组相比于Ⅱ2小鼠纤维化面积减少,差异有统计学意(F =5.110,P<0.001)。
2.3 血清HA水平、肝HYP含量模型Ⅱ各组血清 HA水平、肝 HYP含量见图6。模型Ⅱ实验组小鼠Ⅱ1血清 HA水平(F=3.217,P<0.001)、肝HYP(F=0.451,P<0.001)含量均显著低于Ⅱ2。
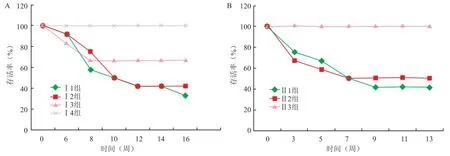
图1 各组小鼠存活率统计结果A:模型Ⅰ组;B:模型Ⅱ组
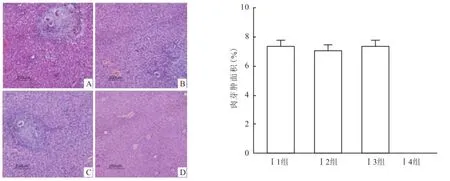
图2 模型Ⅰ组小鼠肝脏肉芽肿病理图 HE×100A:Ⅰ1组;B:Ⅰ2组;C:Ⅰ3组;D:Ⅰ4组
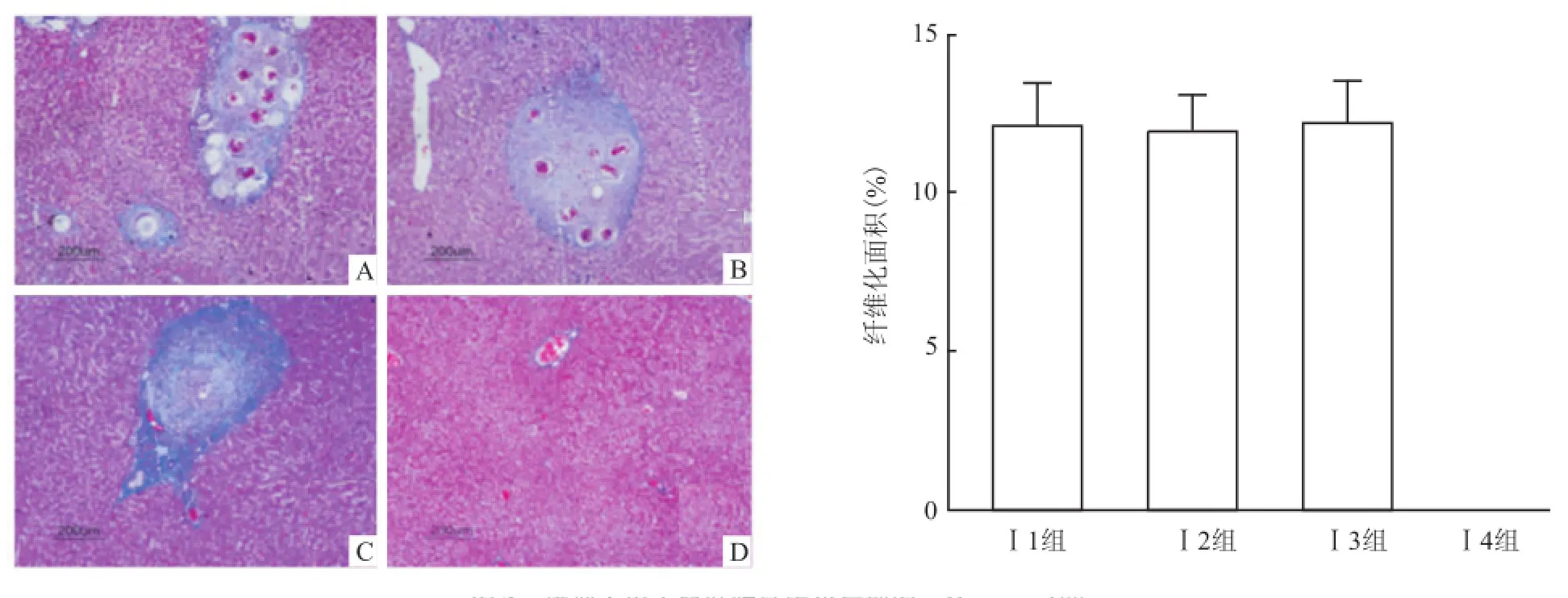
图3 模型Ⅰ组小鼠肝脏纤维化病理图 Masson×100A:Ⅰ1组;B:Ⅰ2组;C:Ⅰ3组;D:Ⅰ4组
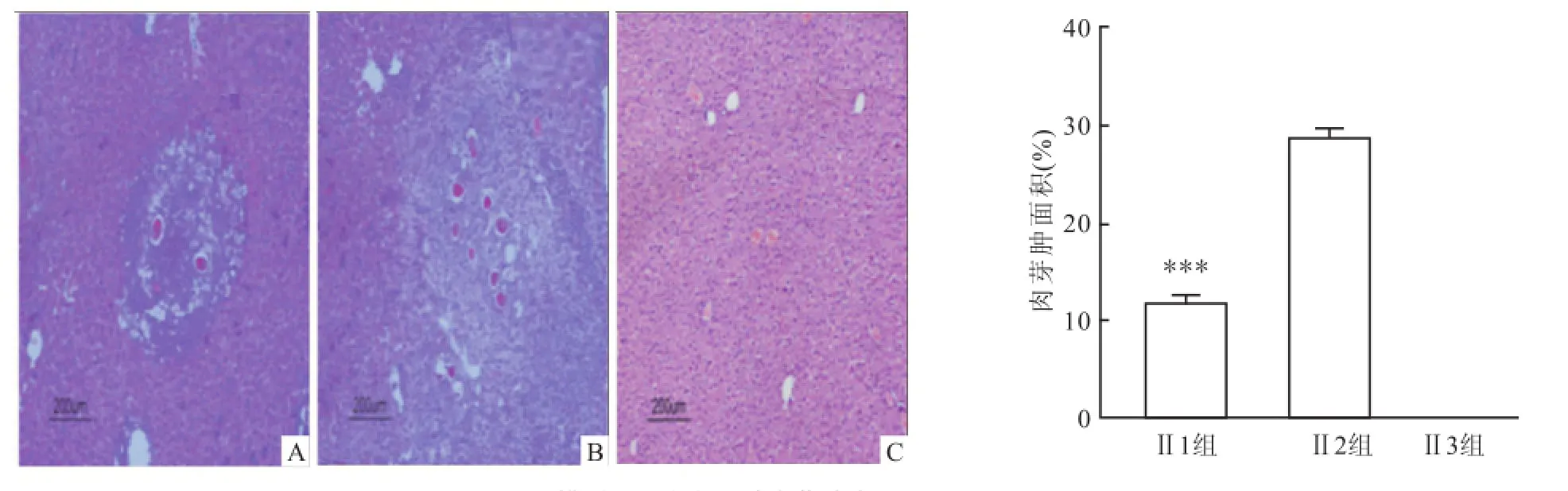
图4 模型Ⅱ组小鼠肝脏肉芽肿病理图 HE×100A:Ⅱ1组;B:Ⅱ2组;C:Ⅱ3组;与Ⅱ2组比较:***P<0.001
3 讨论
血吸虫病肝纤维化是虫卵肉芽肿所致胶原合成与降解失衡而使胶原过度沉积的结果。肝星状细胞(hepatic stellate cells,HSCs)的活化是血吸虫肝纤维化的关键事件[5]。HYP是肝脏胶原蛋白的特征性成分之一,其含量高低可以直接反映肝脏纤维化的严重程度。另外,HA在肝内由 HSCs合成并释放入血液,血中的 HA由肝细胞代谢,肝纤维化时 HSCs增多,而肝细胞代谢能力下降,因此引起外周血中HA水平上升。所以血清 HA水平也是反映肝纤维化的一项敏感指标[6]。
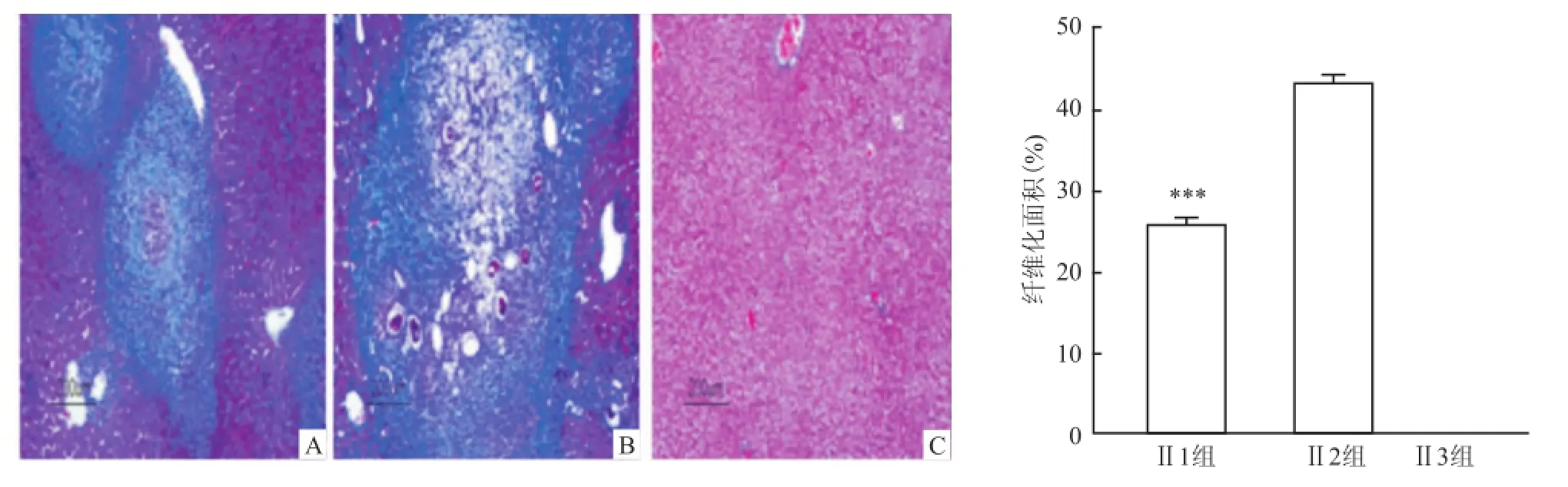
图5 模型Ⅱ小鼠肝脏纤维化病理图 Masson×100A:Ⅱ1组;B:Ⅱ2组;C:Ⅱ3组;与Ⅱ2组比较:***P<0.001
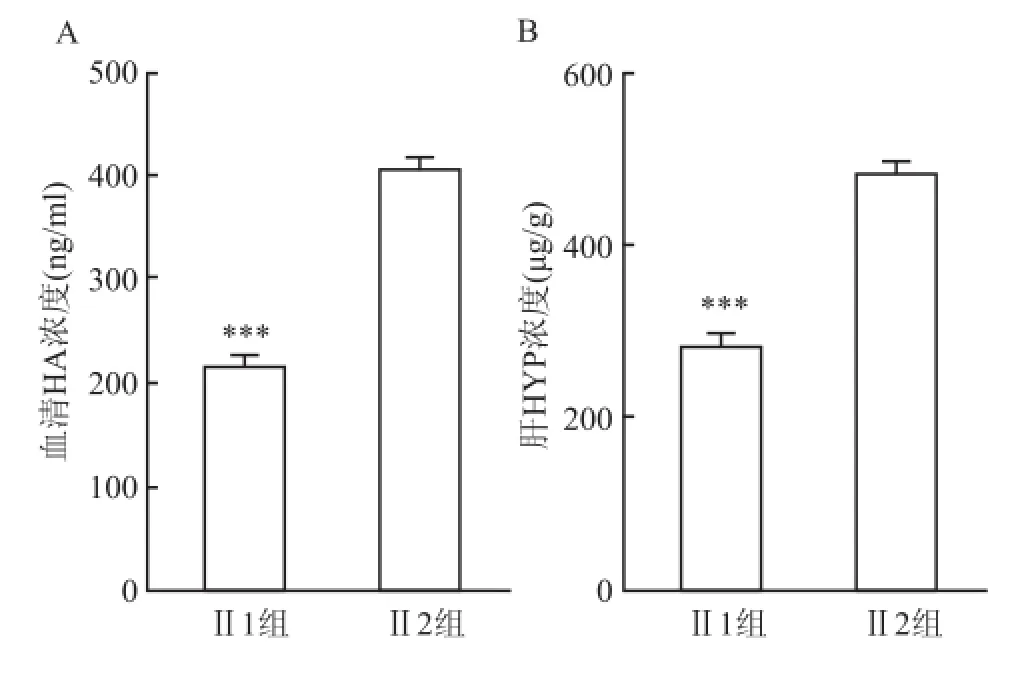
图6 模型Ⅱ小鼠肝脏纤维化指标 HA和 HYP浓度A:血清 HA;B:肝 HYP;与Ⅱ2组比较:***P<0.001
血吸虫感染早期,机体的免疫应答以 Th1型应答为主。而 Th1型细胞因子如 IFN-γ和 IL-2等可以诱导炎症反应而抑制胶原沉积[7-8]。随着病程进展,发生 Th1/Th2偏移,因而在血吸虫感染慢性期和晚期以 Th2型应答为主[9]。而 Th2优势应答则通常伴随 IL-4、IL-5、IL-13、TGF-β1等细胞因子的高表达。IL-4和 IL-13是有效 促胶原 形成的 细胞因子[9],后者还可通过 TGF-β1依赖和非依赖方式,活化 HSCs,促进胶原产生以及纤维化的形成。因此,以虫卵肉芽肿作为始动因子的 Th2应答及其细胞因子参与的胶原合成以及 ECM的形成,是肝脏纤维化的主要病理过程。
弓形虫是一种有核细胞内专性寄生的原虫。虽然弓形虫属内只有刚地弓形虫一个物种,但是近年来对世界各地人畜分离株的种群结构分析发现,弓形虫具有丰富的遗传多样性,欧洲和北美流行的弓形虫以Ⅰ型、Ⅱ型和Ⅲ型为主[10]。对不同基因型的多态性效应分子诱导的宿主免疫应答发现,在感染早期的宿主固有免疫应答中,Ⅱ型弓形虫株(弱毒株)的 GRA15Ⅱ可诱导宿主巨噬细胞出现显著的偏移,驱动巨噬细胞向经典途径活化的巨噬细胞(M1)极化[11]。即使在弓形虫感染宿主的适应性免疫应答中,同样是以 M1/Th1优势应答为主[12]。基于血吸虫病肝脏纤维化病理进程中的 Th2应答机制,本实验以弓形虫 PRU包囊预先感染小鼠后不同时间,血吸虫尾蚴再行感染,结果表明,小鼠预先经口感染Ⅱ型弓形虫 PRU包囊 35 d后,给予血吸虫尾蚴经皮肤感染,小鼠存活率不仅没有受到影响,而且其肝脏纤维化各项检测指标均显著下降。表现为小鼠肝脏虫卵肉芽肿减少,HE染色和 Masson染色显示纤维化面积缩小;血清HA水平和肝组织 HYP含量均显著低于对照组。以上结果提示,Ⅱ型弓形虫诱导的宿主Th1型免疫应答可显著抑制小鼠血吸虫病肝脏纤维化的病理进程和严重程度。其机制可能与PRU株弓形虫感染诱导的 M1/Th1应答对肝脏纤维化发生发展起重要作用的 TGF-β的抑制作用有关。弓形虫诱导的 M1/Th1的偏移与Ⅱ型虫株的致密颗粒蛋白 15(GRA15Ⅱ)有关[13]。用 GRA15Ⅱ重组慢病毒诱导肝脏 kupffer细胞的 M1偏移进行早期肝脏纤维化的预防和治疗研究正在进行中。
本研究提示,预先感染弓形虫 PRU株建立的宿主的 Th1的微环境,可能导致机体 Th2应答减弱或迟滞,或者可增强 Th1应答中某些促纤维溶解分子的表达。例如 Wynn et al[14]发现在感染血吸虫之前给与小鼠 IL-12(M1/Th1型应答的重要细胞因子),预先建立 Th1应答免疫环境,可以显著减轻小鼠慢性期纤维化,其肝脏肉芽肿和胶原沉积明显减少。值得关注的是,小鼠感染血吸虫42 d或56 d后再给予弓形虫感染,不但未见肝脏纤维化的明显缓解,反而升高了小鼠的死亡率,其机制尚待深入研究。
参考文献
[1]Colley D G,SecorW E.Immunology of human schistosomiasis[J]. Parasite Immunol,2014,36(8):347-57.
[2]Ramachandran P,Iredale JP.Liver fibrosis:a bidirectionalmodel of fibrogenesis and resolution[J].QJM,2012,105(9):813-7.
[3]Montoya JG,Liesenfeld O.Toxoplasmosis[J].Lancet,2004,363(9425):1965-76.
[4]Dupont C D,Christian D A,Hunter C A.Immune response and immunopathology during toxoplasmosis[J].Semin Immunopathol,2012,34(6):793-813.
[5]Anthony B,Allen J T,Li Y S,et al.Hepatic stellate cells and parasite-induced liver fibrosis[J].Parasit Vectors,2010,3(1):60.
[6]Kopke-Aguiar L A,Martins JR,Passerotti CC,et al.Serum hyaluronic acid as a comprehensivemarker to assess severity of liver disease in schistosomiasis[J].Acta Trop,2002,84(92):117-26.
[7]Tao F F,Yang Y F,Wang H,et al.Th1-type epitopes-based cocktail PDDV attenuates hepatic fibrosis in C57BL/6 mice with chronic Schistosoma japonicum infection[J].Vaccine,2009,27(31):4110-7.
[8]EIRidi R,Salem R,Wagih A,et al.Influence of interleukin-2 and interferon-gamma in murine schistosomiasis[J].Cytokine,2006,33(5):281-8.
[9]Ramalingam T R,Pesce JT,Mentink-Kane M M,et al.Regulation of helminth-induced Th2 responses by thymic stromal lymphopoietin[J].J Immunol,2009,182(10):6452-9.
[10]Boothroyd JC,Grigg M E.Population biology of Toxoplasma gondii and its relevance to human infection:do different strains cause different disease?[J].Curr Opin Microbiol,2002,5(4):438-42.
[11]Yarovinsky F.Innate immunity to Toxoplasma gondii infection[J]. Nat Rev Immunol,2014,14(2):109-21.
[12]KänkováS,Holán V,Zajicova A,et al.Modulation of immunity in mice with latent toxoplasmosis-the experimental support for the immunosuppression hypothesis of Toxoplasma-induced changes in reproduction ofmice and humans[J].Parasitol Res,2010,107(6):1421-7.
[13]Rosowski E E,Lu D,Julien L,et al.Strain-specific activation of the NF-kappaB pathway by GRA15,a novel Toxoplasma gondii dense granule protein[J].JExp Med,2010,208(1):195-212.
[14]Wynn T A,Cheever AW,Jankovic D,et al.An IL-12-based vaccinationmethod for preventing fibrosis induced by schistosome infection[J].Nature,1995,376(6541):594-6.
Experimental study on the effects of Toxoplasma gondii and Schistosoma japonicum overlapping infection on the liver fibrosis in m ice
Guo Yujuan1,2,Xie Yuanyuan2,Chu Deyong1,et al
(1Dept of Parasitology and Microbiology,Anhui Medical University,Hefei 230032;2Dept of Laboratory,The People’s Hospital of Lujiang County,Hefei 231500)
Objective To explore the positive effect of overlapping infection of Toxoplasma gondii and Schistosomiasis japonica on the hepatic fibrosis ofmice.Methods BALB/c mice(specific pathogen free)were transcutaneously infected with(15±2)larvae of Schistosoma japonicum to generate amodel of chronic infection after 42~56 days of larval infection,followed by an intragastric infection of 10 cysts Toxoplasma gondii PRU strain(group I).Simultaneously,mice received 10 cysts infection of Toxoplasma gondii to establish a chronic infection with 35 days,followed by(15±2)larvae infection of Schistosoma japonicum(groupⅡ).Equal number of normal animals were taken as control.Blood and liver tissue sampleswere collected for HE and Masson staining respectively.The size of liver egg granulomas and fibrosis areasweremeasured.Additionally,hyaluronic acid(HA)and hydroxyproline(HYP)in sera were tested.Results Pre-infection of PRU strain of Toxoplasma before Schistosoma japonicum infection resulted in a remarkable amelioration of hepatic fibrosis in mice,presenting the reduced size of egg granulomas and tissue fibrosis(P<0.001).And HA and HYP levelswere significantly decreased in themice with Toxoplasma pre-infection(P<0.001).In contrast,the established chronic infection of schistosomiasis ofmice,followed by oral reinfection with 10 cysts of Toxoplasma,did not show any inhibitory effects on hepatic fibrotic procession.Conclusion Pre-establishment of Th1 immune response induced by Toxoplasmamay help the animalswhich were infected with Schistosoma japonicum to ameliorate the procession of hepatic fibrosis.
Toxoplasma gondii;Schistosoma japonicum;overlapping infection;liver fibrosis
R 382.33;R 383.2+4
A
1000-1492(2016)02-0161-05
时间:2016-1-20 10:32:26
http://www.cnki.net/kcms/detail/34.1065.R.20160120.1032.006.htm l
2015-11-17接收
国家自然科学基金(编号:81471983、81171606);安徽高校省级自然科学研究项目(编号:KJ2014A106)
1安徽医科大学病原生物学教研室,合肥 230032
2安徽省庐江县人民医院检验科,合肥 231500
3安徽医科大学第一附属医院检验科,合肥 230032
郭玉娟,女,硕士研究生;
沈继龙,男,教 授,博 士 生 导 师,责 任 作 者,E-mail:shenjilong53@126.com
