氧化还原反应有效教学策略探析
2016-04-25王毅
氧化还原反应有效教学策略探析
◇甘肃王毅
氧化还原反应是高中化学的基础,也是难点所在,学生在做题时出错概率较高.
1习题中所见问题分析
1.1概念理解出现负迁移
在初中化学的阶段,学生分别学习了“氧化反应”和“还原反应”,于是,将其负迁移到高中阶段“氧化还原反应”的学习中,有些学生认为,在氧化还原反应中,可以单独存在“氧化反应”或“还原反应”.
1.2对立概念的认识混杂一团
在氧化还原反应中,具有6组对立的概念:氧化反应、还原反应,被氧化、被还原,氧化剂、还原剂,氧化产物、还原产物,得电子、失电子,化合价升高、化合价降低.关于这6组概念的认识,有些学生在习题中很难准确判断.
1.3化合价判断不够灵活
学生对于元素化合价的认识,停留在初中所背的顺口溜阶段,对于常见元素的罕有化合价以及不常见元素的化合价,学生往往作出错误判断.
1.4电子转移分析失误
在氧化还原反应中,得失电子是本质.然而,对于得失电子的分析,学生却屡屡出错,有些学生数不清转移的电子数,有些是对电子转移的方向有所疏忽.比如,关于Fe2O3+3CO=2Fe+3CO2的电子转移情况解析,学生错误百出,如图1所示.

图1
所以,教师必须实施有效的教学策略,使学生在有限的课堂时间内对“氧化还原反应”的概念进行透彻分析,并且能够活用于习题中.
2有效教学策略的实施
2.1层层深入迅速更新已有观念
初中阶段“氧化反应”的定义是元素得到氧发生氧化反应;“还原反应”的定义是元素失去氧发生还原反应.然而,在“氧化还原反应”中,很多时候并不是氧原子的得失,所以,学生必须更新头脑中的已存概念,运用化合价的升降来判断“氧化还原反应”的发生,行之有效的方式是步步诱导,层层深入.
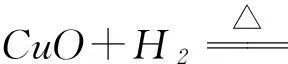
2.2运用口诀和图表法,区分对立概念
可以运用简易口诀法和图表法,使学生在一目了然中掌握6组对立概念,形成便于储存和提取的知识结构,如“升失氧”“降得还”.在此之外另加一条,发生氧化反应的为还原剂,发生还原反应的为氧化剂.
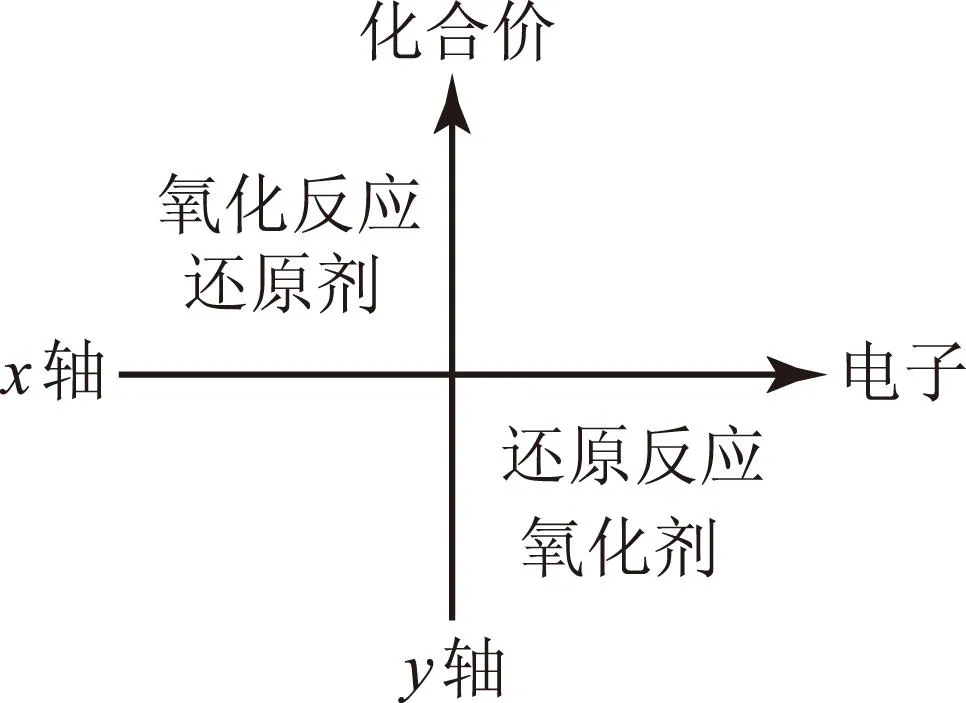
图2
口诀记忆可以与图表记忆相结合,加深学生的印象,比如利用直角坐标系中的象限.如图2,x轴表示电子得失,y轴表示化合价升降,那么第2象限是发生氧化反应的还原剂,第4象限为发生还原反应的氧化剂.
2.3归纳总结与习题训练相结合
在“氧化还原反应”中,化合价的判断是关键,通过正确辨识化合价的多少,可以分析出氧化剂与还原剂以及在反应中电子的转移数量.在教学时,教师可以采用归纳总结与习题训练相结合的方式,提高学生对化合价判断的正确率.
2.4善用变与不变准确判断电子转移
在化学式的线桥方面,不变的是线桥方向:单线桥为还原剂指向氧化剂,连接等式的同一边;双线桥上方表示氧化反应,下方表示还原反应,连接等式两边的同一种元素.变的是电子的表示,单线桥只表数目,不记正负,双线桥上为失电子,下为得电子.在化学式的电子转移方面,不变的是失电子总和与得电子总和相等以及某些元素的化合价,比如O元素在化合物中一般是-2价,变的是具有可变化合价的元素.牢记不变,合理分析变,才能准确地对电子转移作出判断.
(作者单位:甘肃省嘉峪关市第一中学)
