蒙古冰草茎尖愈伤组织及其再生植株诱导
2016-04-24陈雪英云锦凤刘湘萍
赵 彦 ,陈雪英 ,云锦凤 ,刘湘萍
(1.内蒙古农业大学生态环境学院,内蒙古呼和浩特 010018;2.内蒙古自治区草品种育繁工程技术研究中心,内蒙古呼和浩特010018;3.草地资源教育部重点实验室,内蒙古呼和浩特 010018;4.内蒙古农牧业科学院蔬菜研究所,内蒙古呼和浩特 010031)
蒙古冰草(Agropyron mongolicum Keng)为冰草属多年生丛生禾草,二倍体(2n=14),是我国干旱草原和荒漠地带重要的禾本科牧草,产于我国北部沙漠以南边缘地带的干燥草原和沙地[1]。蒙古冰草具有抗旱、抗寒、耐盐碱、耐贫瘠等优良特性,抗旱性尤其突出,根具沙套,是典型的旱生植物。蒙古冰草结实率、种子发芽率高,生命力强、适应性广,耐风沙的侵袭,是良好的固沙植物,也是荒漠草原和干旱草原地带退化草场补播的优良草种[2-3]。但是,由于生态环境变化、过度放牧等原因草原退化,该物种在种群数量上逐渐减少,是国家二级珍稀濒危植物和急需保护的农作物野生近缘种[4]。目前,已从形态学[5-7]、细胞学[8-11],分子生物学及生产利用[12-15]等不同层面对蒙古冰草进行了研究。
植物组织培养技术常用于植物育种、种质资源的保存及其交换,随着生物技术的迅速发展,逐渐成为了生物工程的基础和关键环节之一,并且广泛应用在遗传、生化、生理、病理等研究上[16]。2004年霍秀文以蒙古冰草幼穗为外植体成功建立了再生体系,但幼穗作为外植体,取材时间上受季节限制,不能随时供应,存在一定的局限性[17-18]。因此,本试验试图打破这一局限,以蒙古冰草无菌苗的不同部位为外植体进行离体培养,利用常用植物激素,探索适宜的浓度配比,建立一套有效的以茎尖为外植体的蒙古冰草组织培养再生体系,为进一步的基因转化研究奠定基础。
1 材料和方法
1.1 植物材料
蒙农1号蒙古冰草种子,2014年采收于内蒙古农业大学牧草试验站种质资源圃。
1.2 方法
1.2.1 无菌苗培养 取蒙古冰草种子100粒,清水浸泡4~6 h,剥去内外稃,流水冲洗30 min,转入无菌操作台操作,无菌水冲洗3~5遍,再用75%乙醇进行表面消毒1 min,无菌水冲洗2~3次;用0.1%HgCl溶液处理7~10 min,无菌水冲洗3~5次,接种于MS培养基,培养无菌苗,每瓶接种20粒左右(图1)。
1.2.2 外植体选择 待无菌苗长至5~8 cm时,将幼苗从茎尖到顶部分割成5段,每段3~5 mm,并按此顺序编号为茎尖、茎段、叶片,接种于愈伤组织诱导培养基上,观察并统计愈伤组织诱导率和质量,筛选愈伤诱导率高的外植体进行愈伤组织诱导。
1.3 培养基配置
以MS基本培养基为主,添加不同激素浓度的组合,其中蔗糖3%,琼脂0.7%,pH值调至5.8,在121℃条件下高压灭菌20 min。
(1)愈伤组织诱导培养基 MS+(1.0,1.5,2.0,2.5,3.0 mg/L)2,4-D+ (0,0.05,0.10,0.20 mg/L)6-BA。(2)继代培养基 MS+1.5 mg/L 2,4-D。(3)分化培养基 MS+(2.0,3.0,4.0,5.0 mg/L)6-BA+(0.3,0.5,1.0 mg/L)NAA。(4)生根培养基 MS+0.5 mg/L NAA。
1.4 培养条件
愈伤组织诱导放入25℃的恒温培养室,暗培养20 d后转入继代培养基,继代培养2~3次,每隔21 d继代培养1次。挑选生长状态好的愈伤组织转入分化培养基上进行分化培养,25℃光照培养,继代1~2次,待分化出苗后,转入生根培养基中进行生根培养。
1.5 数据统计
出愈率=愈伤组织数量/外植体数量×100%
分化率=分化成苗数量/愈伤组织数量×100%
2 结果与分析
2.1 适宜外植体的筛选
蒙古冰草幼苗的茎尖、茎段、叶片作为外植体,接种到添加1.5 mg/L 2,4-D的愈伤诱导培养基上,暗培养20 d后,统计愈伤组织的出愈率,观察愈伤状态。
统计结果表明,愈伤诱导率由高到低依次为:茎尖、茎段、叶片(表1)。茎尖的诱导率明显高于茎段,诱导率达到79.3%,愈伤组织质量较好;茎段的诱导率仅为46.0%,愈伤组织小,质量一般;叶片的愈伤诱导率仅为7.0%,且愈伤质量较差。因此,茎尖为诱导愈伤组织的最适外植体。
2.2 不同激素浓度对愈伤诱导的影响
以蒙古冰草茎尖作为外植体接种于不同激素水平的愈伤诱导培养基(表2)。2,4-D浓度设定5个梯度,分别为 1.0,1.5,2.0,2.5,3.0 mg/L;6-BA 浓度设定 4 个梯度,分别为 0,0.05,0.1,0.2 mg/L。
试验结果表明,MS+1.5 mg/L 2,4-D+0.1 mg/L6-BA培养基的诱导率最高,达到84.9%,并且愈伤状态良好,为最适诱导愈伤培养基。其中2,4-D对蒙古冰草茎尖愈伤组织的诱导起主导作用,但浓度过高会抑制愈伤组织的产生,适量添加6-BA有助于提高愈伤组织诱导率和愈伤质量。

表1 不同部位外植体的愈伤诱导结果
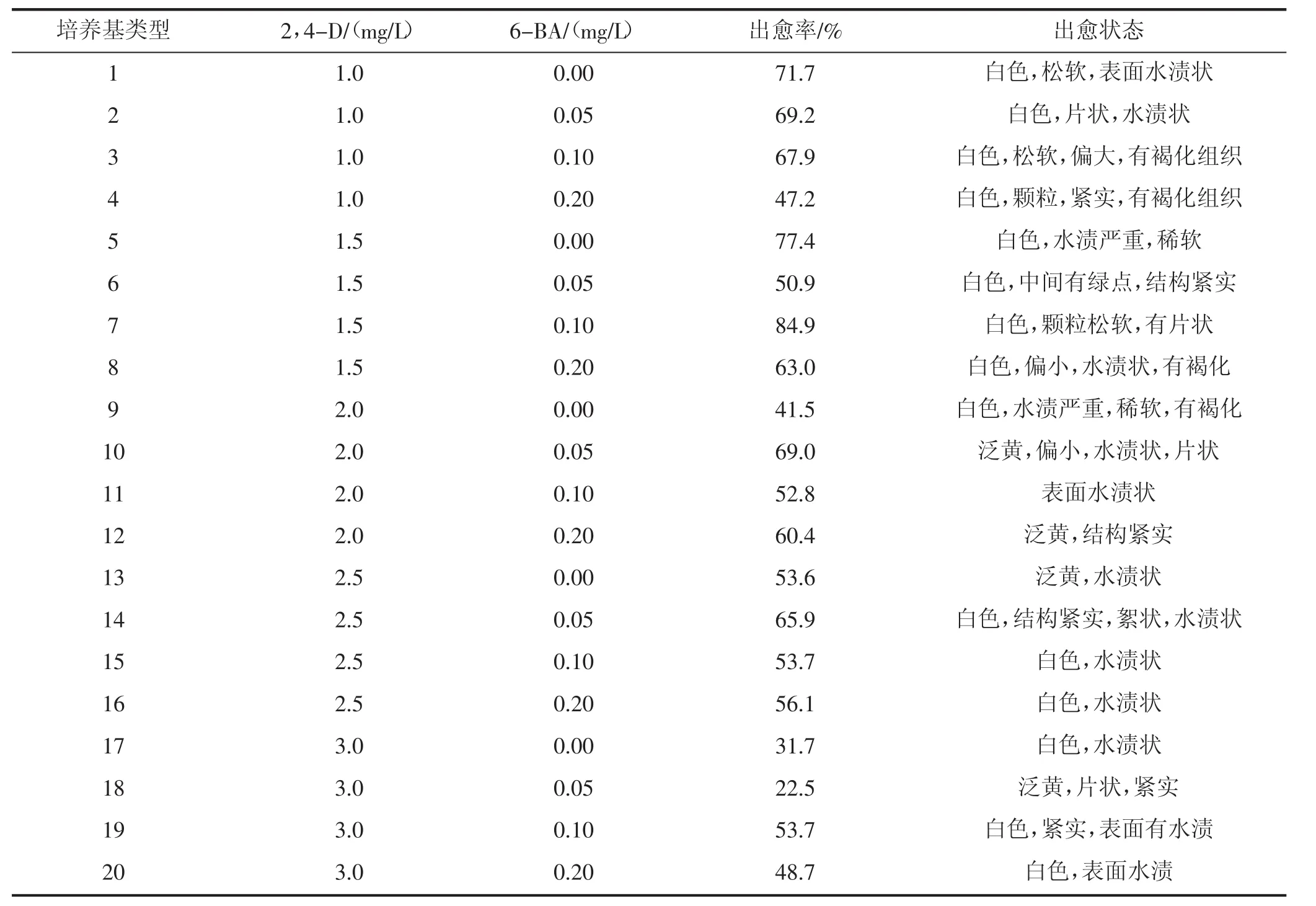
表2 不同激素浓度对蒙古冰草茎尖愈伤诱导的影响
2.3 诱导分化
继代2次后,挑选紧实、颗粒状的愈伤组织,转到分化培养基中进行分化培养。结果表明,6-BA浓度为2.0 mg/L时,分化率最高。添加适宜NAA可以提高愈伤组织的分化率,其中以6-BA 2.0 mg/L+NAA 0.5 mg/L的培养基分化率最高,到达53.2%(图2、表 3)。

表3 不同激素浓度组合条件下愈伤组织分化率
2.4 生根培养
待分化芽长到4~6 cm时,转入MS+0.5 mg/L NAA生根培养基中(图3),培养10 d左右,即可生根,生根率100%,每苗生根达到3条以上,根长5 cm左右。在生根培养基中培养20 d左右,即可移栽到花盆中。
2.5 移栽
再生植株需要室温炼苗3~7 d,用自来水冲洗掉根部所带的培养基,移栽到蛭石、沙土和营养土(1∶1∶1)中,成活率在 90%以上。
3 结论与讨论
对蒙古冰草组织培养及再生体系建立的研究较少,且外植体均为幼胚、幼穗、成熟胚等,但这些外植体或取材困难或受季节限制,尚未见到有关茎尖作为外植体获得再生植株的报道。本试验以蒙古冰草幼苗的不同部位为外植体,探讨了茎尖、茎段、叶片在生长激素2,4-D和细胞分裂素6-BA调控下的愈伤诱导率。结果表明,茎尖为最适宜的外植体,再生性好。最适宜的2,4-D浓度为1.5 mg/L,而以幼穗、幼胚为外植体的愈伤诱导培养基中,2,4-D的浓度为2.0 mg/L[19-20]。
在禾本科牧草愈伤组织诱导培养研究中,多以添加单一的生长素2,4-D作为诱导因子。也有研究表明,添加细胞分裂素,如6-BA可以很好地改善愈伤状态[20-21]。本试验也证实,当添加0.1 mg/L 6-BA时,愈伤状态明显较不添加时好,但对诱导效果没有明显作用。当2,4-D浓度为1.0 mg/L时,愈伤组织诱导率平均为64.0%,2,4-D浓度为1.5 mg/L时,愈伤组织平均诱导率为69.05%,随2,4-D浓度增加,诱导率下降,愈伤组织质量也受影响,呈较严重的水渍状。可见,2,4-D浓度不宜过高,低浓度2,4-D有利于诱导蒙古冰草茎尖愈伤组织的形成,且愈伤组织质量好。当6-BA浓度为0 mg/L时,也可诱导愈伤组织的发生,最高诱导率可达到77.4%,但愈伤组织质量差,表面多为水渍状,结构松软。当添加0.1 mg/L 6-BA时,愈伤组织多为颗粒状,紧实,愈伤状态良好。
有研究表明,2,4-D是诱导体细胞胚性发生的重要激素,细胞分裂素6-BA对禾本科植物诱导愈伤组织分化的作用优于其他分裂素[22],分化过程中应去掉2,4-D,添加生长素NAA有利于植株分化,也可促进再生苗生根[23]。本试验结果表明,当6-BA浓度为2.0 mg/L时,低浓度的NAA可提高愈伤组织的分化效率,促使再生苗健壮生长,且容易生根,幼苗生根率高,移栽成活率高。本试验也证实NAA浓度不宜过高,当NAA为1.0 mg/L时,抑制了愈伤组织的分化。
本试验通过对蒙古冰草不同部位的离体培养,筛选出了茎尖为诱导愈伤的适宜外植体。这是首次建立蒙古冰草营养体为外植体进行组织培养;并通过MS添加不同激素配比试验,建立了一套以蒙古冰草茎尖为外植体的再生体系,其中最适愈伤诱导培养基为 MS+2,4-D 1.5 mg/L+6-BA 0.1 mg/L,最适分化培养基 MS+6-BA 2.0 mg/L+NAA 0.5 mg/L;生根培养基MS+NAA 0.5 mg/L。
参考文献:
[1]郭本兆.中国植物志[M].北京:科技出版社,1987.
[2]李立会,董玉琛.冰草属研究进展[J].遗传,1993,15(1):45-48.
[3]张 众,师文贵,逯晓萍.蒙古冰草研究概况[J].草业科学,2004(7):459-465.
[4]郑殿升.中国农业生物多样性保护与可持续利用现状调研报告[M].北京:气象出版社,2000.
[5]云锦凤.冰草属分类学研究的历史回顾[J].中国草地,1989(2):3-7.
[6]云锦凤,米福贵.干旱地区一种优良禾草-蒙古冰草[J].内蒙古草业,1990(2):70-71.
[7]云锦凤,米福贵.冰草种子的萌发、生长发育及其开花生物学[J].中国草地,1989(4):16-21.
[8]王荣华.渗透胁迫对蒙古冰草幼苗保护酶系统的影响[J].植物学通报,2003,20(3):330-335.
[9]云锦凤,李瑞芬.冰草的远缘杂交及杂种分析[J].草地学报,1997,5(4):1-17.
[10]解新明,云锦凤.蒙古冰草遗传多样性的RAPD分析[J].西北植物学报,2002(1):56-62.
[11]李景欣,云锦凤,阿拉坦苏布道.冰草的遗传多样性研究[J].中国草地,2004,26(6):12-15.
[12]海 棠,云锦凤,贾鲜艳,等.干旱地区优良牧草引种种植试验的研究[J].内蒙古农业大学学报(自然科学版),2001(2):41-43.
[13]谷安琳,云锦凤,Larry Holzworth.冰草属植物在内蒙古干旱草原的种植试验[J].中国草地,1994(3):37-41.
[14]安 渊,王育清.沙地草场补播技术及其渗透效益研究[J].草地学报,1997(1):33-41.
[15]戚秋慧.内蒙古典型草原禾本科牧草生态适应综合评价[J].草地学报,1998(2):133-138.
[16]张 童.禾本科植物离体再生体系研究进展[J].中国新技术新产品,2009(1):169.
[17]霍秀文.冰草组织培养再生体系建立及耐旱转基因研究[D].呼和浩特:内蒙古农业大学,2004.
[18]张 辉.蒙农杂种冰草成熟胚愈伤组织诱导、植株再生及转基因研究[D].呼和浩特:内蒙古农业大学,2004.
[19]徐春波,米福贵,王 勇,等.影响冰草成熟胚组织培养再生体系频率的因素[J].草业学报,2009,18(1):80-85.
[20]解继红,云锦凤,杨 斌,等.2,4-D和BAP对蒙古冰草幼胚愈伤组织诱导及生长的影响[J].中国草地学报,2006,28(2):44-47.
[21]王万军,王文芳,曹建军,等.小麦叶片愈伤组织及其再生植株的诱导[J].西北植物学报,1998,18(3):401-405.
[22]唐小艳,易自力,蒋建雄,等.高羊茅愈伤组织再生体系研究进展[J].四川草原,2006(5):8-11.
[23]李小雷,于 卓,马艳红,等.加拿大披碱草×肥披碱草杂种F1幼穗组培再生体系的研究[J].安徽农业科学,2008,36(6):2235-2237.
