黑玫瑰石竹组培快繁中不同影响因子的优化
2016-04-24周四敏王树彦
周四敏,王树彦,徐 军
(1.内蒙古农业大学农学院,内蒙古呼和浩特 010018;2.内蒙古农业大学生态环境学院,内蒙古呼和浩特 010018)
黑玫瑰石竹(Dianthus Linn)是石竹科石竹属多年生草本植物,花朵繁密,黑紫色,花径4~6 cm,质如丝绒聚伞花絮,株高30~50 cm。怕炎热,耐干旱,要求排水良好的肥沃土壤,家庭院落四季可播,各地可种植,可用作盆栽、切花等,观赏价值极高。石竹科植物是重要的观赏园艺植物,全世界共75个属,约2000种,我国有30属388种,分布于全国各地。目前,一些学者对香石竹和中国石竹的研究较多,包括鲜花切花保鲜[1],基因转化[2-5]、组织培养、原生质体培养[6]等方面,而对黑玫瑰石竹的研究较少。
黑玫瑰石竹作为石竹科的一种,同香石竹[8]一样,不易用种子繁殖,易产生品种混杂,不能保持原品种的优良品质,传统生产主要采取扦插来扩大繁殖,但是长期的营养繁殖使得病毒危害严重,切花质量变劣,栽培质量下降,并且用普通的扦插繁殖难以达到快速繁殖的目的[7]。为了解决这一问题,则有必要采用组织培养的方法,建立一套完整的石竹诱导、增殖、分化等一整套快繁体系。如此不仅可以满足石竹的工厂化生产,适应日益繁盛的花卉市场,而且还对石竹新品种的选育及推广、野生植物资源的保护具有重要的意义。在石竹的离体组织培养中,激素、糖分、营养物等对其生长起着至关重要的作用,本试验通过观察不同激素浓度配比、不同碳源、不同大量元素及不同有机添加物对石竹离体组织茎段分化的影响,确定最优组合建立的快繁体系。
1 材料和方法
1.1 试验材料
试验材料为经过实验室3~4代继代培养的黑玫瑰石竹试管苗,基本培养基为MS培养基。
1.2 试验仪器与用具
高温灭菌锅、无菌操作台、培养室、电子天平、电炉、锅、烧杯、量筒、试管、移液管、容量瓶、玻璃棒、研钵、滤纸、标签纸、研钵、镊子、剪刀、酒精灯等。
1.3 试验内容与方法
1.3.1 不同NAA/6-BA和NAA/KT浓度比例对黑玫瑰石竹试管苗芽增殖的研究 以琼脂做培养基支撑物,采用MS培养基为基本培养基。将培养基中的NAA/6-BA浓度比设置为6个处理,分别为0.1 mg/L/0.5 mg/L(0.20);0.1 mg/L/1.0 mg/L(0.10);0.1 mg/L/1.5 mg/L(0.067);0.2 mg/L/0.5 mg/L(0.40);0.2 mg/L/1.0 mg/L(0.20);0.2 mg/L/1.5 mg/L(0.13)。NAA/KT的浓度设置同NAA/6-BA一样,每个处理4瓶,共12个处理,48瓶,每瓶接4个茎段,接种茎段为1节,共接种192个茎段。
1.3.2 不同碳源对黑玫瑰石竹试管苗生长的研究以琼脂做培养基支撑物,采用MS培养基为基本培养基。培养基中的碳源为蔗糖、白砂糖和麦芽糖,每一种碳源作2个处理:15 g/L和30 g/L,每个处理4瓶,共6个处理,24瓶,每瓶接4个茎段,接种茎段为1节,共接种96个茎段。
1.3.3 不同大量元素浓度对黑玫瑰石竹试管苗生长的研究 以琼脂做培养基支撑物,对大量元素作处理,采用 MS、1/2MS、1/4MS 和 2MS 的培养基,每一处理4瓶,共4个处理,16瓶,每瓶接4个茎段,接种茎段为1节,共接种64个茎段。
1.3.4 几种添加物对黑玫瑰石竹试管苗生长的研究以琼脂做培养基支撑物,采用MS培养基为基本培养基。培养基中添加水解乳蛋白(100 mg/L)、谷氨酰胺(100 mg/L)、椰汁(100 ml/L)和活性炭(2 g/L)。共4个处理,每一个处理4瓶,共16瓶,每瓶接4个茎段,接种茎段为1节,共接种64个茎段。
上述4个试验各处理接种后的培养瓶均放于培养室中培养,培养条件为:23~27℃、光照强度2000~3000 Lx、光照时间为14 h/d。接种后7 d内观察其污染情况,及时清除被污染的培养瓶,培养期间定期观察不同阶段培养苗的生长状况,在40 d后,调查记录试管苗的株高、芽增殖数、生根情况等指标。
2 结果与分析
2.1 不同NAA、6-BA和KT配比对黑玫瑰石竹试管苗芽增殖的影响
在培养基中添加植物生长素和细胞分裂素能促进芽或根的分化,经试验观察,不同的NAA/6-BA浓度比对黑玫瑰石竹的芽增殖及株高影响不同,具体影响结果见表1。
由表1可见,当NAA浓度为0.1 mg/L和0.2 mg/L时,随6-BA浓度的增大,茎长和增殖系数都有升高的趋势。当NAA为0.1 mg/L,6-BA为1.5 mg/L(D1处理)时,芽的增殖系数比其他各个处理高,芽分化数多,并且株高最高,但此时由于6-BA浓度过高,出现玻璃化现象,因此,尽管D1处理芽增殖系数显著高于D3,但不适宜黑玫瑰石竹的生长。D4处理对D6差异显著,而试管苗却矮小丛生。当NAA/6-BA比例都为0.2(D3,D5)时,增殖系数几乎相等,但后者处理的试管苗茎细弱,不易移栽成活。因此,综合增殖系数以及植株的生长情况,采用NAA/6-BA为0.1 mg/L/1.0 mg/L的比例即D2处理时,黑玫瑰石竹的芽分化最佳。

表1 不同NAA/6-BA浓度比例对黑玫瑰石竹试管苗芽增殖的影响
以上处理采用NAA和6-BA时,各植株均无生根现象出现。不同的NAA/KT浓度比对黑玫瑰石竹试管苗芽增殖的影响见表2。

表2 不同NAA/KT浓度比例对黑玫瑰石竹试管苗芽增殖的影响
由表2可见,NAA与KT组合对黑玫瑰石竹试管苗芽的增殖影响差异不显著,而对其生根有促进作用,且对生根的影响差异表现为显著,随着NAA/KT比例的增加,生根数逐渐增多。观察整个经NAA与KT处理过的试管苗,在株高、茎粗等方面均比NAA与6-BA处理过的较好,但就单方面促进芽分化效果不及6-BA处理。由此可见,若要使黑玫瑰石竹组培快繁中获得大量的试管苗,采用6-BA优于KT。
2.2 不同碳源对黑玫瑰石竹试管苗生长分化的影响
不同碳源对黑玫瑰石竹试管苗生长分化的影响见表3。
由表3可见,蔗糖为碳源比白砂糖、麦芽糖的增殖系数都高,由试验观察,经15 g/L的白砂糖处理的试管苗细弱;经麦芽糖处理的试管苗叶色浅绿,并且30 g/L麦芽糖处理的试管苗茎最下端有干枯现象,不利于黑玫瑰石竹的组织快繁。以上各处理的植株均无生根现象出现。
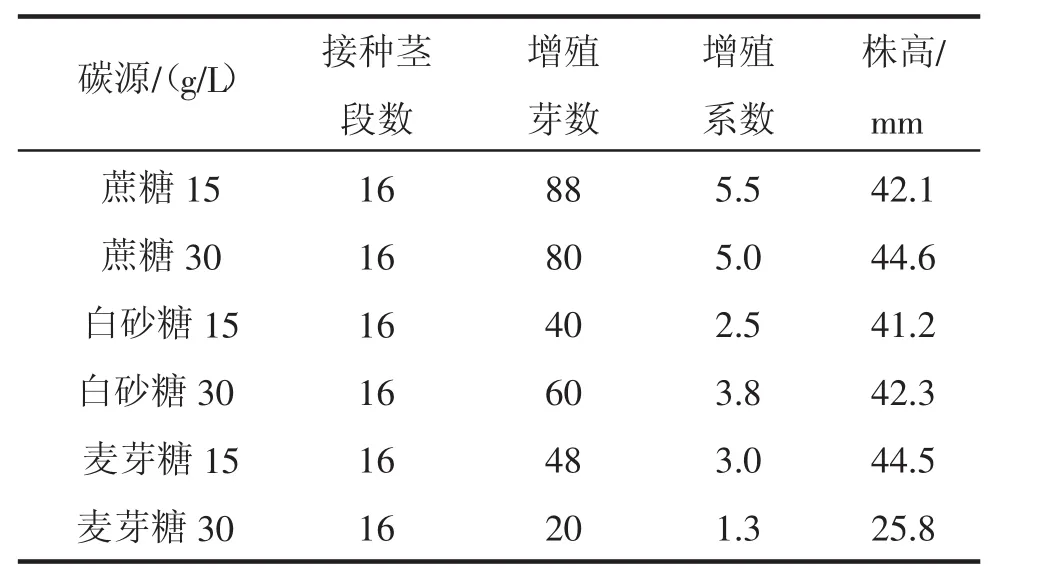
表3 不同碳源对黑玫瑰石竹试管苗生长的影响
因此,在黑玫瑰石竹组培快繁中要获得生长健壮、芽分化率较高的试管苗,并且在节省成本的前提下,宜采用15 g/L的蔗糖,也可用30 g/L的白砂糖代替,以降低成本。
2.3 大量元素浓度对黑玫瑰石竹试管苗生长分化的影响
对黑玫瑰石竹组培快繁培养基中大量元素进行减量或加倍,其影响结果见表4。

表4 不同大量元素浓度对黑玫瑰石竹试管苗生长的影响
从表4可以看出,MS培养基培养的黑玫瑰石竹试管苗增殖系数最高,并且生长状况均优于其他培养基,各处理的试管苗均无生根现象出现。因此,MS培养基为比较适宜的基本培养基。
2.4 几种添加物对黑玫瑰石竹试管苗生长分化的影响
为了研究在黑玫瑰石竹组培快繁中添加物对试管苗生长的影响,本试验添加了水解乳蛋白(LH)、谷氨酰胺(Gln)、椰汁和活性炭4种物质,其具体影响情况见表5。
从表5,可以看出4种添加物对黑玫瑰石竹试管苗的生长有促进作用,谷氨酰胺对试管苗芽增殖的影响最显著;4种添加物均都属丛生分化,对株高的影响不显著,而活性炭却显著提高其茎长。以上经各添加物处理的试管苗只在芽分化上有差异,均无生根现象出现。接种40 d后的生长势可参见图1。
3 讨论与结论
3.1 讨论
3.1.1 外源激素对黑玫瑰石竹试管苗茎芽增殖和生根的影响 本试验中,NAA存在时,培养基中加入6-BA能显著促进黑玫瑰石竹试管苗的芽增殖,加入KT后其芽增殖效果没有6-BA明显,却能显著促使试管苗生长及根的发生。
一般6-BA适宜的质量浓度范围在0.5~2.0 mg/L之间[9]。本试验采用 0.5、1.0、1.5 mg/L 的 6-BA,与NAA配合使用后发现随6-BA浓度的增加,芽的增殖系数也明显增加,但是当NAA为0.1 mg/L,6-BA为1.5 mg/L时,出现玻璃化现象,不利于幼苗的生长,这是因为6-BA浓度过高,促使细胞分裂速度过快,新的细胞没有充足的时间合成细胞内各种物质便进入下一次细胞分裂,结果细胞壁变薄,叶绿体形成少,植株则表现出失绿、半透明、液泡化的玻璃化现象,这种现象的出现叶祖云[10]等已有研究。当NAA为0.2 mg/L时,6-BA随浓度的增加其芽的增殖系数没有NAA为0.1 mg/L时显著。
在培养基中加入NAA和KT后,茎段的芽增殖系数较使用6-BA的低,刘开辉[11]等在对香石竹研究时也发现芽增殖与BA的浓度及BA和NAA的浓度比有关,但是在诱导黑玫瑰石竹根的发生方面可以配合使用NAA和KT,随着NAA/KT浓度比的升高,生根条数逐渐增多,芽增殖系数却下降,但并无显著差异。
通过本试验研究得出黑玫瑰石竹最佳增殖培养基为MS+6-BA1.0 mg/L+NAA 0.1 mg/L,这也与海石竹的增殖培养[12]有相似之处。
3.1.2 不同碳源对黑玫瑰石竹试管苗生长的影响在黑玫瑰石竹的组培快繁中,蔗糖、白砂糖、麦芽糖等多种碳水化合物均可作为碳源,我国关于不同碳源对石竹组织培养影响的研究较少,但在草莓[13-14]等其他木本植物的方面都有研究,出于节约成本考虑,均可用白砂糖代替蔗糖。在本试验中,通过对蔗糖、白砂糖、麦芽糖三者的比较,以蔗糖作为碳源时茎段芽的增殖系数高,在实验室中可用15 g/L的蔗糖;麦芽糖作碳源时增殖系数最低,并且长势不好,因此,在黑玫瑰石竹的组培快繁中,如果需工厂化生产,并节约成本,可用30g/L的白砂糖代替蔗糖。
3.1.3 大量元素浓度变化对黑玫瑰石竹试管苗生长的影响 目前在关于石竹的组培研究中,普遍认为最适合芽增殖,愈伤组织诱导,初、继代培养的培养基为MS培养基,1/2MS培养基适于生根培养[15]。在本试验中,1/2MS培养基无生根现象出现,可能是与本组试验所加激素有关,NAA与6-BA配合使用显著促进了黑玫瑰石竹芽的分化。由于其他培养基中大量元素浓度过低或过高,培养基中总盐分、渗透压过低或过高,使1/4MS和2MS的培养基培养的黑玫瑰石竹试管苗都生长不良。
3.1.4 有机添加物和活性炭对黑玫瑰石竹试管苗生长的影响 在植物的组培快繁中,影响其繁殖系数的因素很多,除激素的种类配比和浓度,碳源种类和浓度,培养基的种类外,有机物的种类和浓度对其也有一定的作用。在重瓣丝石竹[16]的组织培养中,添加多效唑显著地促进了组织培养苗生根,并且较高浓度的多效唑对茎尖外植体不定芽分化有明显的增殖作用,同时抑制了试管苗玻璃化。在其他植物的组织培养中,添加香蕉泥、土豆泥、甘氨酸、肌醇、盐酸、水解乳蛋白等[17-19]都对其组织培养的繁殖系数产生一定的影响。
通过本试验,观察到添加谷氨酰胺、水解乳蛋白和椰汁后,相对无添加物的对照而言,黑玫瑰石竹试管苗芽的增殖系数有显著的提高,且谷氨酰胺影响最为显著。谷氨酰胺作为培养基中重要的有机氮源,对植物组织培养物的生长有良好的促进效果;水解乳蛋白是多种氨基酸的混合物,对胚状体或不定芽的分化有良好的促进作用;椰乳等天然的有机物能提供一些必要的微量营养成分,生理活性物质和生长激素等[20]。添加活性炭提高了黑玫瑰石竹试管苗的茎长,沈宁东[21]等人的研究也得出类似的结论。因此,在条件许可的条件下,添加适量的添加物会对植物的离体培养产生一定的促进作用。
3.2 结论
在黑玫瑰石竹的组培快繁中,采用NAA/6-BA为0.1 mg/L/1.0 mg/L的浓度比对茎芽增殖的促进效果明显,添加KT能显著促进试管苗茎长和根的发生,若三者配合使用,可能效果更佳。
在实验室中宜用15 g/L的蔗糖,其碳源适宜黑玫瑰石竹的组培快繁,若要工厂化生产,在节约成本的前提下,可用30 g/L的白砂糖代替蔗糖。
以MS为基本培养基最适宜黑玫瑰石竹的组培快繁,此时能提供植物所必需的营养并能维持一个适当的渗透势。
初中学生心脏的容积虽有增大,但血液循环的路线随着人体的成长延长了,因而使心脏的负担加重。运动时间过长,运动量过大,都会引起头晕、乏力等现象。因此,在体育教学中,教师要注意节制学生的运动量,以免过于疲劳。为了保持学生心脏健康,对于部分较胖的学生来说,不一定要跑步锻炼,尤其是剧烈的长跑运动,长距离步行(快走)也能够使他们结实、健康。
在黑玫瑰石竹的组培快繁中,添加谷氨酰胺和水解乳蛋白都对试管苗的茎芽增殖产生促进作用,使增殖系数显著提高,椰汁能使茎变的粗壮,活性炭的添加提高了试管苗的茎长。
通过本试验可预测适合黑玫瑰石竹组培快繁的培养基是 MS+NAA(0.1 mg/L)+6-BA(1.0 mg/L)+蔗糖(15 g/L)+Gln(100 mg/L)。
参考文献:
[1]张 云,郭维明,韩 亮.N2月桂酰乙醇胺对香石竹切花瓶插效应的影响[J].园艺学报,2006,33(2):422-425.
[2]蔡友铭,张 露,张 博.利用RAPD标记对中国石竹属植物亲缘关系的研究[J].南京林业大学报,2002,26(4):31-34.
[3]余义勋,刘娟旭,包满珠.香石竹植株再生及基因工程研究进展[J].植物学通报,2006,23(1):23-28.
[4]Pennycooke J C,Cox S,Stushnoff C.Relationship of Cold acclimation,total phenolic content and antioxidant capacity with chilling tolerance in petunia(Petunia×hybrida)[J].Environmental and Experimental Botany,2005,53(2):225-232.
[6]Omid Karami,AliDeljou,Gona Kordestani.Secondary somatic embryogenesis of carnation(Dianthus caryophyllus L.)[J].Plant Cell Tiss Organ Cult,2008(92):273-280.
[7]卢珍红,桂 敏,龙 江,等.香石竹繁殖技术研究进展[J].安徽农业科学,2010,38(4):1715-1717.
[8]周长东.香石竹组织快繁技术的研究[J].山西林业科技出版社,2005(6):10-11.
[9]黄 莺,范燕萍,王文生,等.石竹愈伤组织诱导及植株再生[J].华南农业大学学报,2003,24(1):50-52.
[10]叶祖云,陈爱萍.几种因子对香石竹组培玻璃苗形成的影响[J].宁德师专学报,1998,10(4):286-288.
[11]刘开辉,丁小维,邓百万,等.不同浓度的外源激素对香石竹组织培养的影响[J].安徽农业科学,2007,35(19):5735-5736.
[12]潘俊松,蔡 润,刘艳芳,等.海石竹的离体快繁及核型分析[J].广西植物,2004,24(1):33-36.
[13]曹善东,贾洪涛.不同碳源对草莓脱毒苗组培快繁的影响[J].山东林业科技,2003(3):6-7.
[14]吴 瑕,张 涛,杨凤军,等.不同碳源及浓度对草原樱桃组培苗繁育的影响[J].黑龙江八一农垦大学学报,2007,19(5):26-29.
[15]黄冬华,周 群,陶秀花,等.矮生香石竹的组织培养和快速繁殖[J].中国农学通报,2007,9(23):103-106.
[16]郑丽屏,李文庚,王 玲.多效唑在重瓣丝石竹组织培养中的作用[J].资源开发与市场,2000,16(5):276-277.
[17]陈春满,何蜜丽,蒋雄辉,等.不同基本培养基及有机添加物对3个朵丽蝶兰品种组培苗生长的影响[J].亚热带植物科学,2008,37(4):32-34.
[18]曹善东,李桂新.MS培养基中不同浓度有机物对草莓脱毒苗繁殖系数的影响[J].山东农业大学学报(自然科学版),2004,35(1):32-35.
[19]汤青林,牛 义,王志敏,等.芋芽继代培养中激素、水解乳蛋白、碳源的调节研究[J].西南农业学报,2009,19(5):928-930.
[20]潘瑞炽.植物细胞工程.[M].广州:广东高等教育出版社,2008.19-21.
[21]沈宁东,郭 辉,韦梅琴.活性炭对香石竹试管苗继代培养的影响[J].安徽农业科学,2003,37(3):979-980.
