柱形病对黄颡鱼血液生化指标的影响
2016-04-23程辉辉李大鹏
程辉辉,李大鹏
(华中农业大学水产学院,池塘健康养殖湖北省工程实验室,淡水水产健康养殖湖北省协同创新中心,
农业部淡水生物繁育重点实验室,武汉 430070)
柱形病对黄颡鱼血液生化指标的影响
程辉辉,李大鹏
(华中农业大学水产学院,池塘健康养殖湖北省工程实验室,淡水水产健康养殖湖北省协同创新中心,
农业部淡水生物繁育重点实验室,武汉430070)
摘要:为探究柱形病对黄颡鱼(Pelteobagrus fulvidraco)生理机能的影响,随机选取患病和健康黄颡鱼各10尾,采集其血液,静置后离心分离血清以测定血液生化指标如皮质醇、乳酸(LD)含量,乳酸脱氢酶(LDH)、碱性磷酸酶(ALP)活性,葡萄糖、白蛋白(ALB)、总蛋白(TP)、尿素氮(BUN)、总胆固醇(TCHO)、高密度脂蛋白胆固醇(HDLC)、低密度脂蛋白胆固醇(LDLC)含量,谷草转氨酶(AST)、谷丙转氨酶(ALT)活性。结果显示:患病黄颡鱼血清皮质醇浓度和LDH、AST活性均极显著高于健康鱼,LD含量和ALT活性显著高于健康鱼。与健康鱼相比,患病黄颡鱼血清葡萄糖含量极显著降低,而HDLC、LDLC、TCHO、ALB、TP、BUN浓度和ALP活性无显著差异。健康鱼肝细胞呈近圆形,形状较规则,细胞界线清晰,细胞核多位于细胞中央,呈圆形或椭圆形,肝细胞以中央静脉为中心形成放射状排列。患病鱼肝细胞出现局部坏死、空泡化,形成坏死灶,伴有大量中性粒细胞、淋巴细胞浸润。结果表明:柱状黄杆菌感染可引起黄颡鱼鱼体显著的应激反应,并引起鱼体肝脏损伤。
关键词:黄颡鱼(Pelteobagrus fulvidraco);柱形病;生化指标;皮质醇;肝脏组织
黄颡鱼(Pelteobagrusfulvidraco)隶属于鲇形目鮠科黄颡鱼属,广泛分布于在我国长江、珠江、黑龙江流域江河湖泊等水域,为我国名特经济鱼类之一。在黄颡鱼人工养殖过程中,由于养殖环境恶化等原因,黄颡鱼病害时有发生[1],常见有锚头鳋病、细管虫病、车轮虫病等[2]寄生虫性疾病以及出血性水肿病、肠炎病、烂鳃病[3]等细菌性疾病。

1材料与方法
1.1实验鱼
黄颡鱼来源于湖北省公安县崇湖渔场,暂养于华中农业大学水产学院教学实习基地人工生态试验系统养殖缸内,暂养期间部分黄颡鱼自然感染柱状黄杆菌而患病并出现死亡,当时水温为10~15 ℃。
1.2实验方法
1.2.1采血和血清制备
随机选取黄颡鱼柱形病患病鱼,体质量为(112.13±31.13)g,体长(18.80±1.86)cm和健康鱼,体质量为(108.41±39.57)g,体长(18.67±2.68)cm,各10尾(患病和健康鱼体质量和体长均无显著差异),采用MS-222(160 mg/L)进行鱼体麻醉,尾动脉采血1 mL左右,室温静置至血液分层后,1 500 r/min离心30 min分离血清用于血液生化指标的测定。
1.2.2血液生化指标的测定
血清皮质醇浓度采用竞争性放射性免疫测定法测定,检测试剂盒购自北京北方生物技术研究所。乳酸(LD)含量,乳酸脱氢酶(LDH)、碱性磷酸酶(ALP)活性均采用南京建成生物工程研究所试剂盒测定,相应操作参照说明书进行。葡萄糖、白蛋白(ALB)、总蛋白(TP)、尿素氮(BUN)、总胆固醇(TCHO)、高密度脂蛋白胆固醇(HDLC)、低密度脂蛋白胆固醇(LDLC)含量,谷草转氨酶(AST)、谷丙转氨酶(ALT)活性指标均采用Chemix-800型全自动生化分析仪(日本希森美康公司)测定,相应操作参照说明书进行。
1.2.3肝脏组织石蜡切片观察
解剖黄颡鱼柱形病患病和健康鱼鱼体,分离肝脏,采集肝脏样品(大小为3 mm×3 mm×3 mm)于Bouin氏液固定24 h,普通石蜡(56 ℃)包埋、RN2135型切片机(德国Leica公司)连续切片(厚度5~6 μm)、H.E染色后,最后用80 i荧光显微镜(日本Nikon公司)观察并拍照记录。
1.3数据分析
使用SPSS 19.0软件独立样本T检验对数据进行分析,数据以平均值±标准差形式表示,P<0.05为差异显著,P<0.01 为差异极显著。
2结果
2.1黄颡鱼柱形病患病鱼症状描述
患病黄颡鱼除尾部背肌处皮肤斑块状褪色溃烂外,体色发黑,头部尤为明显;口腔、下颌和下颌至腹部粘附黄褐色物质,将其刮落,可观察到暴露出来的皮肤出现不同程度的腐烂;眼睛凹陷,体表黏液增多,但未见鳃丝肿胀糜烂等异常情况;少数病鱼腹部胸鳍处出现明显的破溃。濒死黄颡鱼离群独游,行动缓慢,对外界刺激反应迟钝,偶见病鱼旋转翻滚。解剖鱼体可见:症状轻微者,内脏器官无明显病变;症状严重者,肠壁变薄、肠道内充满黄色黏液,但未见腹水,其脂肪和肌肉组织也无出血现象。
2.2黄颡鱼柱形病患病鱼血液生化指标的变化
患病黄颡鱼血清皮质醇浓度和LDH、AST活性均极显著高于健康鱼,LD含量和ALT活性显著高于健康鱼。与健康鱼相比,患病黄颡鱼血清葡萄糖含量极显著降低,而HDLC、LDLC、TCHO、ALB、TP、BUN浓度和ALP活性无显著差异(表1)。
2.3黄颡鱼柱形病患病鱼肝脏组织石蜡切片的观察
健康鱼肝细胞呈近圆形,形状较规则,细胞界线清晰,细胞核多位于细胞中央,呈圆形或椭圆形,肝细胞以中央静脉为中心形成放射状排列(图1A)。患病鱼肝细胞出现局部坏死、空泡化,形成坏死灶,伴有大量中性粒细胞、淋巴细胞浸润(图1B)。

表1 柱形病患病和健康黄颡鱼血液生化指标比较
注:*表示差异显著(P<0.05), **表示差异显著(P<0.01),n表示重复数。# 表示由于患病黄颡鱼处于濒死状态,采血困难,采血量不足,导致样本数减少。
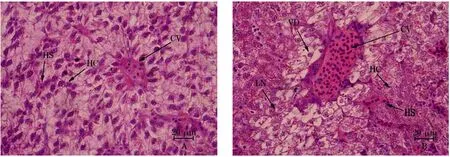
图1 柱形病患病和健康黄颡鱼肝脏组织石蜡切片观察的比较
注:A,健康黄颡鱼肝脏组织;B,患病黄颡鱼肝脏组织。CV,中央静脉;HC,肝细胞索;HS,肝窦;VD,空泡变性;LN,局部坏死。
3讨论
皮质醇通常作为鱼类应激的指示指标。当鱼类经历运输、氨氮、酸碱等胁迫时,往往会表现出以血液皮质醇浓度升高为代表的应激反应[5-7]。黄颡鱼感染累枝虫出现了以血液皮质醇含量显著升高为代表的应激反应[8],而柱形病患病黄颡鱼的血清皮质醇浓度极显著升高,同样表明柱状黄杆菌的感染引起了黄颡鱼显著的应激反应。可见,细菌与寄生虫等一样,均可被看作生物应激因子[9-10]。鱼类应激反应中,血糖含量往往也会明显升高[5,11],然而,非洲鲶鱼(Clariasgariepinus)经过72 h运输应激之后其血浆葡萄糖浓度仍保持稳定[12]。但是本研究结果显示患病黄颡鱼血清葡萄糖含量极显著降低,可能是由于葡萄糖作为二级应激反应指示指标,其浓度变化明显滞后于皮质醇[13],导致患病黄颡鱼低水平血糖水平未能及时补充。
乳酸主要是肌肉在供氧不足如水体中溶氧含量低、血液循环缓慢和动物的剧烈运动等情况下通过糖酵解产生。LDH活性为衡量无氧酵解能力的重要指标,是无氧代谢终产物LD的直接催化酶。机体受胁迫后多会表现出剧烈运动,从而导致LD的累积[14-15]。患病黄颡鱼血清LD含量极显著高于健康鱼,主要可能是在感染柱状黄杆菌的初期,黄颡鱼显著的应激反应导致患病黄颡鱼剧烈运动,短时间产生的LD没有被充分清除而积累在体内,进而引起LDH活性极显著地升高。而在感染柱状黄杆菌的后期,黄颡鱼濒临死亡,反应迟钝,行动缓慢,实验过程中偶见其旋转翻滚。
HDLC和LDLC是反映脂类在动物体内的分解、转运及肝脏脂肪代谢的重要指标。TCHO是脂肪在血液中存在的一种形式,其主要在肝脏中合成,是反映肝脏对脂肪的代谢状况的指标之一[16-17]。ALB、TP和BUN是反映血清蛋白质代谢和排泄水平的重要指标[17-18]。患病黄颡鱼血清HDLC、LDLC、TCHO、ALB、TP、BUN浓度无显著差异表明,尽管柱状黄杆菌引起的应激导致黄颡鱼葡萄糖和LD含量的显著变化,但柱状黄杆菌感染对黄颡鱼脂类和蛋白质代谢并无显著影响。
AST主要分布于心肌,ALT主要分布于肝脏,都属于胞内功能酶,正常情况下血清中含量很低,但当肝细胞或心肌细胞受损时,由于细胞膜通透性增加,胞浆内的ALT与AST释放入血浆,致使血清ALT和AST活性升高,因而具有重要的鱼病诊断意义[19]。而ALP活性通常认为与肝功能障碍和肝脏疾病紧密相关[20]。柱状黄杆菌多数危害鱼类鳃部并引起鱼体体表溃疡[21]。黄琪琰等[22]对草鱼人工感染鱼害黏球菌(MyxococcuspiscicolaLu,Nie & Ko,1975),发现草鱼不仅鳃部发生严重病变,而且肝细胞发生颗粒变性、水样变性、糖元颗粒消失,以至坏死;肾组织主要发生近曲小管上皮细胞颗粒变性、水样变性、坏死。鱼害黏球菌是柱状黄杆菌的同物异名[23],鱼害黏球菌可引发鱼类烂鳃病。本试验中同样发现黄颡鱼肝脏空泡变性和局部坏死,但未观察到鳃丝肿胀糜烂等异常情况。患病黄颡鱼血清AST活性极显著升高,ALT活性显著升高,血液学指标显示出患病黄颡鱼肝脏损伤,而肝脏石蜡切片观察到空泡变性和局部坏死则进一步说明柱状黄杆菌引起黄颡鱼肝脏损伤。
综上所述,柱状黄杆菌感染可引起黄颡鱼鱼体显著的应激反应,并引起鱼体肝脏损伤。
参考文献:
[1]程辉辉,邵建春,李大鹏,等.黄颡鱼柱形病的防治[J].科学养鱼,2014,(4):59.
[2]王如鹓,李萍,王松刚.黄颡鱼常见疾病的防治技术[J].科学养鱼,2014,(5):90.
[3]计连泉,濮月龙.黄颡鱼常见疾病的防治技术[J].科学养鱼,2011,(3):56.
[5]Dhanasiri A K S,Fernandes J M O,Viswanath K.Acclimation of zebrafish to transport stress[J].Zebrafish,2013,10(1):87-98.
[6]李波,樊启学,杨凯,等.慢性氨氮胁迫对黄颡鱼摄食,生长及血液指标的影响[J].应用与环境生物学报,2011,17(6):824-829.
[7]Rodrigues R V,Pedron J D S,Romano L A,et al.Acute responses of juvenile cobia,Rachycentroncanadum(Linnaeus 1766) to acid stress[J].Aquacult Res,2015,46(5):1241-1247.
[8]程辉辉,Onxayvieng K,王哲,等.感染累枝虫对黄颡鱼血液生化指标的影响[J].淡水渔业,2015,45(4):96-99.
[9]赵建华,杨德国,陈建武,等.鱼类应激生物学研究与应用[J].生命科学,2011,(4):394-401.
[10]Pickering A D,Pottinger T G.Stress responses and disease resistance in salmonid fish:Effects of chronic elevation of plasma cortisol[J].Fish Physiol Biochem,1989,7(1-6):253-258.
[11]Oyoo-Okoth E,Cherop L,Ngugi C C,et al.Survival and physiological response ofLabeovictorianus(Pisces:Cyprinidae,Boulenger 1901) juveniles to transport stress under a salinity gradient[J].Aquaculture,2011,319:226-231.
[12]Manuel R,Boerrigter J,Roques J,et al.Stress in African catfish (Clariasgariepinus) following overland transportation[J].Fish Physiol Biochem,2014,40(1):33-44.
[13]Vijayan M,Moon T.Acute handling stress alters hepatic glycogen metabolism in food-deprived rainbow trout (Oncorhynchusmykiss)[J].Can J Fish Aquat Sci,1992,49(11):2260-2266.
[14]童燕,陈立侨,庄平,等.急性盐度胁迫对施氏鲟的皮质醇、代谢反应及渗透调节的影响[J].水产学报,2007,31:38-44.
[15]Carl B S,Logi J,Grant F,et al.Conditioning improves performance of juvenile chinook salmon,Oncorhynchustshawytscha,to transportation stress[J].Aquaculture,1995,135(1-3):99-110.
[16]贺喜,戴求仲,张石蕊,等.日粮共轭亚油酸对两个品种肉仔鸡生长性能及脂类代谢的影响[J].动物营养学报,2007,19:581-587.
[17]黄金凤,徐奇友,王常安,等.温度和饲料蛋白质水平对松浦镜鲤幼鱼血清生化指标的影响[J].大连海洋大学学报,2013,28:85-90.
[18]李辉,刁其玉,张乃锋,等.不同蛋白质来源对早期断奶犊牛消化及血清生化指标的影响(一)[J].动物营养学报,2009,21:47-52.
[19]张丽杰.血清转氨酶的测定及临床意义[J].中国医药指南,2012,10:298-299.
[20]Giannini E G,Testa R,Savarino V.Liver enzyme alteration:a guide for clinicians[J].Can Medic Associat J,2005,172(3):367-379.
[21]黄锦炉,汪开毓,黄艺丹,等.水生动物致病菌——柱状黄杆菌研究进展[J].中国水产,2009,(10):59-61.
[22]黄琪琰,郑德崇,蔡完其,等.草鱼细菌性烂鳃病的组织病理研究[J].水产学报,1983,(2):95-104.
[23]王良发,谢海侠,张金,等.我国淡水鱼类柱形病病原菌柱状黄杆菌的遗传多样性[J].水生生物学报,2010,(2):367-377.
(责任编辑:张红林)
The influence of columnaris disease on blood biochemical profiles in Pelteobagrus fulvidraco
CHENG Hui-hui,LI Da-peng
(CollegeofFisheries,HuazhongAgriculturalUniversity/EngineeringLaboratoryofPondAquacultureinHubeiProvince/FreshwaterAquacultureCollaborativeInnovationCenterofHubeiProvince/KeyLaboratoryofFreshwaterAnimalBreeding,MinistryofAgriculture,Wuhan430070,China)
Abstract:To investigate the effects of columnaris disease on physiological function in yellow catfish (Pelteobagrus fulvidraco),the sick and healthy yellow catfish,respectively 10 individuals,were randomly selected to collect its blood for serum indices comparison.The serum indices included cortisol,lactic acid (LD),lactate dehydrogenase (LDH),alkaline phosphatase (ALP),glucose,albumin (ALB),total protein (TP),blood urea nitrogen (BUN),total cholesterol (TCHO),high density lipoprotein cholesterol (HDLC),low density lipoprotein cholesterol (LDLC),aspartate aminotransferase (AST),alanine aminotransferase (ALT).The results showed that level of cortisol,activities of LDH and AST in sick fish increased extremely significantly,and LD content,ALT activity increased significantly.Compared with healthy fish,the glucose content in sick fish decreased significantly,but the levels of HDLC,LDLC,TCHO,ALB,TP,BUN and ALP activity had no significant difference.The liver cells of healthy fish were nearly round,with regular shape and clear cell boundaries.Its cell nuclei were in the central and round or oval.Liver cells were radially arranged with center of central vein.The liver cells of diseased fish showed partial necrosis,vacuolization,accompanied by a large number of neutrophils and lymphocytes.The results suggested that it provoked significant stress response and liver damage in yellow catfish infected with Flavobacterium cloumnare.
Key words:Pelteobagrus fulvidraco;columnaris disease;biochemical indicates;cortisol;hepatic tissue
中图分类号:S941.42
文献标识码:A
文章编号:1000-6907-(2016)02-0103-04
作者简介:第一程辉辉(1990-),男,硕士研究生,专业方向为水产养殖。E-mail:chhwoter@126.com通讯作者:李大鹏。E-mail:ldp@mail.hzau.edu.cn
收稿日期:2015-05-23;
修订日期:2015-11-10
资助项目:“十二五”农村领域国家科技计划课题(2012BAD25B06);中央高校基本科研业务费专项资金资助项目(2014PY041);湖北省自然科学基金重点项目(2012FFA029)
·研究简报·
