饲料中添加几丁聚糖对吉富罗非鱼幼鱼肝脏抗氧化力、血清激素及肌肉营养的影响
2016-04-23孙意岚袁庆华朱志祥苏田平
强 俊,孙意岚,黄 永,徐 跑,杨 弘,袁庆华,何 杰,朱志祥,苏田平
(1.中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和
种质资源利用重点实验室,江苏无锡 214081;
2.无锡几丁生物新材料科技发展有限公司,江苏无锡 214026;
3.江苏德仁生物科技发展有限公司,江苏金坛 213200)
饲料中添加几丁聚糖对吉富罗非鱼幼鱼肝脏抗氧化力、血清激素及肌肉营养的影响
强俊1,孙意岚1,黄永2,徐跑1,杨弘1,袁庆华2,何杰1,朱志祥1,苏田平3
(1.中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和
种质资源利用重点实验室,江苏无锡214081;
2.无锡几丁生物新材料科技发展有限公司,江苏无锡214026;
3.江苏德仁生物科技发展有限公司,江苏金坛213200)
摘要:以吉富罗非鱼(Oreochromis niloticus)幼鱼为研究对象,探讨添加不同剂量的几丁聚糖对吉富罗非鱼幼鱼肝脏抗氧化力、血清生化与肌肉品质的影响。选择体重为(2.97±0.02) g的健康吉富罗非鱼375尾,随机分为5组,每组3个重复,每个重复25尾鱼,分别饲喂在基础日粮中添加0%(对照组)、1%、2%、3%和4%几丁聚糖溶液(有效成分为0.6%)。养殖63 d后,测定肝脏抗氧化性能、血清生化和激素水平以及肌肉中氨基酸与脂肪酸组成。结果显示,饲料中添加1%和2%几丁聚糖能显著提高血清C3、T3和Po水平,降低Lac与T4水平(P<0.05)。同时,1%和2%添加组能显著降低肝脏MDA含量,提高SOD、CAT和GSH-Px活力(P<0.05)。各实验组水分、灰分与粗蛋白含量无显著差异(P>0.05)。然而,随几丁聚糖添加水平的增加,粗脂肪含量显著下降(P<0.05)。各实验组氨基酸组成与脂肪酸组成无显著差异(P>0.05); 2%和3%几丁聚糖组氨基酸组成中EAA、DAA和TAA含量与PUFA含量略高于其它实验组。
关键词:吉富罗非鱼(Oreochromis niloticus);几丁聚糖;抗氧化力;血清激素;肌肉营养成分
为适应罗非鱼健康养殖发展的需求,寻求一种既能提高鱼体生长与免疫力,又能减少环境污染的产品成为了关键。几丁聚糖可以有效地抑制多种真菌与细菌生长,其调控原理是几丁聚糖与细胞表面的负电荷残基之间的质子化氨基(NH2)基团通过静电力相互作用,从而增强细胞表面的抗菌活性[1]。饲料中添加几丁聚糖可以提高鲤鱼(Cyprinuscarpio)[2]、草鱼(Ctenopharyngodonidellus)[3]和异育银鲫(Carassiusauratusgibelio)[4]等淡水鱼类的免疫与抗氧化活性。然而,通过传统工艺从虾壳与蟹壳中提取的几丁聚糖存在分子质量巨大、聚合度高、吸收率低以及提取工艺成本较高等原因制约了其推广应用。由无拮抗作用的微生物发酵产生的新型几丁聚糖分子小,易于吸收,提取工艺较为简单,成本较低,安全性高,毒性低 (LD50>20 000 mg/kg)[5]。前期实验研究发现,饲料中添加1%~2%的几丁聚糖能够明显促进吉富罗非鱼(Oreochromisniloticus)幼鱼生长、提高饲料效率与头肾非特异性免疫,降低感染海豚链球菌后死亡率。相关结果已另行发表[6]。实验针对不同几丁聚糖添加水平下吉富罗非鱼幼鱼肝脏抗氧化力、血清激素以及肌肉氨基酸与脂肪酸组成展开研究,旨在为新型几丁聚糖的推广应用提供依据。
1材料与方法
1.1实验用鱼
实验鱼采自中国水产科学研究院淡水渔业研究中心宜兴基地自繁的第十七代“吉富”品系尼罗罗非鱼幼鱼,选择无病无伤,活力强的个体作为实验用鱼。实验前在室内水泥池(水温(29±1)℃,pH 7.4±0.2)中暂养10 d,自然光周期。暂养期间使用循环水连续充气,每天8:00和15:00各投喂沉水性饲料1次(粗蛋白为29.0%、粗脂肪8.0%),投喂量为体重的8%。
1.2实验设计与分组
实验饲料基础日粮组成见表1,共设5组实验饲料,以基础饲料为对照,分别在基础饲料中添加1%、2%、3%和4%的几丁聚糖溶液(购于江苏德仁生物科技有限公司,有效浓度0.6%)。每个实验组合按照下述饲料配方分别配制10 kg的饲料后,采用电动移液器准确吸取100、200、300、400 mL的几丁聚糖液体溶液,转化为浓度质量比为1%、2%、3%和4%。同时设置不加几丁聚糖的对照组(0%)。将几丁聚糖溶液添加至水中,混匀后,用喷壶均匀喷洒到饲料中,使用饲料制粒机制成颗粒。阴凉处风干,-20 ℃保存备用。本实验基础日粮含粗蛋白29.0%、粗脂肪8.0%。
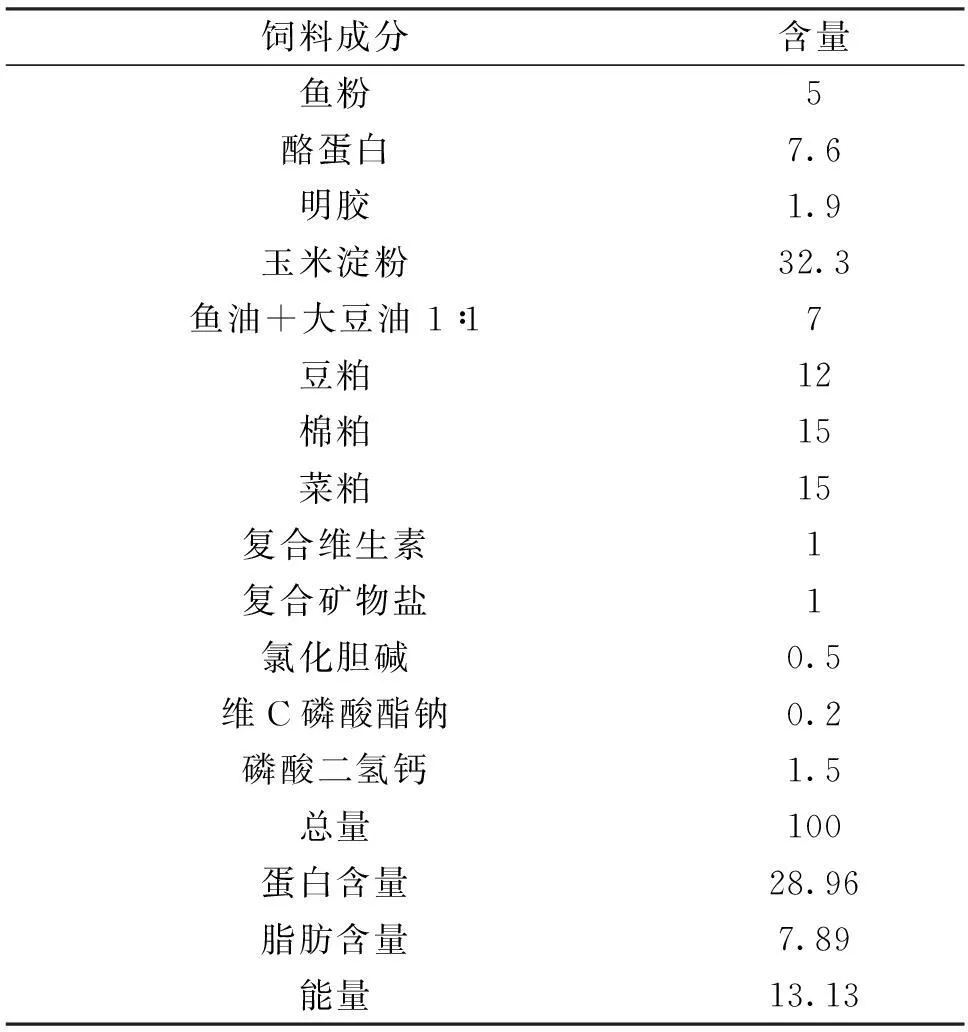
表1 基础日粮组成
注:1)复合维生素(mg/kg 饲料):维生素 A 10,维生素D 0.05,维生素 E 400,维生素 K 40,维生素B150,维生素B2200,维生素B3500,维生素B650,维生素B75,维生素B1115,维生素B120.1,维生素 C 1 000,肌醇 2 000,胆碱 5 000;2) 复合矿物质(mg/kg 饲料):FeSO4·7H2O 372,CuSO4·5H2O 25,ZnSO4·7H2O 120,MnSO4·H2O 5,MgSO42 475,NaCl 1 875,KH2PO41 000,Ca (H2PO4)2 2 500.
1.3饲养管理
实验在封闭的水循环系统中进行,选取15个800 L的塑料桶,每个塑料桶添加曝气3 d后的自来水700 L。利用控温系统将温度保持在(29±0.3)℃,实验用鱼初始平均体重为(2.97±0.02)g,每个实验水平共放置75尾鱼,每个平行组各25尾鱼。各组初始体重没有显著差异(P>0.05)。分别投喂添加不同几丁聚糖水平的实验饲料,每次投喂体重的5%~8%,每周投喂6 d,停饲1 d,实验周期共计63 d。实验期间连续充气,采用虹吸法清除桶底粪便,每隔3 d换水1/3,保持换水前后温差不超过0.5 ℃,溶氧保持在5 mg/L以上,pH 7.6±0.2,氨氮和亚硝酸盐分别不高于0.003 mg/L和0.004 mg/L,自然光周期。
1.4采样与处理
每个养殖桶随机选取4尾鱼,利用MS-222(2%)深度麻醉后,取血样检测相关指标的变化。血样于4 ℃冰箱中静置2 h,在4 ℃,3 500 r/min离心10 min制备血清,上清液移置-70 ℃冰箱中保存备用。每个平行另外随机选取3尾鱼,用纱布擦去每尾鱼体表的水分,用手术刀割取罗非鱼背部肌肉,低温绞碎后分装,一半用于测量肌肉一般营养成分,一半用于肌肉氨基酸与脂肪酸的测定;同时剖取0.1 g左右的肝脏用液氮速冻后,于-70 ℃保存,用于抗氧化指标分析。
1.5血清生化指标的测定
补体3(C3)、乳酸(Lac)、酚氧化酶(PO)、免疫球蛋白M(IgM)、三碘甲腺原氨酸(T3)与甲状腺素(T4)采用鱼用生物素双抗体夹心酶联免疫吸附法(ELISA)进行检测,实验结果通过BioTek EonTM微孔板分光光度计进行读数。试剂盒均购自上海朗顿生物科技有限公司。
1.6肝脏抗氧化指标的测定
肝脏样品解冻后,用预冷生理盐水冲洗,滤纸吸干水分后称重,加入4倍体积(W/V)预冷生理盐水研磨制作匀浆,肝脏SOD、CAT、GSH和GSH-Px的活性以及MDA含量测定采用上海朗顿生物有限公司的试剂盒,按照试剂盒中的说明制备粗酶液。粗酶液置于4 ℃保存,在24 h内测定完毕。实验结果通过BioTek EonTM微孔板分光光度计进行读数。
1.7肌肉营养测定
1.7.1一般营养成分测定
试验鱼肌肉粗蛋白质含量采用凯氏定氮法(GB 5009.5-2010) 测定,粗脂肪含量采用索氏抽提法( GB 5009.6-2010) 测定,水分含量采用恒温(105 ℃) 干燥法( GB 5009.3-2010) 测定,粗灰分含量采用马福炉高温( 550 ℃) 灼烧法( GB5009.4-2010) 测定[7]
1.7.2氨基酸组成测定
样品经酸(6 mol/L HOI)水解后,参照JY/T019-1996的方法在高效液相色谱仪(Aglient 1100型)上测定氨基酸组成(色氨酸须碱水解方能测出,本实验未检测)。
1.7.3脂肪酸组成测定
称取约1.5 g样品+15 mL混合溶剂(氯仿/甲醇=2/1)振荡提取三次,过滤,合并滤液挥干。加2 mL 0.5 mol/L氢氧化钠甲醇溶液,60 ℃水浴30 min。冷却,加2 mL 25%三氟化硼甲醇溶液,60 ℃水浴20 min。冷却,加2 mL正己烷和2 mL饱和氯化钠溶液,振荡萃取,静止分层。取上层利用日本岛津(Shimadzu) GC-2010进行检测。
1.8数据处理
数据结果用平均值±标准差(Mean±SD)表示,实验数据用SPSS17.0统计软件进行方差分析及Duncan多重比较,显著水平为P<0.05。
2结果与分析
2.1饲料中添加几丁聚糖对吉富罗非鱼幼鱼血清生化与激素水平的影响
几丁聚糖对吉富罗非鱼幼鱼血清生化与激素水平的影响见表2。1%组血清补体C3与IgM水平均显著高于对照组;随着几丁聚糖添加水平上升,补体C3水平显著下降(P<0.05)。2%组血清Lac水平显著低于对照组(0%)与3%和4%添加水平;同时,1%和2%水平组血清PO与T3水平均显著高于其它实验组。随着几丁聚糖添加水平上升(1%-4%),血清T4水平显著上升(P<0.05)。
2.2饲料中添加几丁聚糖对吉富罗非鱼幼鱼肝脏抗氧化指标的影响
饲喂不同几丁聚糖饲料63 d后,吉富罗非鱼肝脏抗氧化指标见表3。1%~2%组肝脏MDA水平分别为580.94与550.04 nmol/mL,明显低于对照组647.03 nmol/mL与4%组的760.70 nmol/mL。肝脏SOD、CAT、GSH与GSH-Px活力在1%或2%几丁聚糖添加组达到峰值,各项指标均显著高于对照组(P<0.05)。
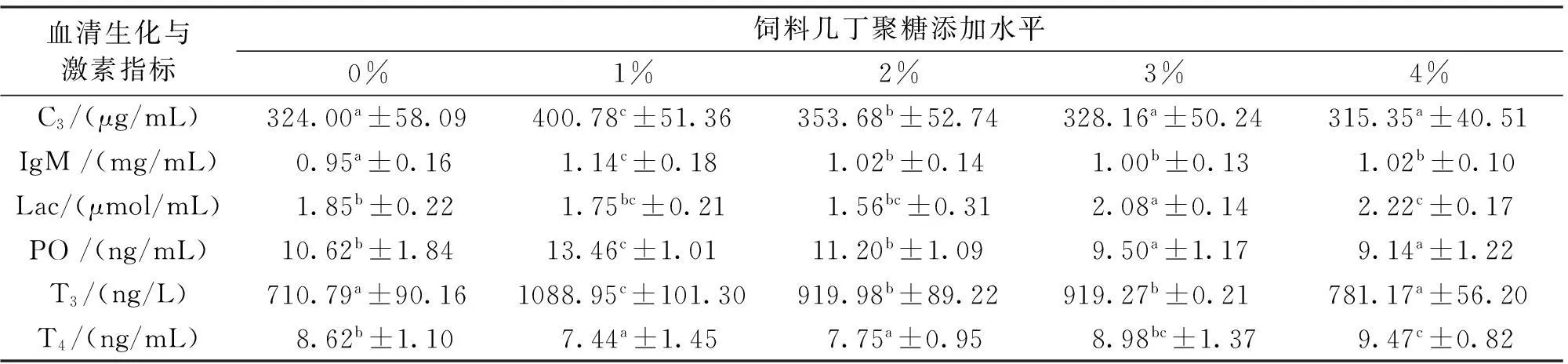
表2 饲料中添加几丁聚糖对吉富罗非鱼幼鱼血清生化与激素水平的影响
注:同一行数值右上角标有不同字母者表示差异显著(P<0.05),下同。
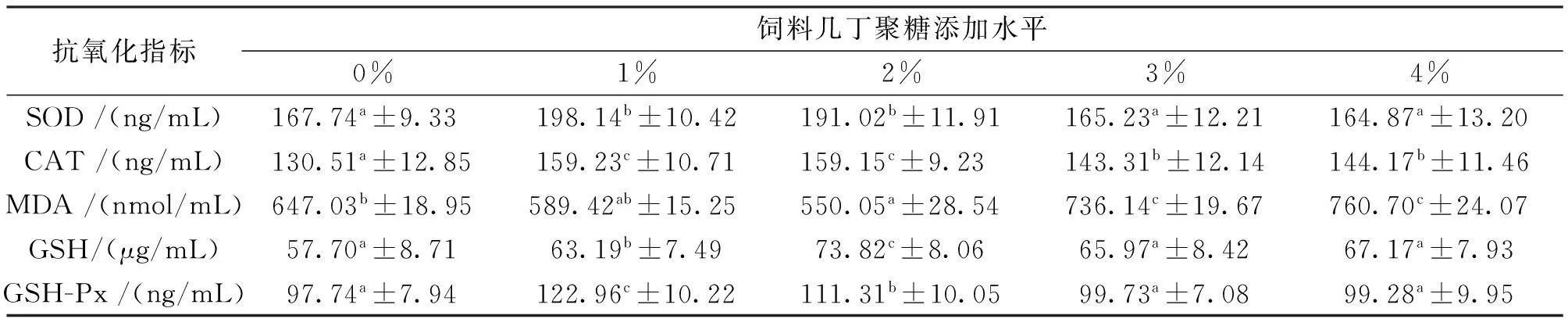
表3 饲料中添加几丁聚糖对吉富罗非鱼幼鱼肝脏抗氧化指标的影响
2.3饲料中添加几丁聚糖对吉富罗非鱼幼鱼肌肉营养成分组成的影响
不同几丁聚糖添加水平下,各实验组肌肉水分、灰分、粗蛋白和粗脂肪的测定结果见表4。当添加水平为0%~4%时,5个处理组肌肉水分为75.87%~77.63%,粗蛋白含量为17.14%~18.23%,灰分含量为1.34%~1.45%,各处理组间无显著差异(P>0.05)。然而,幼鱼粗脂肪含量随着几丁聚糖添加水平的增加而显著下降,由对照组的0.98%下降到4%水平组的0.73%。
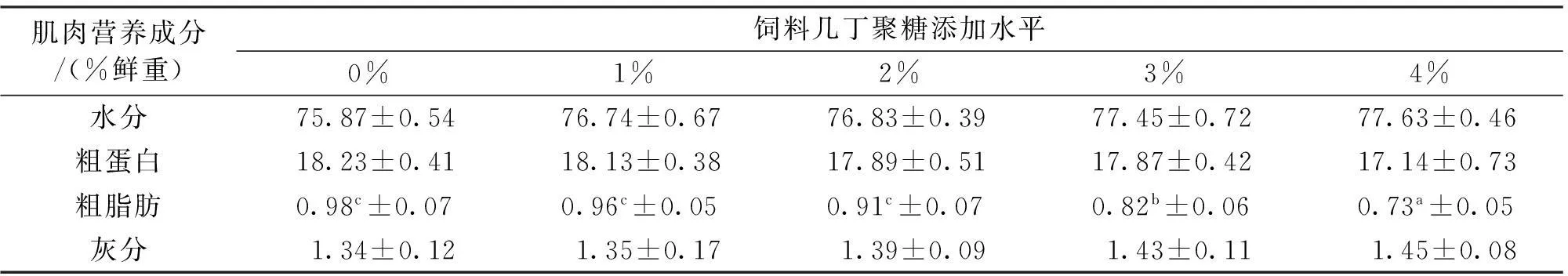
表4 饲料中添加几丁聚糖对吉富罗非鱼幼鱼肌肉营养成分的影响
2.4饲料中添加几丁聚糖对吉富罗非鱼幼鱼肌肉氨基酸组成的影响
由表5所示,不同几丁聚糖添加水平下各实验组吉富罗非鱼幼鱼肌肉中(鲜样)中共检测出17种氨基酸,包含7种必需氨基酸和4种呈味氨基酸。氨基酸总量占鲜样的16.75%~17.75%,必需氨基酸占鲜样重的6.77%~7.26%,呈味氨基酸为6.58%~6.97%,各实验组之间无显著差异(P>0.05)。但是,总氨基酸(TAA)、必需氨基酸(EAA)与呈味氨基酸(DAA)含量在2%和3%几丁聚糖添加组较高,同时,3%组肌肉中Asp、Glu与Lys含量均显著高于对照组。
2.5饲料中添加几丁聚糖对吉富罗非鱼幼鱼肌肉脂肪酸组成的影响
由表6所示,各处理组吉富罗非鱼肌肉中均检测出21种脂肪酸。其中含6中饱和脂肪酸(SFA),3种单不饱和脂肪酸(MUFA)以及12种多不饱和脂肪酸(PUFA)。不同几丁聚糖添加水平下,各实验组SFA、MUFA和PUFA含量之间无显著差异(P>0.05)。然而,各添加水平下,SFA含量呈先下降后上升的变化,3%添加水平SFA含量最低;PUFA的变化趋势相反,2%~3%组PUFA含量较高,其中2%组C20∶4n-6、EPA和DHA含量均显著高于0%与4%几丁聚糖添加组(P<0.05)。各实验组n-6系列PUFA含量无显著差异,然而3%组n-3与n-6系列PUFA略高于其它各实验组。
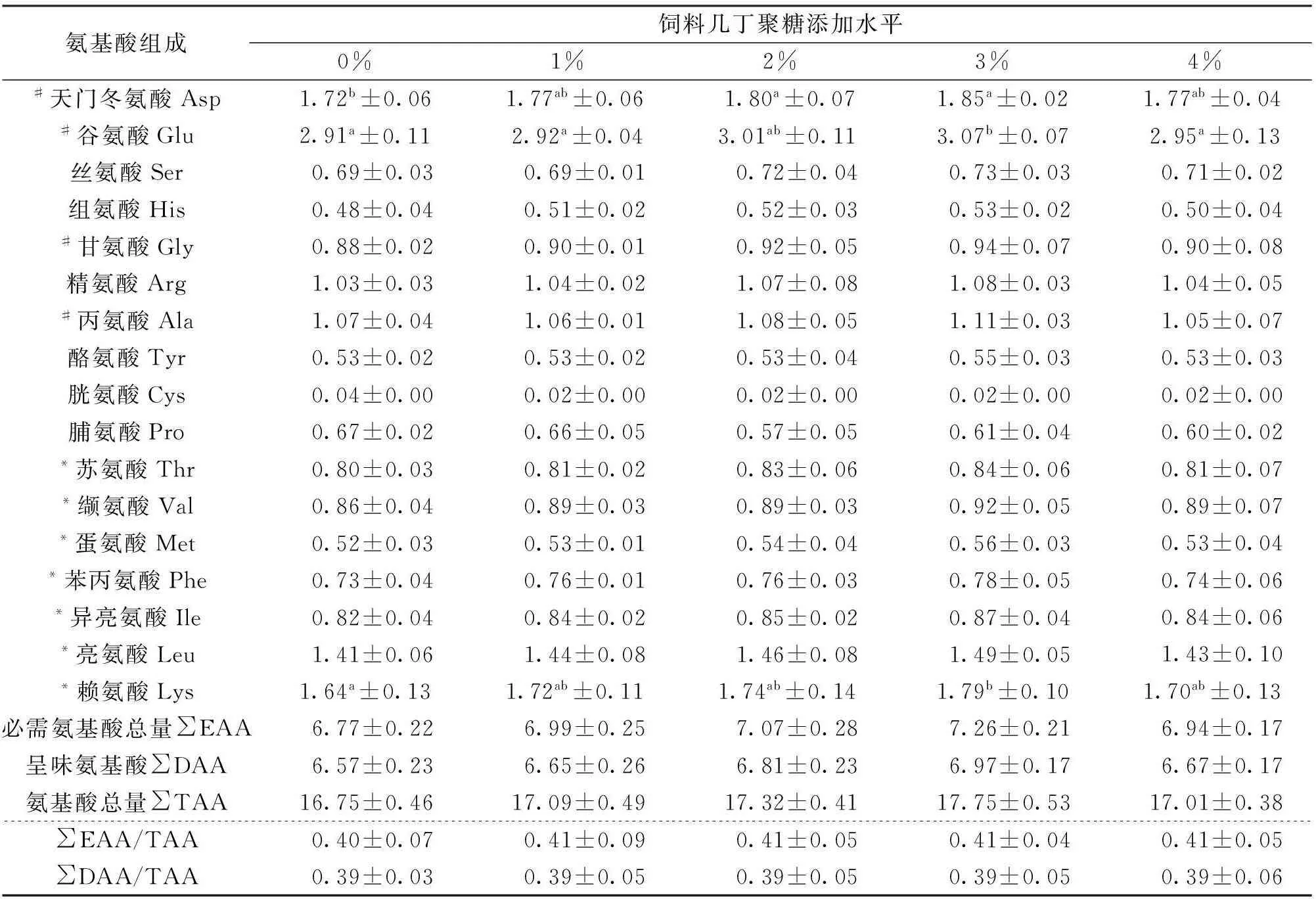
表5 饲料中添加几丁聚糖对吉富罗非鱼幼鱼肌肉氨基酸组成的影响
注:“#”表示呈味氨基酸;“*”为必需氨基酸。
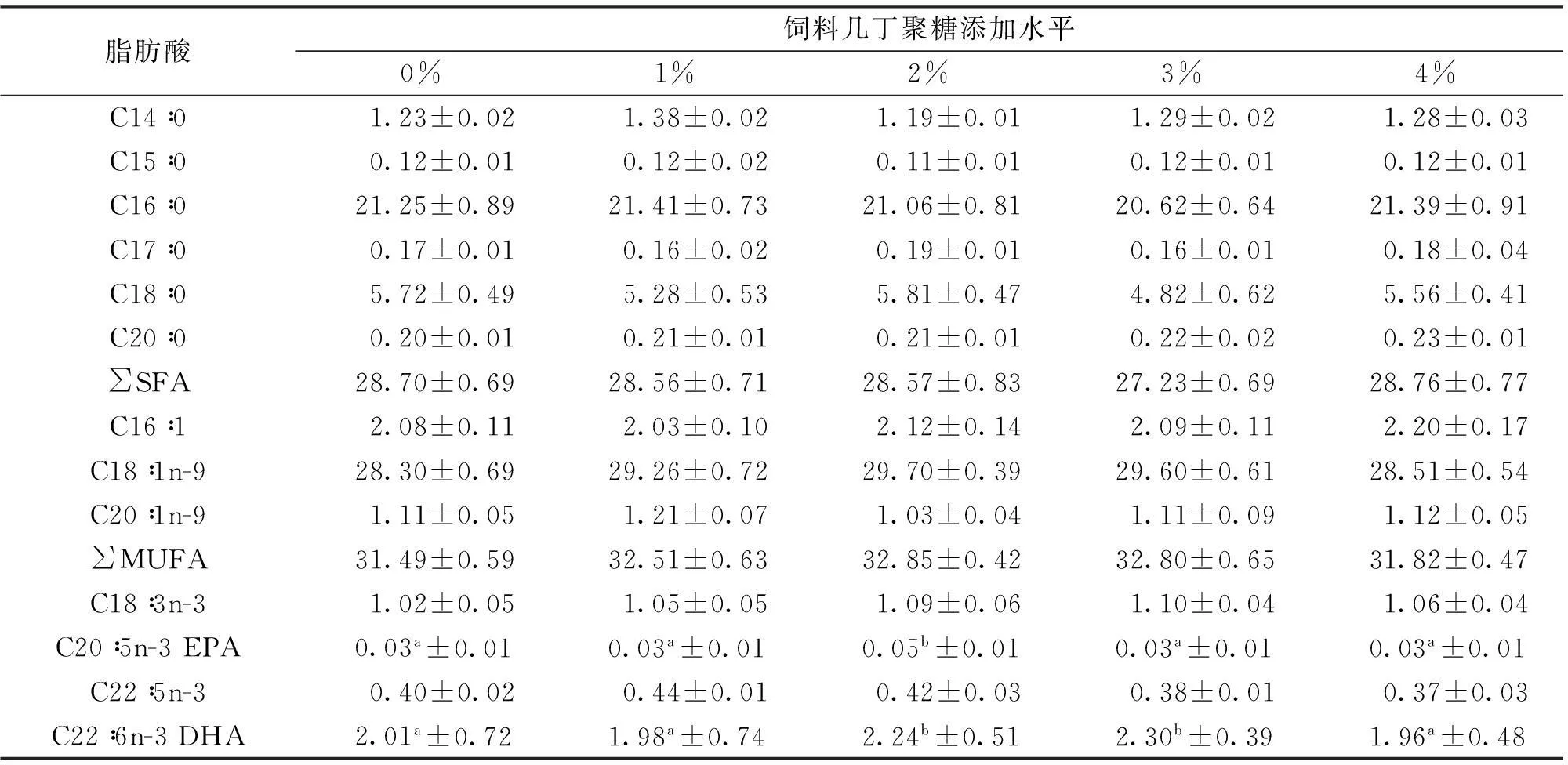
表6 饲料中添加几丁聚糖对吉富罗非鱼幼鱼肌肉脂肪酸组成的影响
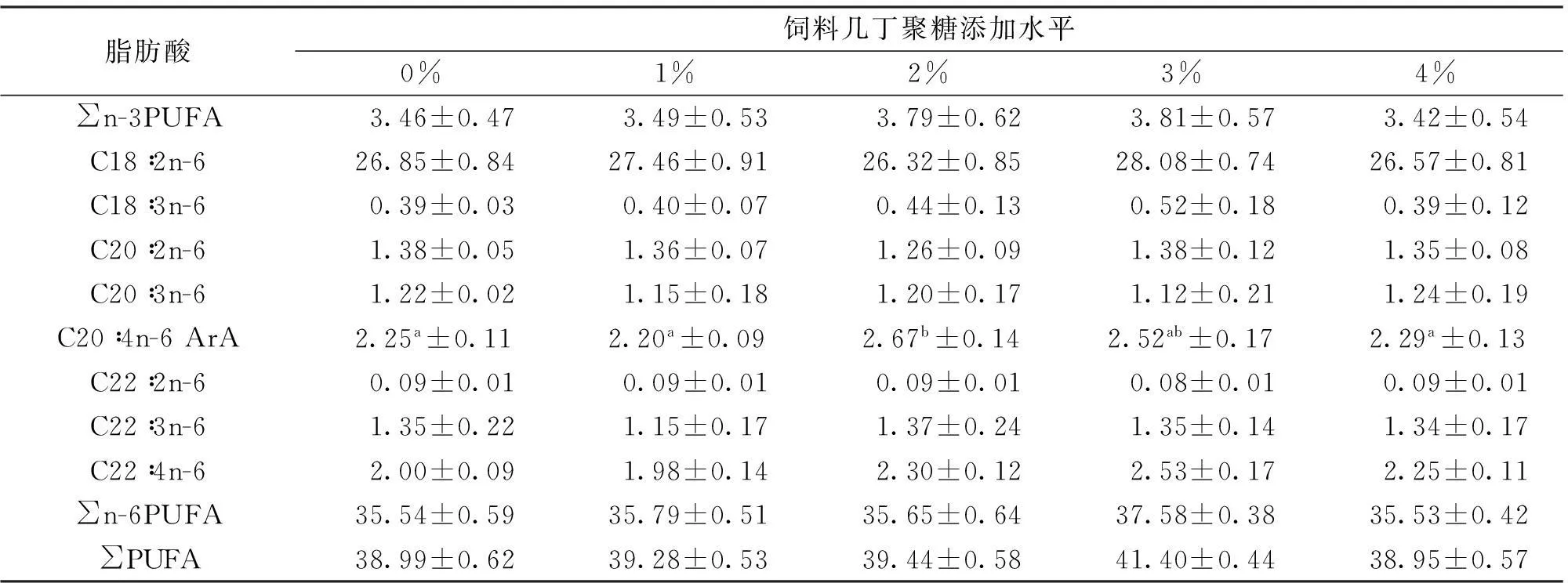
续表6
3讨论
3.1饲料中添加几丁聚糖对吉富罗非鱼幼鱼血清生化与激素水平的影响
本研究中,1%和2%几丁聚糖添加组血清C3与IgM水平显著高于对照组。众所周知,各种肽,诸如LZM、抗体、补体等构成了鱼体第一道免疫防线,这些肽主要存在于血清中,用于预防病害入侵时病菌在鱼体粘附与增殖[8]。血清C3与IgM水平显著上升,可能与低浓度的几丁聚糖添加量能够增加鱼体的天然免疫有关。Cha等[9]与Dautremepuits等[10]在牙鲆(Paralichthysolivaceus)与鲤(Cyprinuscarpio)的几丁聚糖实验中也发现类似结果。3%与4%几丁聚糖添加水平下血清Lac的含量分别为2.08 μmol/mL与2.22 μmol/mL,显著高于其它各实验组。饲料中较高的几丁聚糖水平可能使鱼体产生代谢应激,机体降低了氧气供应或增加了无氧呼吸以满足能量需求,从而导致Lac在血清中聚积[11]。
酚氧化酶(PO)原激活系统属机体识别和防御系统的一部分,可被β-葡聚糖、脂多糖和肽聚糖激活,从颗粒细胞释放到血清中,并在丝氨酸蛋白酶的作用下转变为活性的酚氧化酶。PO可将酚催化成黑色素,起到杀死病原菌的作用[12-13]。因此,PO活性可作为鱼体免疫的评价指标[14]。刘云等[15]在饲料中添加甲壳胺投喂鲫(Carassiuscuvieri)后,PO活性与对照组相比明显提高。本研究中,1%和2%几丁聚糖添加组PO活力显著高于对照组与4%组,这与其较高的C3与IgM相一致,可能与免疫功能提高有关。
鱼类的营养状况对甲状腺激素的分泌与中间产物5′-单脱碘酶的活性有显著影响。摄食低蛋白水平的饲料或饥饿能明显降低血清T3与T4水平,同时也会使肝脏的5′-单脱碘酶活性降低[16-17]。然而增加饲料蛋白水平[18]或恢复摄食能明显提高肝脏5′-单脱碘酶的活性和T3核受体的数量,促进T4向T3的转化[19-20]。因此,饲料中添加低浓度的几丁聚糖促进了吉富罗非鱼生长与饲料利用(前期研究结果),增加甲状腺激素活性,从而导致T4向T3转化,因此出现1%组T3水平上升,T4水平下降的现象。
3.2饲料中添加几丁聚糖对吉富罗非鱼幼鱼肝脏抗氧化指标的影响
应激状态下可诱发鱼体产生氧化损伤,使机体内自由基大量产生,膜脂质过氧化,从而导致细胞膜结构受损与功能衰退,降低鱼体免疫功能[21]。SOD与GSH-Px可以催化体内超氧化物自由基,从而维持氧自由基代谢平衡[22]。本研究中发现,1%和2%几丁聚糖添加组吉富罗非鱼肝脏SOD与GSH-Px活力显著高于对照组与4%水平组。1%和2%组可显著提高吉富罗非鱼肝脏抗氧化力,降低脂质过氧化反应的终产物MDA含量。
同时,由表3可见,2%添加水平组肝脏GSH水平显著高于对照组。较高的GSH水平有助于提高氧化应激时肝脏细胞的解毒作用。GSH作为一种多功能抗氧化剂,可与单线态氧、羟基自由基以及超氧阴离子起化学反应,因此其可直接作为自由基清除剂而发挥作用[23]。本实验中发现,当几丁聚糖添加水平高于2%时,肝脏GSH水平的下降可能会提高机体组织对于氧化损伤的敏感性。同时,GSH可能与GSH-Px共同参与H2O2和脂质过氧化物反应,从而降低他们的毒性。CAT也可以作为H2O2的清除剂,将H2O2还原成氧分子和水[24]。1%与2%组较高的GSH、GSH-Px与CAT活力可能与添加适当的几丁聚糖有助于促进肝脏抗氧化力提高有关。
3.3饲料中添加几丁聚糖对吉富罗非鱼幼鱼肌肉营养成分组成的影响
饲料中营养物质的吸收速率主要依赖于上皮细胞对营养成分的吸收[25]。饲料中几丁聚糖沿着鱼体胃肠道消化器官的移动可能会影响营养物质的吸收。Deuchi 等[25]研究发现,几丁聚糖能干扰大鼠肠道中脂肪消化与吸收,同时,促使饲料中脂肪通过粪便排泄出体外。本研究中,4%几丁聚糖组较低的肌肉脂肪含量可能与几丁聚糖影响饲料脂肪的吸收与利用有关。这与Shiau等[26]和王际英等[27]对奥尼罗非鱼与星斑川鲽(Platichthysstellatus)的研究结论相似。然而,本实验中采用的是微生物发酵后的小分子几丁聚糖溶液,有效成分仅为0.6%,具有较好的溶解性与吸收性,因此作用效果更明显。
3.4饲料中添加几丁聚糖对吉富罗非鱼幼鱼肌肉氨基酸组成的影响
本实验所检测的肌肉17种氨基酸中,除3%添加组肌肉中Asp、Glu与Lys含量显著高于其它各处理组外,剩余14种氨基酸在不同几丁聚糖添加水平下均无显著差异。Glu不仅是重要的鲜味氨基酸之一,而且参与脑组织生化代谢与多种生物活性物质合成[28]。本研究中,饲料中添加3%几丁聚糖可以在一定程度上提高了EAA,DAA和TAA含量。同时,由表5可见,除了对照组EAA/TAA比值在0.40外,其它各处理组比值均在0.41,高于普通蛋白的0.40正常比值,氨基酸平衡效果较优,属于人体所需的优质蛋白质。
3.5饲料中添加几丁聚糖对吉富罗非鱼幼鱼肌肉脂肪酸组成的影响
脂肪酸是加热产生香气不可缺少的物质,尤其是高含量的 PUFA 能显著地增加香味,同时可以在一定程度上反映肌肉的多汁性[29]。同一群体肌肉脂肪酸组成与饲料中营养成分、季节、水温、水体理化因子、光照等密切相关。本研究中,虽然各处理组的SFA、MUFA和PUFA没有统计学上的差异,然而SFA数值呈先下降后上升的变化,PUFA的变化与之相反。几丁聚糖对肌肉中脂肪酸组成的调控可能与肠胃消化道中脂肪的消化与吸收有关。2%与3%组较高的PUFA主要归因于肌肉中C22∶6n-3(DHA),C20∶5n-3(EPA)和C20∶4n-6(ArA)的增加。DHA与EPA在人类健康需求,疾病防控以及促进营养物质吸收上发挥着重要作用,同时,长链n-3多不饱和脂肪酸在人体内不能合成,必须通过外界食物[30]。本研究中发现,饲料中添加2%和3%几丁聚糖可能有助于促进肌肉中DHA和EPA的合成。
ArA是n-6 PUFA,参与细胞膜中磷脂组成。ArA及其代谢物在多种生物反应过程中发挥重要作用,包括骨骼肌组织修复与生长,脑发育与减少氧化损伤等[31]。2%几丁聚糖组较高的ArA有助于促进鱼体生长,增加抗氧化能力。
4结论
饲料中添加1%~2%几丁聚糖可以提高吉富罗非鱼幼鱼的血清非特异性免疫与肝脏抗氧化力;然而,添加2%~3%的几丁聚糖有助于增加肌肉中DHA、EPA和ArA含量。因此,在实际养殖生产中,建议在饲料中添加2%几丁聚糖。
参考文献:
[1]Gooday G W.Aggressive and defensive roles for chitinases[M]//Jolles P,Muzzarelli R A A.Chitin and chitinases.Basel:Birkhäuser Verlag,1999,87:157-169.
[2]Gopalakannan A.,Arul V.Immunomodulatory effects of dietary intake of chitin,chitosan and levamisole on the immune system ofCyprinuscarpioand control ofAeromonashydrophilainfection in ponds[J].Aquaculture,2006,255(1/2):179-187.
[3]王红权,赵玉蓉,余建波.壳聚糖对草鱼非特异性免疫功能的影响[J].湖南农业大学学报:自然科学版,2010,36(2):215-217.
[4]曹志华,严书林,罗静波,等.壳聚糖对异育银鲫非特异性免疫功能的影响[J].长江大学学报:自然科学版,2010,7(2):29-31.
[5]苟晨晨.创新生物农药太抗的特性及使用[J].安徽农学通报,2012,18(11):115-116.
[6]强俊,孙意岚,黄永,等.饲料中添加几丁聚糖对吉富罗非鱼幼鱼生长性能、免疫调控与抗海豚链球菌感染的影响[J].动物营养学报,2015,27(6):1769-1778.
[7]贺建华.饲料分析与检测[M]..北京:中国农业出版社,2003:19-46.
[8]Harikrishnan R.,Kim J S.,Balasundaram C.,et al.,Immunomodulatory effects of chitin and chitosan enriched diets inEpinephelusbruneusagainstVibrioalginolyticusinfection[J].Aquaculture,2012,326-329:46-52.
[9]Cha S H.,Lee J S.,Song C.B.,et al.Effects of chitosan-coated diet on improving water quality and innate immunity in the olive flounder,Paralichthysolivaceus[J].Aquaculture,2008,278(1-4):110-118.
[10]Dautremepuits C.,Paris-Palacios S.,Betoulle S.,et al.Modulation in hepatic and head kidney parameters of carp (CyprinuscarpioL) induced by copper and chitosan[J].Comp Biochem Physiol.C,2004,137(4):325-333.
[11]Grutter A S.,Pankhurst N W.The effects of capture,handling,confinement and ectoparasite load on plasma levels of cortisol,glucose and lactate in the coral reef fishHemigymnusmelapterus[J].J Fish Biol,2000,57(2):391-401.
[12]González-Santoyo I.,Córdoba-Aguilar A.Phenoloxidase:a key component of the insect immune system[J].Entomol Exp Appl,2012,142(1):1-16.
[13]Yang Y.,Bao C.,Liu A.,et al.Immune responses of prophenoloxidase in the mud crabScyllaparamamosainagainstVibrioalginolyticusinfection:in vivo and in vitro gene silencing evidence[J].Fish Shellfish Immun,2014,32(9):237-244.
[14]冯金英.几种中草药对罗非鱼免疫效果的研究[M].海南大学,2006.
[15]刘云,孙峰,王丹.免疫增强剂对鲫鱼非特异性免疫功能的影响[J].海洋科学,2004,28(9):42-44.
[16]Leatherland J F.Reflection on the thyroidology of fishes:from molecules to humankind[J].Guelph Ichthyol Rev,1994,2(1):61-67.
[17]Leatherland J F.,Farbridge K J.Chronic fasting reduces the response of the thyroid to growth hormone and TSH,and alters the growth hormone-related changes in hepatic 5′-monodeiodinase activity in rainbow trout,Oncorhynchusmykiss[J].Gen Comp Endocr,1992,87(3):342-353.
[18]Higgs D A.,Eales J G.Influence of diet composition on radiothyroxine kinetics in brook troutsalvelinusfontinalis(Mitchill)[J].Can J Zool,1979,57(4):396-402.
[19]Sweeting R M.,Eales J G.The effects of starvation and food intake on hepatic thyroxine 5′-monodeiodinase activity in rainbow trout,Oncorhynchusmykiss[J].Can J Zool,1992,70(1):1516-1525.
[20]Bres O.,Cyr D G.,Eales J G.Factor influencing the affinity and capacity of T3-binding sites in hepatic nuclei of rainbow trout,Oncorhynchusmykiss[J].J Exp Zool,1998,254(5):63-71.
[21]Abele D.,Puntarulo S.Formation of reactive species and induction of antioxidant defence systems in polar and temperate marine invertebrates and fish[J].Comp Biochem Physiol.A,2004,138(4):405-415.
[22]Monteiro D A.,de Almeida J A.,Rantin F T.Oxidative stress biomarkers in the freshwater characid fish,Bryconcephalus,exposed to organophosphorus insecticide Folisuper 600 (methyl parathion)[J].Comp Biochem Physiol.C,2006,143(2):141-149.
[23]Mate J.M.Effects of antioxidant enzymes in the molecular control of reactive oxygen species toxicology[J].Toxicology,2000,153(1-3):83-104.
[24]Speranza M.,Bagley A C.,Lynch R.E.Cellsenriched for catalasea resensitized to the toxicities of bleomycin,adriamycin,and paraquat[J].J Biol Chem,1993,268(2):19039-19043.
[25]Deuchi K.,Kanauchi O.,Imasato Y,et al.Decreasing effect of chitosan on the apparent fat digestibility by rats fed on a high-fat diet[J].Biosci,Biotech,Bioch,1994,58:1613-1616.
[26]Shiau S Y.,Yu Y P.Dietary supplementation of chitin and chitosan depresses growth in tilapia,Oreochromisniloticus×O.aureus[J].Aquaculture,1999,179(1-4):439-446.
[27]王际英,蒋锦坤,张利民,等.壳聚糖对星斑川鲽幼鱼生长、脂肪含量及抗氧化能力的影响[J].中国农学通报,2013,29(8):64-70.
[28]王镜岩,朱圣庚,徐长法,等.生物化学(第3版) [M].北京:高等教育出版社,2007.
[29]王伟,陈立侨,顾志敏,等.六个群体翘嘴红鲌肌肉生化组成的比较[J].水产学报,2007,31(9):92-99.
[30]胡燕,陈忠杰.不饱和脂肪酸与人体健康关系探讨[J].肉类研究,2011,143(1):17-20.
[31]Tian J J.,Ji H.,Oku H.,et al.Effects of dietary arachidonic acid (ARA) on lipid metabolism and health status of juvenile grass carp,Ctenopharyngodonidellus[J].Aquaculture,2014,430:57-65.
(责任编辑:邓薇)
Effects of chitosan-enriched diet on hepatic antioxidant capacity,serum hormone and muscle nutrition in GIFT tilapia Oreochromis niloticus
QIANG Jun1,SUN Yi-lan1,HUANG Yong2,XU Pao1,YANG Hong1,YUAN Qin-hua2,
HE Jie1,ZHU Zhi-xiang1,SU Tian-pin3
(1.FreshwaterFisheriesResearchCenterofChineseAcademyofFisherySciences,Wuxi214081,Jiangsu,China;2.WuxiJidingBiologicalNew-typeMaterialTechnologyDevelopmentCo.,Ltd.,Wuxi214026,Jiangsu,China;3.JiangsuDerenBiologicalTechnologyDevelopmentCo.,Ltd.,Jintan213200,Jiangsu,China)
Abstract:The present study was performed to investigate the effects of dietary chitosan on hepatic antioxidant capacity,serum biochemistry and muscle quality of GIFT tilapia (Oreochromis niloticus) juveniles.375 health juveniles with an average body weight of 2.97±0.02 g were randomly divided into 5 groups with 3 replicates in each group and 25 fish in each replicate.Fish were fed with the control diet and four different experiment diets containing four levels of chitosan (1%,2%,3% and 4%).The active ingredients of chitosan was 0.6% in our study.After 9-week feeding trial,hepatic antioxidant capacity,the levels of biochemistry and hormone in serum and composition of nutrients,amino acids and fatty acids in muscle were determined.The results showed that chitosan could inprove serum C3,T3 and Po levels,and reduce Lac and T4 levels in the fish fed with 1% and 2% chitosan.Moreover,the antioxidant responses in 1% and 2% chitosan groups were characterized by higher GSH and higher antioxidant enzyme activities (SOD,CAT,GSH-Px) and lower oxidative stress levels (MDA) in liver compared to levels found in other groups (P<0.05).There was no significant difference in the contents of moisture,ash and crude protein among 5 treatment groups (P>0.05).However,crude lipid content of treatments decreased significantly with the increase of dietary chitosan level (P<0.05).There were no significant differences among 5 treatment groups for the contents of amino acids and fatty acids in muscle,but the contents of EAA,DAA and TAA,PUFA in 2% and 3% chitosan groups were slightly higher than the other groups.
Key words:GIFT tilapia(Oreochromis niloticus);chitosan;antioxidant capacity;serum hormone level;muscle nutritional components
中图分类号:S963.73
文献标识码:A
文章编号:1000-6907-(2016)02-0066-08
作者简介:第一强俊(1984-),男,安徽合肥人,助理研究员,博士研究生,研究方向鱼类遗传繁殖和健康养殖。E-mail:qiangjunn@163.com.同等贡献第一作者:孙意岚(1989-),女,江苏无锡人,本科,研究方向渔业经济。E-mail:sunyl@ffrc.cn通讯作者:徐跑。E-mail:Xup@ffrc.cn
收稿日期:2015-03-19;
修订日期:2015-10-20
资助项目:“十二五”国家科技支撑计划(2012BAD26B03-1);现代农业产业技术体系专项资金(CARS-49)
