高血压脑出血血肿周围C反应蛋白变化与凋亡细胞的关系
2016-04-22常海刚王雅潇马鹏举周文科金保哲通讯作者
常海刚 王雅潇 马鹏举 周 祥 惠 磊 徐 翀 周文科 金保哲(通讯作者)
新乡医学院第一附属医院 卫辉 453100
高血压脑出血血肿周围C反应蛋白变化与凋亡细胞的关系
常海刚王雅潇马鹏举周祥惠磊徐翀周文科金保哲(通讯作者)
新乡医学院第一附属医院卫辉453100
【摘要】目的探讨高血压脑出血患者血肿周围C反应蛋白表达及与细胞凋亡的关系。方法选取20例高血压脑出血患者血肿灶周围脑组织标本为实验组,5例手术通道血肿远隔部位脑组织标本为对照组。根据脑出血量大小实验组标本分为3组A(出血量35~45 mL)、B(出血量45~70 mL)、C(出血量≥70 mL)组。所有标本均行TUNEL染色、C反应蛋白免疫组化染色。对资料进行统计学相关分析。结果实验组血肿周围脑组织都有不同程度TUNEL阳性凋亡细胞和C反应蛋白阳性细胞;越远离血肿周围,对照组TUNEL阳性细胞和C反应蛋白阳性细胞表达减少,同时血肿量较大者,血肿周围TUNEL阳性细胞和C反应蛋白表达更为显著。结论脑出血血肿周围脑组织大量表达C反应蛋白,TUNEL阳性凋亡细胞亦较明显,而血肿远隔部位CRP不表达或仅少量表达,TUNEL阳性细胞表达亦减少,CRP可能直接参与脑出血血肿周围脑组织细胞凋亡过程。
【关键词】C反应蛋白;脑出血;细胞凋亡
脑出血是神经科常见病、多发病,是一种最具破坏性的脑血管病,占所有脑卒中的15%,其发病率、致残率、复发率及病死率均较高[1],且预后极差[2-3]。近年来,随着脑血管病患者数的不断上升,脑血管病已成为威胁人类健康的首发疾病,脑血管病变的诊治日益受到重视。研究表明,脑出血后出血部位和周围组织存在炎性反应,是脑出血后继发性脑损害病理生理的重要环节[4-5]。C反应蛋白(CRP)为一种反映各种急慢性炎症的时相蛋白[6],正常情况存在于血清或血浆中,机体在急性炎症或创伤时,体内炎性反应系统被激活,CRP水平显著升高[7-8]。研究证实CRP是与动脉粥样硬化的发生、演变进展有关的促炎因子[9],可预测未来心脑血管事件的发生。它在冠心病、脑梗死、周围血管栓塞等疾病诊断和预测中发挥越来越重要的作用,甚至被认为是心、脑血管病危险评估的金标准[10]。大量研究也证实,在自发性脑出血患者中,血清CRP增高并和患者预后有密切相关性,以往研究主要集中在全身及血清中CRP的表达,而对脑组织中CRP参与病理生理直接证据较少,尤其对自发性脑出血血肿周围的CRP表达及与细胞凋亡关系等研究更少。本文旨在研究高血压脑出血血肿周围CRP表达及其与细胞凋亡关系。
1资料与方法
1.1一般资料研究对象为新乡医学院第一附属医院收治手术患者20例,男12例,女8例,年龄38~65岁,平均50岁。家属签署知情同意书。
1.2诊断标准符合1995年第4届脑血管会议修订的脑出血诊断标准。排除标准:发病前4周内出现潜在的感染、创伤、手术史、放化疗及抗炎药物治疗史;糖尿病、肝肾疾病、肺结核、慢性阻塞性肺疾病、心功能衰竭、自身免疫性疾病。所有患者行CT检查,测量血肿量,出血量计算采用多田方法T=π/6×a×b×c,a为血肿最大层面最大直径(cm),b为血肿最大层面与a垂直的直径,c为血肿出现的层数。实验组按血肿量分为3组,A组:出血量35~45 mL;B组:出血量45~70 mL;C组:出血量≥70 mL;
1.3标本采集临床病例脑组织标本在手术中经皮层“造瘘"清除血肿时,将手术入路通道中邻近血肿约0.5 cm范围内的脑组织保存下来,作为病例组标本。将部分超早期手术组患者皮层“造瘘”起始处,即远隔血肿部位脑组织保留下来,作为对照组标本。标本立即放入4%多聚甲醛固定溶液固定,遂行石腊包埋、切片。
石蜡切片:组织脱水、渗透与包埋:①脱水:70%乙醇(60 min)→85%乙醇(60 min)→95%乙醇(60 min)→100%乙醇(60 min)→100%乙醇(60 min)。②透明:二甲苯Ⅰ(30 min)→二甲苯Ⅱ(30 min)。③渗透:石蜡Ⅰ(60 min)→石蜡Ⅱ(60 min),62 ℃烘箱中。④包埋:将组织放入盛有石蜡的模具中,摆好位置,于石蜡包埋机的冷台上冷却。
切片和贴片:将包埋好的组织块于切片机中约5 μm,放于漂片机中展开,再将切片捞于多聚赖氨酸附膜载玻片上,编号,70 ℃干烤1 h,贴片后60 ℃烤5 h。
1.4C反应蛋白免疫组化方法检测步骤(1)热修复:将载玻片放入容器中,加10 mM的枸橼酸钠缓冲液,pH 6.0;(2)标本用正常封闭血清封闭,PBS冲洗3次,每次5 min。(3)与一抗孵育60 min。(4)与荧光标记的二抗一起温浴45 min(用于免疫组化的二抗)。(5)用液态封固剂或90%甘油PBS液封片。(6)用适当的滤镜在荧光显微镜下阅片。阴性对照:每组各抽取切片2张用抗体稀释液代替一抗,其余步骤同上。
1.5脑组织细胞凋亡检测方法操作流程图:制作石蜡切片→脱蜡、水合→细胞通透→加TUNEL反应液→加converter-POD→与底物DAB反应显色→光学显微镜计数并拍照。
具体操作步骤:(1)用二甲苯浸洗2次,每次5 min;(2)用梯度乙醇(100%、95%、90%、80%、70%)各浸洗1次,每次3 min;(3)PBS漂洗2次;(4)用Proteinase K工作液处理组织15~30 min在21~37 ℃(温度、时间、浓度均需摸索)或加细胞通透液8 min;(5)PBS漂洗2次;(6)制备TUNEL反应混合液,处理组用50 μL TdT+450 μL荧光素标记的dUTP液混匀;而阴性对照组仅加50 μL荧光素标记的dUTP液,阳性对照组先加入100 μL DNase 1,反应在15~25 ℃下10 min,后面步骤同处理组。(7)玻片干后,加50 μL TUNEL反应混合液(阴性对照组仅加50 μL荧光素标记的dUTP液)于标本上,加盖玻片或封口膜在暗湿盒中反应37 ℃×1 h。(8)PBS漂洗3次;(9)可以加1滴PBS在荧光显微镜下计数凋亡细胞(激发光波长为450~500 nm,检测波长为515~565 nm);(10)玻片干后加50 μL converter-POD于标本上,加盖玻片或封口膜在暗湿盒中反应37 ℃×30 min。(11)PBS漂洗3次;(12)在组织处加50~100 μL DAB底物,反应15~25 ℃×10 min;(13)PBS漂洗3次;(14)拍照后再用苏木素或甲基绿复染,几秒后立即用自来水冲洗。梯度酒精脱水、二甲苯透明、中性树胶封片。(15)加一滴PBS或甘油在视野下,用光学显微镜观察凋亡细胞(共200~500个细胞)并拍照。可结合凋亡细胞形态特征综合判断(未染色细胞变小,胞膜完整但出现发泡现象,晚期出现凋亡小体,贴壁细胞出现邹缩、变圆、脱落;而染色细胞呈现染色质浓缩、边缘化,核膜裂解,染色质分割成块状/凋亡小体)。
1.6统计学处理选用统计学软件SPSS 19.0对数据进行分析和处理,计量资料以均数±标准差表示,采用t检验,计数资料以百分率表示,采用χ2检验,双变量相关分析采用计算相关系数,查r界值表确定P值。P<0.05为差异有统计学意义。
2结果
2.1细胞凋亡情况见图1。脑出血后6 h经TUNEL检测对照组偶见或未见凋亡细胞;而实验组血肿周围有凋亡细胞明显高于对照组,出血量最大组明显高于出血量较小组,不同出血量组TUNEL阳性细胞差异有统计学意义(F=439.573,P<0.01)。
2.2血肿周围C反应蛋白表达情况见图2。对照组各视野间有少量C反应蛋白阳性细胞;血肿量愈大,血肿周围C表达愈显著;且血肿周围CRP表达明显,远离血肿脑组织表达降低,各组间差异有统计学意义(F=327.99,P<0.01)。
2.3CRP蛋白表达与凋亡的关系对CRP阳性细胞计数和凋亡阳性细胞计数进行相关性分析,结果表明二者有相关性(r=0.99,P<0.01)。见表1。

表1 不同组别TUNEL阳性细胞
注:不同出血量组阳性细胞比较,P<0.01
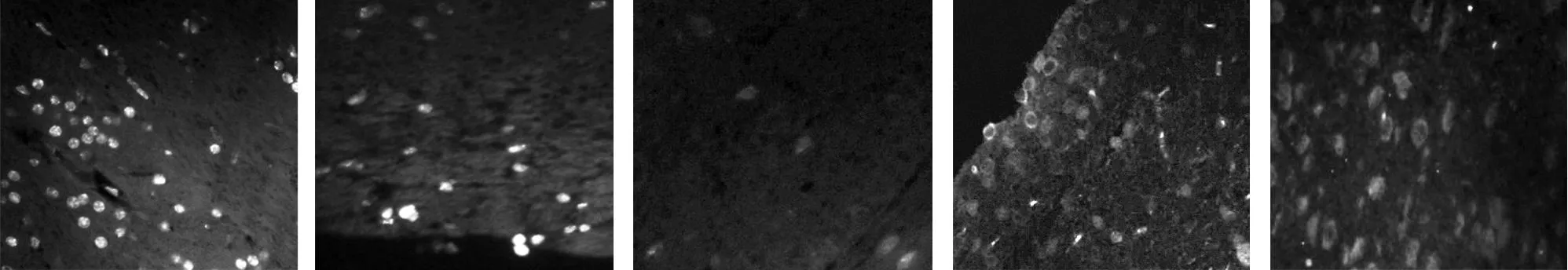
a b c a b图1 a:出血量≥70 mL组血肿周围TUNEL阳性细胞表达情况,可见凋亡细胞数较多,左侧靠近血肿侧,距离血肿侧愈远阳性细胞表达愈少 b:出血量30~45 mL组TUNEL阳性细胞表达情况,可见凋亡细胞数较前组有减少,下侧靠近血肿侧 c:对照组TUNEL阳性细胞表达情况 图2 a:出血量30~45 mL组血肿周围C反应蛋白表达情况,可见少量C反应蛋白阳性细胞,右侧靠近血肿侧 b:出血量≥70 mL组血肿周围C反应蛋白表达情况,可见大量C反应蛋白阳性细胞,右侧靠近血肿侧,可见距离血肿愈远,阳性细胞表达愈少
3讨论
高血压脑出血发病率、致残率、致死率、复发率高,无论国内或国外,仍缺乏特别有效的改善预后的治疗方法,带来沉重的社会经济负担。而探讨脑出血的病理生理机制,从而寻求有效的治疗方案成为目前研究的热点。近年来,研究脑出血的病理生理机制主要包括:出血血肿压迫周围脑组织及继发性缺血[11],血肿及分解残物毒性作用[12-13],炎症反应[14-15]等,而关于脑出血血肿周围的炎症反应研究越来越多。CRP是炎症、感染、组织损伤、坏死和恶性肿瘤的一个重要标志。研究认为,超敏CRP>3 mg/L时,心、脑血管事件的发生危险较高,其在冠心病、脑梗死、周围血管栓塞等疾病诊断和预测中发挥越来越重要的作用,甚至被认为是心、脑血管病危险评估的金标准。而CRP同样可以预测脑出血患者的预后,与脑出血患者的致残率及病死率密切相关,并以此为治疗脑出血提供新的策略。以往对脑出血后血清CRP的研究较多,主要集中在血清CRP的检测及变化过程,从而研究血清CRP表达与疾病发生发展及预后的关系。以往研究证实血清CRP主要有肝脏释放分泌,且在炎症介质尤其IL-6介导下表达增多,脑出血后血清CRP明显升高主要在发病后24 h左右,在超早期6 h内甚至在正常范围内,而以往对脑出血后血肿周围CRP的研究极少。CRP仅是脑出血后的全身应激反应,还是直接参与脑出血的病理生理机制需进一步研究。本研究发现,脑出血血肿周围脑组织大量表达CRP,且血肿量愈大,CRP表达愈显著;CRP表达与凋亡细胞表达有相关性,提示CRP可能参与脑出血后血肿周围脑细胞凋亡过程;在脑出血超早期,血肿周围已有CRP大量表达,推测除肝脏可以释放CRP外,神经元或胶质细胞亦能分泌CRP,这在以往研究中鲜有报道。脑出血不仅引起脑组织局部炎症反应,也会导致全身炎症反应应激。脑出血致损伤脑组织释放大量炎症介质,如IL-6。IL-6可诱导肝脏产生急性反应蛋白,主要是血清CRP的升高较为明显。而本研究发现,脑出血血肿周围有大量CRP表达,且远离血肿,其表达减少。由此认为,脑出血后血清CRP表达增加,主要有肝脏产生释放于循环系统中,血清CRP参与全身系统器官损伤过程,同时血肿周围大量表达CRP,据此推测血肿周围脑组织神经元或胶质细胞可能表达分泌CRP,这与Di Napoli等[16]的研究结果一致,并且血肿周围局部CRP参与脑损伤过程,如细胞凋亡过程、水肿反应、血脑屏障破坏等继发损伤。以往研究证实,CRP通过一些信号途径介导内皮细胞凋亡,导致局部血流障碍,从而形成类似脑梗死半暗带的低血流量区域[17],且最近研究[18]也显示CRP通过直接诱导P53介导凋亡,本研究发现血肿周围脑组织高表达CRP区域凋亡细胞亦较丰富,提示CRP可能通过阻断血管内皮细胞增殖导致脑组织缺血而能量匮乏或直接通过P53基因参与出血后血肿周围细胞的凋亡过程,甚至加重血肿周围胶质细胞炎症反应参与脑出血的病理生理机制,由此阻断CRP或成为治疗脑出血的新策略,为下一步研究提供思路。
4参考文献
[1]Sacco S,Marini C,Toni D,et al.Incidence and 10-year survival of intracerebral hemorrhage in a population-based registry[J].Stroke,2009,40(2):394-399.
[2]van Asch CJ,Luitse MJ,Rinkel GJ,et al.Incidence,case fatality,and functional outcome of intracerebral haemorrhage over time,according to age,sex,and ethnic origin: a systematic review and meta-analysis[J]. Lancet Neurol,2010,9(2):167-176.
[3]Kleindorfer DO,Khoury J,Moomaw CJ,et al.Stroke incidence is decreasing in whites but not in blacks: a population-based estimate of temporal trends in stroke incidence from the Greater Cincinnati/Northern Kentucky Stroke Study[J]. Stroke,2010,41(7):1 326-1 331.
[4]Aronowski J,Zhao X.Molecular pathophysiology of cerebral hemorrhage: secondary brain injury[J]. Stroke,2011,42(6):1 781-1 786.
[5]Wang J.Preclinical and clinical research on inflammation after intracerebral hemorrhage[J]. Prog Neurobiol,2010,92(4):463-477.
[6]Pope CA.Particulate air pollution,C-reactive protein,and cardiac risk[J]. Eur Heart J,2001,22(4):1 149-1 150.
[7]Gabay C,Kushner I.Acute-phase proteins and other systemic responses to inflammation[J]. N Engl J Med,1999,340(6):448-454.
[8]Szalaic AJ,Agrawal A,Greenhough TJ,et al.C-reactive protein: structural biology and host defense function[J]. Clin Chem Lab Med,1999,37(3):265-270.
[9]Libby P.Inflammation in atherosclerosis[J]. Nature,2002,420(6917):868-874.
[10]Ridker PM.Clinical application of C-reactive protein for cardiovascular disease detection and prevention[J]. Circulation,2003,107(3):363-369.
[11]Mun-Bryce S,Wilkerson AC,Papuashvili N,et al.Recurring episodes of spreading depression are spontaneously elicited by an intracerebral hemorrhage in the swine[J]. Brain Res,2001,888(2):248-255.
[12]Wagner KR,Sharp FR,Ardizzone TD,et al.Heme and iron metabolism: Role in cerebral hemorrhage[J]. J Cereb Blood Flow Metab,2003,23(6):629-652.
[13]Xi G,Keep RF,Hoff JT.Mechanisms of brain injury after intracerebral haemorrhage[J]. Lancet Neurol,2006,5(1):53-63.
[14]Zhao X,Sun G,Zhang J,et al.Hematoma resolution as a target for intracerebral hemorrhage treatment: Role for peroxisome proliferator-activated receptor gamma in microglia/macrophages[J]. Ann Neurol,2007,61(4):352-362.
[15]Wang J,Dore S.Inflammation after intracerebral hemorrhage[J].J Cereb Blood Flow Metab,2007,27(5):894-908.
[16]Di Napoli M,Godoy DA,Campi V,et al.C-reactive protein in intracerebral hemorrhage: time course,tissue localization,and prognosis[J]. Neurology,2012,79(7):690-699.
[17]Winbeck K,Poppert H,Etgen T,et al.Prognostic relevance of early serial C-reactive protein measurements after first ischemic stroke [J].Stroke,2002,33(10):2 439.
[18]Choi JW,Lee KH,Kim SH,et al.C-reactive protein induces p53-mediated cell cycle arrest in H9c2 cardiac myocytes[J]. Biochem Biophys Res Commun,2011,410(3):525-530.
(收稿2015-08-13)
【中图分类号】R743.34
【文献标识码】A
【文章编号】1673-5110(2016)06-0033-03
