设施番茄连作障碍与土壤芽孢杆菌和假单胞菌及微生物群落的关系分析
2016-04-21葛晓颖孙志刚欧阳竹
葛晓颖,孙志刚,李 涛,欧阳竹*
(1.中国科学院地理科学与资源研究所/中国科学院生态系统网络观测与模拟重点实验室/中国科学院禹城试验站,北京100101;2.中国科学院大学,北京100049)
设施番茄连作障碍与土壤芽孢杆菌和假单胞菌及微生物群落的关系分析
葛晓颖1,2,孙志刚1,李涛1,2,欧阳竹1*
(1.中国科学院地理科学与资源研究所/中国科学院生态系统网络观测与模拟重点实验室/中国科学院禹城试验站,北京100101;2.中国科学院大学,北京100049)
摘要:以山东寿光及禹城地区不同连作年限(1~21年)的54个设施番茄土壤为研究对象,研究芽孢杆菌(Bacillus spp.)和假单胞菌(Pseudomonas spp.)及土壤微生物群落随连作年限的变化及其与土壤养分的关系,进而分析土壤中芽孢杆菌和假单胞菌与连作障碍之间的关系。结果表明:土壤细菌随着连作年限的持续增加而逐渐减少,连作年限少于6~10年时芽孢杆菌和假单胞菌的数量为增加趋势,连作6~10年后表现为减少趋势;PCR-DGGE(变性浓度梯度凝胶电泳)结果显示,作为土壤优势种群的芽孢杆菌及假单胞菌也在连作4~5年后减少,均与连作障碍发生(集中于5~10年)的时间基本吻合。土壤微生物生物量氮、碳随着连作年限呈增加趋势,符合指数增长模型(R2分别为0.30及0.20,P<0.001)。由于设施番茄土壤肥料投入量大,土壤有机碳、C/N随着连作年限的增加而增加,呈显著正相关关系;土壤细菌数量与土壤C/N呈极显著负相关关系。通过对设施连作番茄土壤分析可知,连作番茄土壤中土壤细菌数量随连作年限呈减少趋势,芽孢杆菌及假单胞菌数量随着连作年限的变化与土壤连作障碍出现的时间基本吻合,可能是导致连作土壤微生物群落发生变化的原因。
关键词:设施番茄;连作障碍;微生物群落;芽孢杆菌;假单胞菌
葛晓颖,孙志刚,李涛,等.设施番茄连作障碍与土壤芽孢杆菌和假单胞菌及微生物群落的关系分析[J].农业环境科学学报, 2016, 35(2):514-523.
GE Xiao-ying, SUN Zhi-gang, LI Tao, et al. Soil Pseudomonas spp., Bacillus spp., and microbial communities under tomato continuous cropping in greenhouse production[J]. Journal of Agro-Environment Science, 2016, 35(2): 514-523.
2012年我国番茄(Lycopersicum esculentum Mill.)栽培面积达到100万hm2[1],是最重要的棚室蔬菜之一。设施番茄经济效益高、农民增收效果明显、单位面积产值远超过大田粮食和露地蔬菜作物。连作是目前我国设施番茄栽培的主要方式,长期连续种植同一种蔬菜作物,将导致连作土壤中有害微生物逐渐富集,土传病害频繁发生。目前,研究者将连作障碍归因于土壤微生物群落的变化[2]。土壤微生物在土壤养分循环及土壤-作物生长体系中均发挥重要作用,土壤微生物总量、活性和有益微生物数量是评价土壤活性高低的重要指标[3]。在健康的土壤生态系统中,有益微生物的种类和数量远大于有害微生物,而同一种作物长期连作导致土壤微生物和植物之间相互选择,使得某些特定微生物富集,病原菌数量增加,而有益细菌种类和数量减少[4]。长期连作的土壤微生物特性主要表现为多样性下降;细菌数量下降、真菌数量上升;病原微生物数量上升、有益微生物数量下降等[5]。
植物促生菌即PGPR是指自由生活在土壤、根际、根表以及叶际,在一定条件下有利于植物生长的细菌[6]。相对于价格昂贵、高生产值、高环境风险的化学肥料来说,PGPR作为潜在的土壤微生物资源,对于发展可持续型及环境友好型农业有非常重要的意义。土壤假单胞菌(Pseudomonas spp.)及芽孢杆菌(Bacillus spp.)含众多植物促生菌(PGPR),是重要的土壤细菌。多种假单胞菌及芽孢杆菌接种到作物中可以促进作物生长[7]、减少作物病虫害[8]。而长期连作导致土壤假单胞菌多样性耗竭[9],芽孢杆菌数量减少[5]。茄科劳尔氏菌(Ralstonia solanacearum)引起的番茄青枯病是设施番茄中最常见的土传细菌病害,国内外众多研究表明,设施番茄连作障碍与致病型茄科劳尔氏菌有关,芽孢杆菌及假单胞菌类PGPR对劳尔氏菌有很好的抑制效果[10]。
目前针对芽孢杆菌及假单胞菌的研究可归结于两个方面:一方面验证某一或某些菌株的PGPR特性,以期得到能够在多种作物或土壤中发挥作用的菌种资源;另一方面则是研究PGPR类芽孢杆菌及假单胞菌在不同作物或土壤类型中发挥作用的机理。本研究则首次尝试将芽孢杆菌及假单胞菌当作一类土壤微生物,研究其在土壤微生物群落中发挥的作用及其与连作障碍的关系。因此,本研究选择山东寿光及禹城地区集约化蔬菜产区的不同连作年限设施番茄土壤(1~21年),对其中芽孢杆菌及假单胞菌的数量以及土壤微生物群落、土壤碳氮进行分析,探讨土壤中芽孢杆菌及假单胞菌随着连作年限的变化与土壤连作障碍之间的关系,以期为解决我国蔬菜连作障碍问题提供理论依据。
1 材料与方法
1.1研究区域及样本采集
本研究以我国最大的蔬菜生产基地——山东省寿光市蔬菜生产基地以及位于山东省北部的禹城蔬菜生产区不同连作年限番茄大棚土壤为研究对象。寿光(118°32'~119°10'E,36°41'~37°19'N)有我国最大的设施蔬菜生产基地,其耕地面积的65%用于设施蔬菜生产[15]。寿光处于中纬度带,属暖温带季风大陆性气候,年平均气温12.7℃,历年平均降水量593.8 mm。土壤类型、无霜期及其他信息见Ruan等[8]。禹城地处山东西北部(116°22'~116°45'E,36°41'~37°12'N),同属暖温带季风大陆性气候,年均温度为13.1℃,年均降水量593.2 mm,其他信息包括土壤类型、无霜期等见Chen等[11]。
样品采集于2012年11月,选择栽培措施和管理方法相近、不同连作年限的设施番茄大棚54个,在采样的同时调查施肥量及产量,如表1所示。每个大棚取0~20 cm根层土壤,采用“之”字型取样,每棚取7钻,充分混匀,取新鲜土壤测定微生物生物量C、N。然后将土样分为两份,其中一份过0.5 mm孔径的筛子并放入4℃冰箱保存,供常规土壤理化指标测定,包括土壤pH、有机质、全氮、有效磷及速效钾等;另一份存于超低温冰箱中(温度-80℃),供测定土壤中细菌、芽孢杆菌、假单胞菌的数量和土壤微生物群落结构等微生物指标。
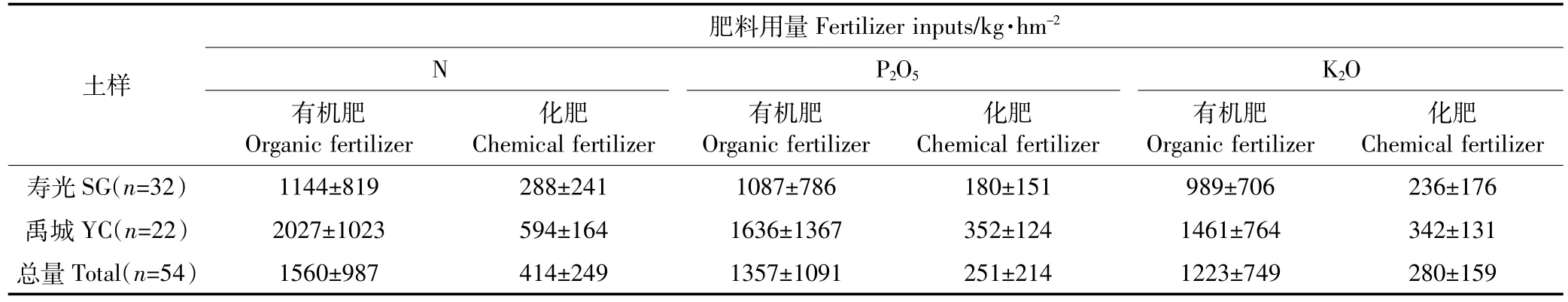
表1 土壤样本量及相应氮磷钾施肥量调查Table 1 Annual nitrogen,phosphorus,and potassium fertilizer inputs in soils of greenhouse tomato under continuous operation for a wide range of years in Shouguang(SG)and Yucheng(YC)Counties
1.2土壤化学性质测定
土壤pH测定使用1:2.5的土水比;土壤有机质(SOM)使用重铬酸钾氧化法[12];土壤全氮(TN)使用凯氏定氮法;土壤有效磷(AP)和速效钾(AK)分别用Olsen磷法和火焰分光光度计法(FP6410,上海仪电分析仪器有限分司)测定,参考中国农业出版社出版的《土壤农化分析》[13]方法进行。
1.3土壤微生物生物量碳和生物量氮
采用氯仿熏蒸浸提方法测定微生物生物量碳(MBC)、氮(MBN)[14]。称取相当于20.0 g干土重的新鲜土壤放入培养皿中,将其置于真空干燥器中(底部含有少量NaOH和去乙醇氯仿),抽真空后保持氯仿沸腾3~5 min,然后将干燥器转移到黑暗条件下于25℃熏蒸24 h,将熏蒸好的土壤全部转移到250 mL三角瓶中,加入约100 mL 0.5 mol·L-1K2SO4提取液(土水比为1:5),振荡30 min后过滤。溶液中的有机碳(TOC)和总氮用自动TOC分析仪(Vario TOC,Elementar lnc.)测定。同时,未熏蒸空白和试剂空白也用以上同样的方法处理,每份土壤重复3次。MBC和MBN采用Tian等[15]的方法计算。
1.4土壤DNA提取
土壤DNA提取使用MOBIO土壤DNA提取试剂盒进行(MOBIO Laboratories,lnc. CA,USA)。提取出的DNA用微量紫外分光光度计(UV-2550,日本岛津)进行浓度及纯度检测。检测后的DNA存放于-20℃冰箱中以备qPCR(荧光定量PCR)及PCR-DGGE(变性浓度梯度凝胶电泳)分析使用。
1.5qPCR分析
1.5.1标准菌株与培养基
本研究用qPCR方法定量土壤中的细菌、芽孢杆菌及假单胞菌。标准株分别是大肠杆菌、枯草芽孢杆菌和荧光假单胞菌,其中枯草芽孢杆菌和荧光假单胞菌来自中国微生物菌种保存中心(CGMCC)。将标准株接种于NA培养基(葡萄糖10 g,蛋白胨5 g,酵母膏0.5 g,牛肉浸膏3 g,加水至1 L,调pH至7.0)上,于35℃培养箱中培养24 h进行活化。
1.5.2标准曲线绘制
用于定量土壤总细菌、芽孢杆菌及假单胞菌的特异性引物如表2所示。引物的专一性对定量结果起决定性作用,因此试验前需验证所选择的引物专一性。方法如下:应用枯草芽孢杆菌的DNA及芽孢杆菌属的定量引物(Bac F及Bac R)进行PCR扩增反应,得到的PCR产物为500 bp,而以水为对照或以荧光假单胞菌的DNA与芽孢杆菌属的定量引物反应,在500 bp处无扩增产物,证明芽孢杆菌的引物是专一性的。用同样的方法测定土壤细菌及假单胞菌的引物也为专一性引物,可以在qPCR反应中用于定量土壤中的细菌和假单胞菌。
土壤细菌、芽孢杆菌、假单胞菌采用Invitrogen公司的实时荧光PCR试剂盒SYBR Green qRT-PCR kit with ROX在ABI7500TM进行实时荧光定量PCR检测。将经过浓度和纯度检测的阳性质粒依次稀释,1.0×100~1.0×10-7,每个梯度3次重复,最后选取扩增效率高的5~6个梯度用于标准曲线的绘制。阴性对照以无菌超纯水代替。每个样品重复3次。各反应的退火温度及扩增产物片段见表2。
1.6PCR-DGGE
选择寿光地区栽培模式、管理方法相近的不同连作年限番茄土壤进行PCR-DGGE分析。PCR扩增引物是16S rDNA的V3区通用引物,分别是338F 5'-ACTCCTACGGGAGGCAGCAG-3'和534R 5'-CGCC CGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGG (ATTACCGCGGCT GCTGG)-3'[19]。PCR反应条件:94 ℃10 min;94℃变性1 min,55℃退火1.5 min(每个循环降低0.1℃),72℃延伸1.5 min此过程进行30个循环;最终72℃延伸10 min。

表2 实时荧光定量土壤总细菌、芽孢杆菌及假单胞菌的引物Table 2 Primers for total bacteria,Bacillus spp. and Pseudomonas spp.
DGGE电泳条件:采用的胶浓度为8%,变性范围为30%~60%,电泳条件为150 V、420 min。在含0.5 μg·mL-1EB的1×TAE缓冲液中染色15 min,取出后用凝胶成像系统(Alpha Innotech Corporation,San Leandro,CA,USA)进行拍照。测序时将回收的产物片段重新扩增,引物及循环反应条件与PCR反应的引物序列及反应条件相同,产物用PCR产物纯化试剂盒纯化(天根生物科技有限公司,中国)。测序过程由宝杰罗生物科技有限公司(北京)完成。
1.7数据处理与分析
本研究根据文献资料中连作障碍发生的时间进行归纳(下文表5),将不同连作年限的土壤按照连作番茄的年限划分为4个范围:≤3年(CCY3,新建大棚),4~5年(CCY5,开始出现连作障碍的时间),6~10年(CCY10,连作障碍集中发生的时间),>10年(CCY10+,老龄棚,包括连作11~21年的土壤)。土壤理化性质、肥料用量以及产量均以平均值±标准差(sd)的形式表示。不同处理间的差异显著性检验采用单因素ANOVA,LSD检验,P<0.05为差异显著。在指数模型、线性模型、二次方程式模型、对数模型及多项式模型等趋势线模型中,通过比较R2以及P值选择最为合适的趋势线模型。不同变量之间的相关性通过Spearman(2-tailed)分析得出。
所有数据分析均通过SPSS12.0完成,在数据处理过程中剔除部分异常值(例如MBN测定值为负数的2个样品)。为了研究土壤中细菌、芽孢杆菌及假单胞菌数量的变化规律,qPCR测定土壤DNA样品时,将检测不到数值或个别严重偏离整体平均值的样品剔除。
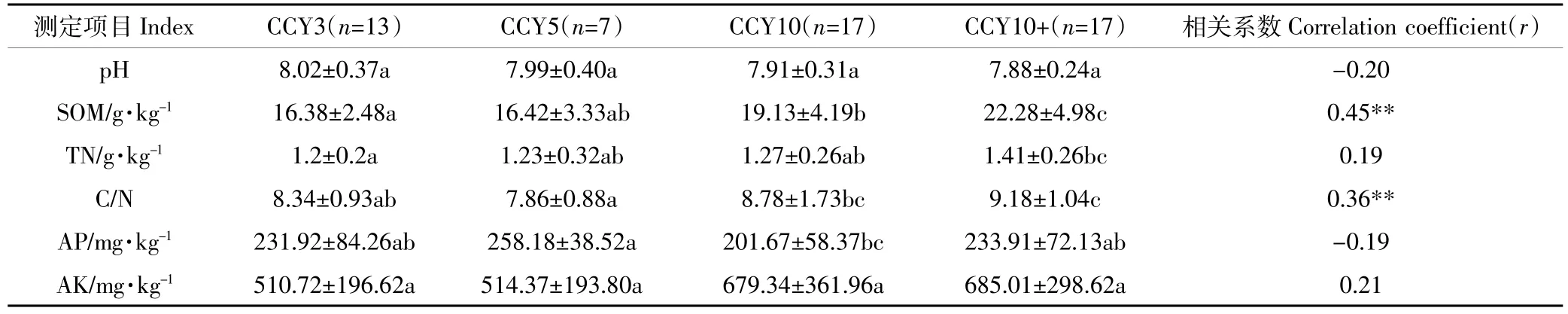
表3 不同连作年限设施番茄土壤理化性质Table 3 Chemical properties of soils in tomato continuous cropping in greenhouses for a wide range of years
2 结果与分析
2.1土壤养分的变化
不同连作年限番茄土壤的pH、有机质、全氮、碳氮比、有效磷及速效钾如表3所示。土壤pH随连作年限呈下降趋势,但差异并不显著。土壤有机质随连作年限呈上升趋势,CCY5与CCY3相比,有机质的变化差异并不显著,而CCY10、CCY10+与CCY3及CCY5相比显著增加了土壤有机质的含量,分别比CCY3增加了16%、36%。CCY10+土壤中全氮显著高于其他连作年限,比CCY3增加22%。CCY10+土壤中C/N相比CCY3增加了10%。土壤有效磷及速效钾在不同连作年限土壤中的变化无显著性差异。
不同土壤化学性质与连作年限间(1~21年)的相关关系分析表明,土壤有机质及C/N与土壤连作年限呈显著相关(P<0.01),但其他土壤养分含量与土壤连作年限之间无显著相关关系。
2.2土壤微生物生物量碳、氮的变化
不同连作年限土壤样品的微生物生物量碳、氮的变化如图1所示。微生物生物量碳氮随不同连作年限表现出相似的变化规律,在连作初期即0~3年内,微生物生物量碳、氮均较低,在连作4~10年期间均处于快速增长的阶段,而连作10年以上则增长趋于平缓。土壤MBN值介于20.9~93.8 mg·kg-1之间(平均值为57.3 mg·kg-1),MBC值介于87.9~263.1 mg·kg-1之间(平均值为178.7 mg·kg-1)。土壤微生物生物量碳、氮与连作年限之间符合对数模型:MBN与连作年限R2= 0.30,n=52(其中2个样品的测定值为负数,判断为异常值,已舍去),P<0.001;MBC与连作年限R2=0.20,n=54,P<0.001。CCY10+土壤中MBN含量比CCY3土壤增加21.6 mg·kg-1(50.2%),MBC含量比CCY3土壤增加37.2 mg·kg-1(22.8%)。
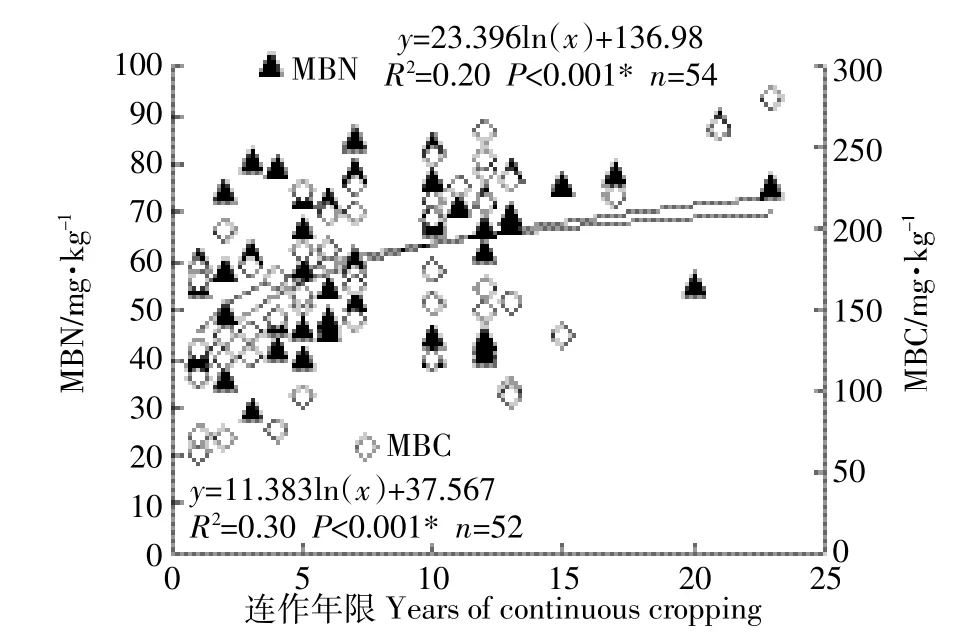
图1 不同连作年限土壤微生物生物量碳、氮含量Figure 1 Soil microbial biomass-C and N over years of tomato continuous cropping in greenhouse
2.3细菌、芽孢杆菌及假单胞菌的数量
由标准菌株及本研究所选择的定量引物得到标准曲线循环数(Ct)与各反应体系测定的基因拷贝数(Copy number)均有很好的线性关系(土壤细菌、芽孢杆菌及假单胞菌的R2分别是0.996、0.992及0.999),标准曲线如图2所示。土壤细菌总量随着番茄连作年限的增加而下降(图3),符合对数模型(R2=0.18,n= 42,P=0.02),细菌数量从CCY3土壤中的6.9×106个下降为CCY10+土壤中的4.9×106个(下降29.3%)。连作年限小于6年时,芽孢杆菌、假单胞菌数量随着连作年限不断增加;连作年限大于10年时,随着连作年限的增加而减少;总体呈现先增加后降低的趋势(图3)。整体变化趋势符合多项式模型:芽孢杆菌为R2= 0.12,n=44,P=0.08;假单胞菌为R2=0.20,n=42,P= 0.07。
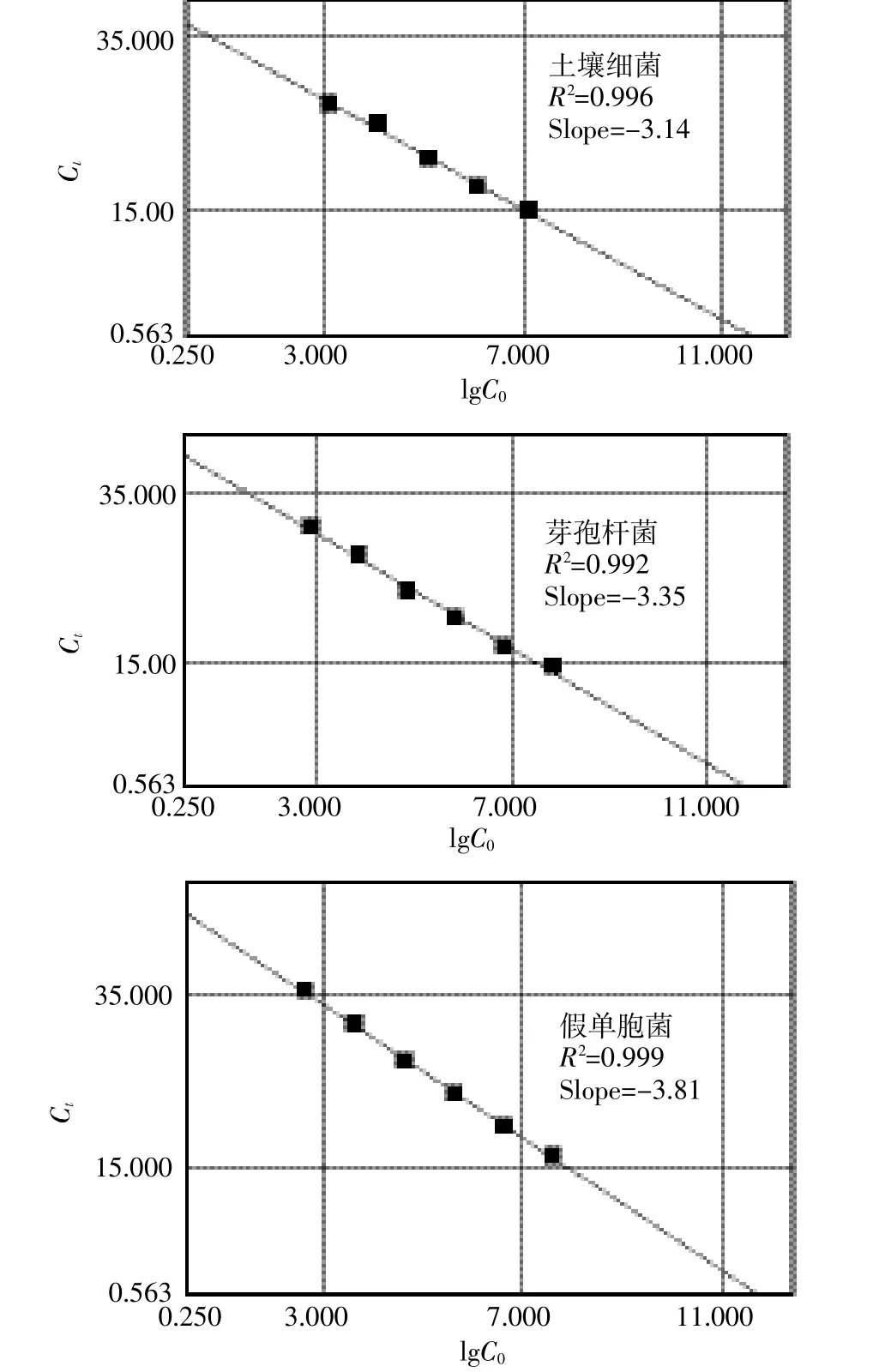
图2 定量土壤细菌、芽孢杆菌和假单胞菌的标准曲线Figure 2 Standard curves for total bacteria,Bacillus spp. and Pseudomonas spp.
2.4土壤性质之间的相关性分析
不同连作年限番茄土壤化学性质与微生物性质之间的相关性如表4所示。土壤有机质与全氮、C/N之间表现为极显著正相关(P<0.01),与P2O5及土壤假单胞菌数量呈显著正相关(P<0.05),与土壤pH呈极显著负相关(P<0.01)。TN与土壤pH呈极显著负相关(P<0.01),但与土壤P2O5、K2O及芽孢杆菌数量呈极显著正相关(P<0.01)。土壤细菌数量与C/N及芽孢杆菌数量呈极显著正相关(P<0.01);芽孢杆菌数量与假单胞菌数量呈极显著正相关(P<0.01)。
2.5土壤微生物群落结构变化
不同连作年限番茄土壤的微生物群落结构如图4所示。连作4年的土壤获得条带数最多(20条),连作11年土壤条带数最少(12条)。不同连作年限土壤的DGGE图谱中存在特异性条带,如:条带Ⅰ(假单胞菌)和条带Ⅱ(海洋沉积细菌)仅存在于连作4年的土壤中;条带Ⅲ(芽孢杆菌)仅存在于连作7年的土壤中;条带Ⅳ(不可培养的微杆菌)仅存在于连作13年的土壤中。除以上所述的一些特异性菌群外,还有一些菌群并非单一存在于某一特定土壤,但是其在不同土壤中条带亮度有所不同,如条带V(Nealsonii芽孢杆菌)和条带Ⅵ(假单胞菌)虽然同时存在于各个连作年限的土壤中,但是在连作4年和5年的土壤中其条带亮度大于其他连作年限土壤,说明在连作4年和5年的土壤中,芽孢杆菌和假单胞菌的种群数量大于其他连作年限土壤。
表5列出了几种常见作物连作年限与土壤微生物性质及作物产量的关系。土壤微生物方面的障碍主要表现为微生物多样性下降、微生物生物量减少、功能群落减少、有益微生物减少、土传病害增加等。土壤出现连作障碍的时间多数集中于4~10年之间。作物方面的连作障碍主要表现为产量下降,时间集中于连作4~7年。
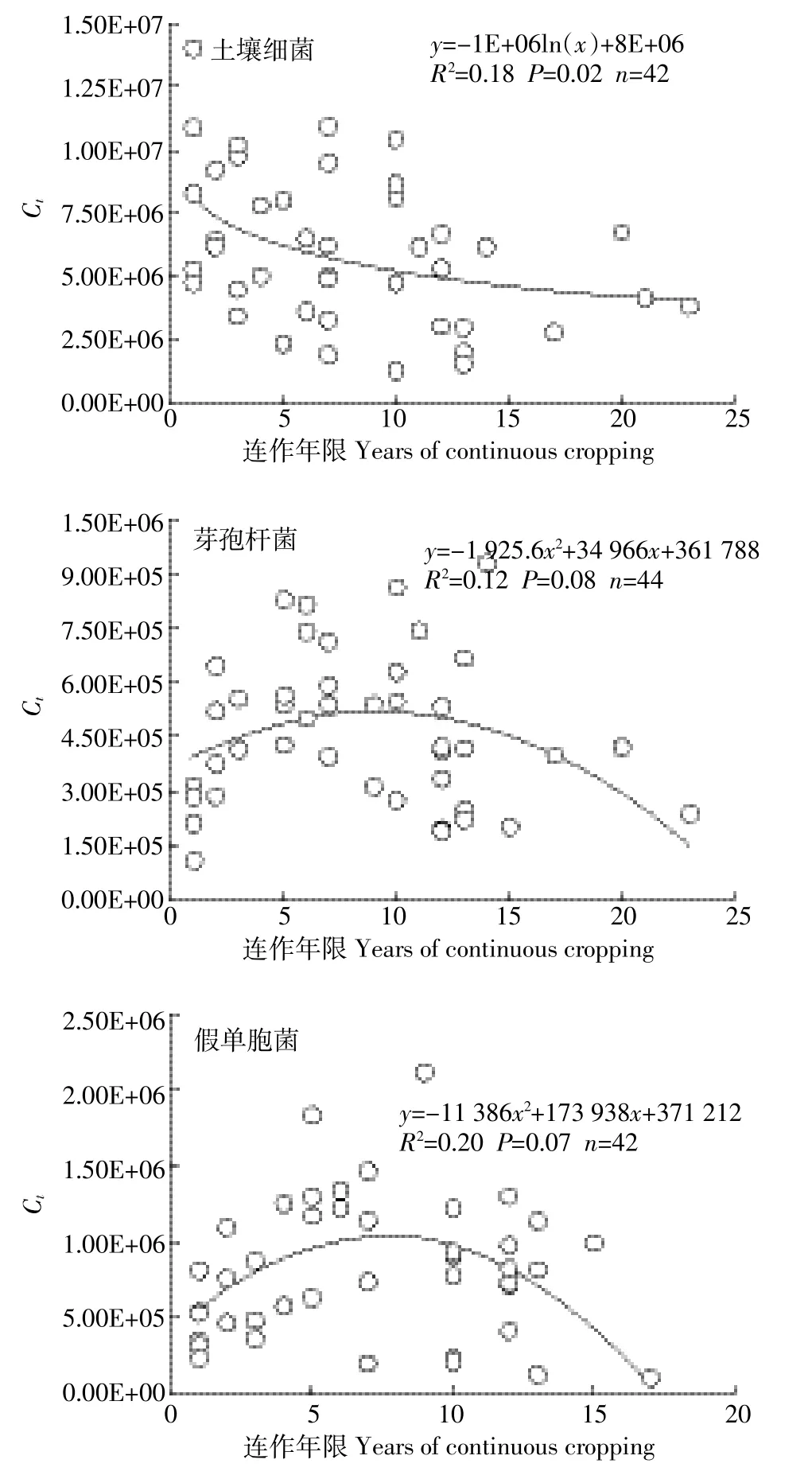
图3 土壤细菌、芽孢杆菌和假单胞菌的数量随种植年限的变化趋势Figure 3 Soil total bacteria,Bacillus spp. and Pseudomonas spp. copy number changed with years of tomato continuous cropping
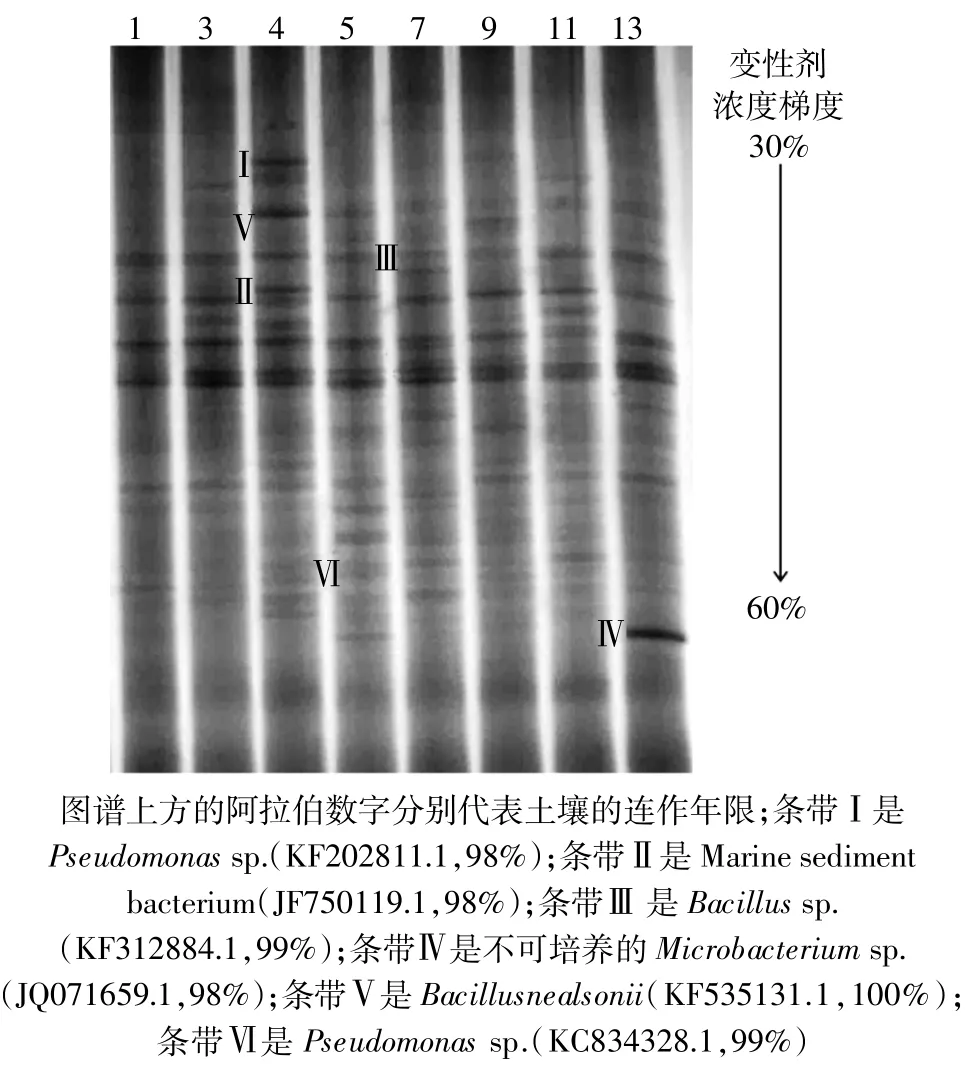
图4 不同连作年限设施番茄土壤DGGE图谱Figure 4 DGGE patterns under different continuous tomato cropping years
3 讨论
3.1长期连作对土壤化学性质的影响
长期连续种植设施番茄对土壤化学性质有显著影响。Guo等[38]指出在集约化农业生产中,尤其是长期连作设施蔬菜生产中,大量投入N肥(表1)及氮肥利用效率低下会导致土壤发生酸化。在本研究中,土壤pH随连作年限的增加呈下降趋势,由CCY3土壤中的8.02下降为CCY10+土壤中的7.88。设施番茄最适宜生长的pH为7.0左右,从本研究来看,由于土壤本身为盐碱性土壤,长期连作虽然导致土壤酸化,但pH的下降使得土壤酸碱性更适宜番茄生长。
长期连作设施番茄导致土壤SOM及TN增加(表3)。为了培肥土壤、确保高产,农户每年都会将一定量的有机肥(如牛粪、鸡粪等)投入设施番茄土壤中,这部分有机肥成为增加土壤有机质及总氮的主要来源。任涛[39]总结14个相关研究结果表明,SOC在连作前10年范围内表现为增加趋势,连作10年后表现为下降趋势。Yang等[40]总结100多个相关研究结果表明,土壤N库与土壤C库为线性相关关系,且SOC的增加会导致TN的增加。同样的,在本研究中,SOM 与TN也呈线性相关关系(TN=13.798SOM+1.454,R2= 0.697 4,n=54)。土壤TN与土壤pH呈显著负相关,也与其他研究结果一致[8],表明N肥的过量使用导致土壤pH值下降[38]。也有SOC及TN随着连作年限变化呈现相反变化趋势的研究结果,Naranjo等[41]研究表明SOC及TN随着甘蔗连作年限(5~30年)的增加而降低,但SOC及TN的降低并未导致甘蔗产量下降,而是增加67%。将本研究中选取的连作番茄土壤肥料投入量与该甘蔗试验的肥料投入量相比,发现设施番茄的肥料投入量远大于甘蔗肥料的投入量,因此SOM及TN的变化趋势不同是合理的。
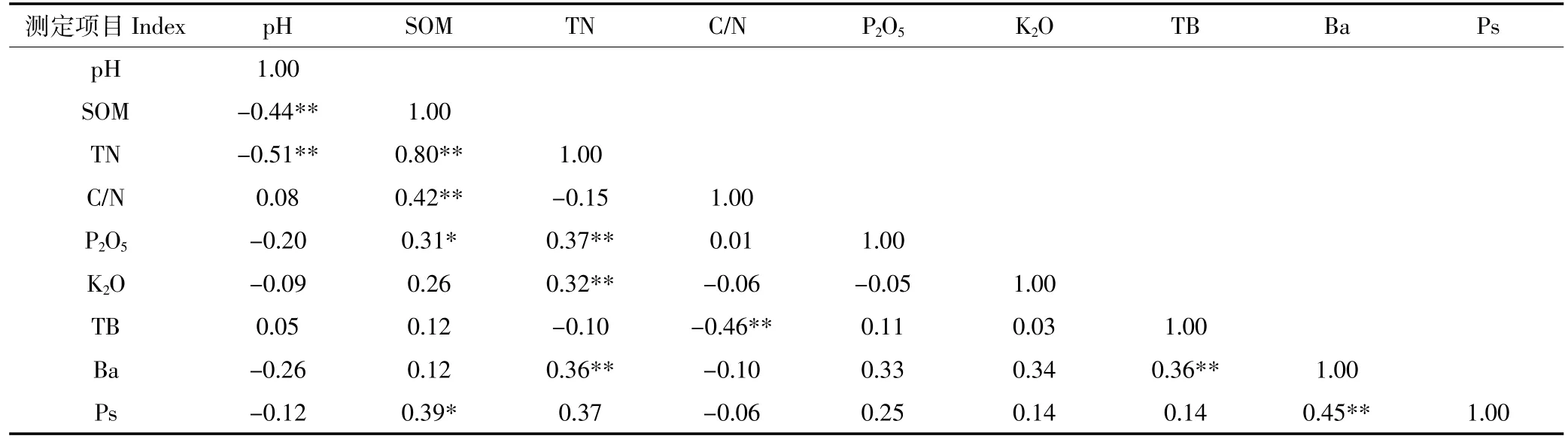
表4 不同连作年限番茄土壤性质之间的相关性分析Table 4 Spearman correlation coefficients between chemical properties and microbial properties of soils with different continuous cropping years

表5 几种常见作物连作年限对土壤性质及产量的影响Table 5 Soil properties and yield responses to continuous cropping years for several commonly continuously-cultured crops
3.2不同连作年限对土壤MBC及MBN的影响
土壤微生物生物量与土壤团聚体、土壤养分循环以及土壤有机质都有重要关系,因此它是表征土壤生态系统功能的重要指标[42],也是评价土壤质量的必要指标之一。研究表明,对土壤MBC及MBN影响最主要的因素是有机肥的调控而非其他养分或环境因子[42-43]。本研究结果表明,MBC与MBN随着连作年限的增加而增加,符合对数增长模型(图1)。土壤有机碳含量是影响土壤微生物生物量的关键因素[43],土壤有机碳含量越高,则土壤微生物生物量越高。本研究中土壤有机质随着连作年限的增长而增加,MBC与MBN也表现为随连作年限的增长而增加。
在本研究中,虽然土壤MBC及MBN随着连作年限而增加,但连作设施番茄土壤MBC及MBN的平均值远低于草地土壤的微生物生物量(781±253 mg·kg-1,Trasar-Cepeda等[44]),也低于普通农田土壤微生物生物量(351±21 mg·kg-1,Cynthia等[42])。农田扰动是造成这一现象的原因之一,例如不断地施用化肥、灌溉等,影响了土壤微生物生物量的恢复,使得土壤微生物群落处于持续的扰动-恢复状态。除此以外,近期也有相关研究表明化学肥料的投入对土壤微生物生物量有抑制作用。设施番茄生产过程中,农户习惯性投入过量的肥料可能对土壤微生物群落产生不利的影响(表1)。
3.3不同连作年限对土壤微生物群落结构的影响
通过对已发表的连作年限相关的文献进行总结,得出连作障碍通常出现在连作5~10年间(表5),包括产生土壤盐渍化、土壤微生物多样性下降,土壤真菌及病菌数量增加、作物产量下降等。本研究选择寿光地区栽培措施、管理方法相似、连作年限不同的设施番茄土壤,采用qPCR及DGGE两种方法研究土壤中两种重要土壤细菌——芽孢杆菌和假单胞菌及微生物群落随连作年限的变化规律。结果表明,土壤芽孢杆菌、假单胞菌及土壤微生物优势种群均在连作6~10年间表现出下降趋势(图3和图4),与生产中连作障碍出现的时间基本吻合。
未受干扰的自然土壤中,有益微生物和有害微生物通常处于平衡状态,有利于作物生长;相反,现代集约化农业栽培体系中,连续单一种植后,土壤微生物的平衡状态被打破,有益微生物减少,有害微生物增加,不利于作物生长。就目前已有的研究来看,大多数已发现的PGPR细菌属于芽孢杆菌属和假单胞菌属[45],这两个菌属中的多种菌株都具有抑制土传病害和促进作物生长的功能[7],例如荧光假单胞菌(Pseudomonas fluorescens)及枯草芽孢杆菌(Bacillus subtilis)。但并非所有的芽孢杆菌及假单胞菌都是PGPR细菌,因此并没有明确的证据表明土壤芽孢杆菌及假单胞菌的含量可以用来作为土壤微生物指标,指示土壤性质。但本研究发现土壤芽孢杆菌及假单胞菌连作6~10年开始下降,与连作障碍发生的时间基本一致。因此,我们可以推断,土壤中芽孢杆菌和假单胞菌作为包含大量植物促生菌的优势细菌种群,它们的存在对维持良好的土壤微生态环境有一定的作用。
土壤细菌数量随连作年限的增加表现为逐渐下降趋势(图3)。近期有很多研究表明,土壤肥力、有机物质、植被类型、土壤pH等都对土壤细菌丰度及群落结构有重要影响[44,46],Wu等[47]采用qPCR的方法研究水稻长期施肥试验中土壤细菌的变化,结果表明在养分含量较高的土壤中细菌数量较高。Wessén等[48]也得出相似的研究结果,即长期施用硝酸钙及硫酸铵的土壤具有较高的细菌数量。因此,施用化肥有助于增加土壤细菌含量。在本研究中,采集样品的两个区域农户的施肥方式和数量相似,均为频繁施用过量化学肥料(表1),我们推断施肥不是导致土壤细菌数量下降的直接原因。Shen等[46]的研究表明,土壤细菌的16S rRNA基因拷贝数与土壤pH呈显著正相关。根据这一结果,本研究中因施肥导致的pH随连作年限不断下降可能是导致土壤细菌数量下降的直接原因。
DGGE图谱(图4)表明土壤细菌优势菌群在连作4~5年后开始下降,也与文献中连作障碍出现的时间一致。对DGGE图谱的测序结果表明,连作4年和5年土壤中的条带Ⅰ和Ⅵ为假单胞菌,连作7年和4年土壤中的条带Ⅲ和V为芽孢杆菌。根据这些条带的亮度来看,DGGE对两种细菌的定性研究结果与qPCR的研究结果一致。此外,DGGE对设施番茄土壤微生物群落结构的变化分析也与近期连作黄瓜的研究结果一致。土壤微生物群落变化带来微生物群落功能变化,进而影响作物生长[46]。
4 结论
土壤细菌随着连作年限的增加而逐渐减少,可能与土壤pH降低有关;当连作年限少于6~10年时,芽孢杆菌和假单胞菌的数量表现为增加趋势,连作6~10年后逐渐减少;DGGE图谱及测序结果定性地反映了作为土壤优势菌群的芽孢杆菌和假单胞菌在连作4~5年后种群密度降低,均与连作障碍发生的时间基本吻合。因此,作为土壤中的优势细菌及PGPR的重要组成,芽孢杆菌及假单胞菌的数量变化可能与导致连作障碍的土壤微生物群落变化有关。在未来的研究中,应用多种研究手段在不同作物体系中分析芽孢杆菌及假单胞菌与连作障碍的关系,将对研究连作障碍的机理及调控有重要意义。
参考文献:
[1] FAO. Production:Crops. 2015b. http://faostat. fao. org/site/567/default. aspx#ancor.
[2]王敬国,陈清,林杉,等.设施菜田退化土壤修复与资源高效利用[M].北京:中国农业大学出版社, 2011:46-48. WANG Jing-guo, CHEN Qing, LIN Shan, et al. Management of degraded vegetable soils in greenhouses[M]. Beijing:China Agricultural University Press, 2011:46-48.
[3]何文寿.设施农业中存在的土壤障碍及其对策研究进展[J].土壤, 2004, 36(3):235-242. HE Wen-shou. Soil problems and countermeasure in facility agriculture in China[J]. Soils, 2004, 36(3):235-242.
[4]吴凤芝,赵凤艳,刘元英.设施蔬菜连作障碍原因综合分析与防治措施[J].东北农业大学学报, 2000, 31(3):241-247. WU Feng-zhi, ZHAO Feng-yan, LIU Yuan-ying. Comprehensive analysis and preventive measures for the cause of continuous cropping obstacle of facilities[J]. Journal of Northeast Agricultural University, 2000, 31(3):241-247.
[5] Xiong W, Zhao Q Y, Zhao J, et al. Different continuous cropping spans significantly affect microbial community membership and structure in a vanilla-grown soil as revealed by deep pyrosequencing[J]. Microbial E-cology, 2015, 70(1):209-218.
[6] Bashan Y, Holguin G. Proposal for the division of plant growth-promoting rhizobacteria into two classifications:Biocontrol -PGPB(Plant Growth-Promoting Bacteria)and PGPB[J]. Soil Biology and Biochemistry, 1998, 30(4):1225-1228.
[7] Gravel V, Antoun H, Tweddell R J. Growth stimulation and fruit yield improvement of greenhouse tomato plants by inoculation with Pseudomonas putida or Trichoderma atroviride:Possible role of indole acetic acid(IAA)[J]. Soil Biology and Biochemistry, 2007, 39(8):1968-1977. [8] Ruan W B, Ren T, Chen Q, et al. Effects of conventional and reduced N inputs on nematode communities and plant yield under intensive vegetable production[J]. Applied Soil Ecology, 2013, 66(4):48-55.
[9] Xiong W, Li Z G, Liu H J, et al. The effect of long-term continuous cropping of black pepper on soil bacterial communities as determined by 454 pyrosequencing[J]. Plos ONE, 2015, 10(8):1-13.
[10] Zhou T T, Chen D, Li C Y, et al. Isolation and characterization of Pseudomonas brassicacearum J12 as an antagonist against Ralstonia solanacearum and identification of its antimicrobial components[J]. Microbiological Research, 2012, 167(7):388-394.
[11] Chen B, Ouyang Z, Sun Z G, et al. Evaluation on the potential of improving border irrigation performance through border dimensions optimization:A case study on the irrigation districts along the lower Yellow River [J]. Irrigation Science, 2013, 31(4):715-728.
[12] Nelson D W, Sommers L E. Total carbon, organic carbon and organic matter[M]//Methods of soil analysis. Part 3:Chemical methods, soil science society of America. Wisconsin:Madison, 1996:961-1010.
[13]鲍士旦.土壤农化分析[M].北京:中国农业出版社, 2005. BAO Shi-dan. Soil agro-chemistrical analysis[M]. Beijing:China A-griculture Press, 2005.
[14] Ge T D, Chen X J, Yuan H Z, et al. Microbial biomass, activity, and community structure in horticultural soils under conventional and organic management strategies[J]. European Journal of Soil Biology, 2013, 96(6):122-128.
[15] Tian Y Q, Zhang X Y, Liu J, et al. Microbial properties of rhizosphere soils as affected by rotation, grafting, and soil sterilization in intensive vegetable production systems[J]. Scientia Horticulturae, 2009, 123 (2):139-147.
[16] Castillo M, Marti'n-Oru'e S M, Manzanilla E G, et al. Quantification of total bacteria, enter bacteria and lactobacilli population in pig digesta by real-time PCR[J]. Veterinary Microbiology, 2006, 114(1-2):165-170.
[17] Mori K, R Iriye, M Hirata. Quantification of Bacillus species in a wastewater treatment system by the molecular analyses[J]. Biotechnology and Bioprocess Engineering, 2004, 9(6):482-489.
[18] Kaare J, Oivind E, CarstenS J, et al. Quantitative selective PCR of 16S ribosomal DNA correlates well with selective agar plating in describing population dynamics of indigenous Pseudomonas spp. in soil hot spots [J]. Applied Environmental Microbiology, 1999, 65(4):1786-1788.
[19] Muyzer G, Smalla K. Application of denaturing gradient gel elec -trophoresis(DGGE)and temperature gradient gel electrophoresis (TGGE)in microbial ecology[J]. Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology, 1998, 73(1):127-141.
[20]胡元森.黄瓜连作障碍因子分析及其生物修复措施探讨[D].南京:南京农业大学, 2005. HU Yuan-sen. Factors analysis of continuous cucumber cropping obstacle and its preparatory bioremediation[D]. Nanjing: Nanjing Agricultural University, 2005.
[21]马云华,魏珉,王秀峰.日光温室连作黄瓜根区微生物区系及酶活性的变化[J].应用生态学报, 2004, 6(6):1005-1008. MA Yun-hua, WEI Min, WANG Xiu-feng. Variation of microflora and enzyme activity in continuous cropping cucumber soil in solar greenhouse[J]. Chinese Journal of Applied Ecology, 2004, 6(6):1005-1008.
[22]申卫收,林先贵,张华勇,等.不同栽培条件下蔬菜塑料大棚土壤尖孢镰刀菌数量的变化[J].土壤学报, 2008, 45(1):137-142. SHEN Wei-shou, LIN Xian-gui, ZHANG Hua-yong, et al. Numbers of Fusarium oxysporum in different greenhouse vegetable soils[J]. Acta Pedologica Sinica, 2008, 45(1):137-142.
[23]时立波.连作年限及杀线剂对番茄根围土壤线虫及微生物影响的研究[D].泰安:山东农业大学, 2009. SHI Li-bo. Effects of continuous tomato-cropping and different nematicides on soil nematodes and soil microorganism from rhizosphere soil[D]. Taian: Shandong Agricultural University, 2009.
[24]张静文.连作和轮作棉田土壤微生物多样性分析及PGPR菌株筛选[D].乌鲁木齐:新疆农业大学, 2009. ZHANG Jing-wen. Soil microbial diversity analysis in cotton continuous fields under continuous and rotation cropping systems and screening of plant-growth promoting rhizobacteria strains[D]. Urumchi:Xinjiang Agricultural University, 2009.
[25]顾美英,徐万里,茆军,等.连作对新疆绿洲棉田土壤微生物数量及酶活性的影响[J].干旱地区农业研究, 2009, 27(1):1-11. GU Mei-ying, XU Wan-li, MAO Jun, et al. Effects of cotton continuous cropping on the amount of soil microbes and enzyme activities in Xinjiang[J]. Agricultural Research in the Arid Areas, 2009, 27(1):1-11.
[26]刘建国,张伟,李彦斌,等.新疆绿洲棉花长期连作对土壤理化性状与土壤酶活性的影响[J].中国农业科学, 2009, 42(2):725-733. LIU Jian-guo, ZHANG Wei, LI Yan-bin, et al. Effects of long-term continuous cropping system of cotton on soil physical-chemical properties and activities of soil enzyme in oasis in Xinjiang[J]. Scientia agriculture sinica, 2009, 42(2):725-733.
[27]盘莫谊,张杨珠,肖嫩群,等.烟草连作对旱地土壤微生物及酶活性的影响[J].世界科技研究与发展, 2008, 30(3):295-297. PAN Mo-yi, ZHANG Yang-zhu, XIAO Nen-qun, et al. Effect of con-tinuous cropping tobacco on the microbes and enzyme activities in dry land soil[J]. World Sci-tech R&D, 2008, 30(3):295-297.
[28]陈冬梅,柯文辉,陈兰兰,等.连作对白肋烟根际土壤细菌群落多样性的影响[J].应用生态学报, 2010, 21(7):1751-1758. CHEN Dong-mei, KE Wen-hui, CHEN Lan-lan, et al. Diversity of bacterial community in rhizosphere soil under effects of continuously planting burley tobacco[J]. Chinese Journal of Applied Ecology, 2010, 21(7):1751-1758.
[29]杨宇虹,陈冬梅,晋艳,等.连作烟草对土壤微生物区系影响的T-RFLP分析[J].中国烟草学报, 2012, 18(1):40-45. YANG Yu-hong, CHEN Dong-mei, JIN Yan, et al. T-RFLP analysis of soil microbial diversity after continuous tobacco cropping[J]. Acta Tabacaria Sinica, 2012, 18(1):40-45.
[30]贾欢欢.马铃薯连作对根际细菌和真菌遗传多样性的影响[D].兰州:甘肃农业大学, 2013. JIA Huan-huan. Effect of continuous potato cropping on genetic diversity of bacterium and fungi in potato rhizosphere[D]. Lanzhou:Gansu Agricultural University, 2013.
[31]许永利.生姜连作土壤生态系统调控研究[D].北京:中国农业大学, 2014. XU Yong-li. Regulation on ginger continuous cropping soil ecosystem [D]. Beijing:China Agriculture University, 2014.
[32]陈政.连作生姜根际土壤微生物群落结构分析[D].泰安:山东农业大学, 2013. CHEN Zheng. Analysis of continuous cropping on rhizosphere microbial community structure in ginger field[D]. Taian:Shandong Agriculture University, 2013.
[33]吴凤芝,孟立君,王学征.设施蔬菜轮作和连作土壤酶活性的研究[J].植物营养与肥料学报, 2006, 12(4):554-558. WU Feng-zhi, MENG Li-jun, WANG Xue-zheng. Soil enzyme activities in vegetable rotation and continuous cropping system of under shed protection[J]. Plant Nutrition and Fertilizer Science, 2006, 12(4):554-558.
[34]贺丽娜,梁银丽,高静,等.连作对设施黄瓜产量和品质及土壤酶活性的影响[J].西北农林科技大学学报, 2008, 36(5):155 -159. HE Li-na, LIANG Yin-li, GAO Jing, et al. The effect of continuous cropping on yield, quality of cucumber and soil enzymes activities in solar greenhouse[J]. Journal of Northwest A&F University, 2008, 36 (5):155-159.
[35]郭红伟.连作对土壤性状和辣椒生育、生理代谢的影响[D].南京:南京农业大学, 2011. GUO Hong -wei. Effect of continuous cropping on physicochemical properties of soil and growth, physiological metabolism of pepper[D]. Nanjing: Agriculture University, 2011.
[36]许艳丽,刘晓冰,韩晓增,等.大豆连作对生长发育动态及产量的影响[J].中国农业科学, 1999, 32(增刊1):62-68. XU Yan-li, LIU Xiao-bing, HAN Xiao-zeng, et al. Effect of continuous cropping on yield and growth development of soybean[J]. Scientia A-gricultura Sinica, 1999, 32(Suppl1):62-68.
[37]邓阳春,黄建国.长期连作对烤烟产量和土壤养分的影响[J].植物营养与肥料学报, 2010, 16(4):840-845. DENG Yang-chun, HUANG Jian-guo. Effect of long continuous cropping on the yields of flue-cured tobacco and nutrients in soils[J]. Plant Nutrition and Fertilizer Science, 2010, 16(4):840-845.
[38]Guo J H, Liu X J, Zhang Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 327(5968):1008-1010.
[39]任涛.不同氮肥及有机肥投入对设施番茄土壤氮去向的影响[D].北京:中国农业大学, 2011:9-11. REN Tao. Effect of different nitrogen fertilizer and organic fertilizer on the soil nitrogen in greenhouse tomato[D]. Beijing:China Agriculture University, 2011:9-11.
[40] Yang Y H, Luo Y Q, Finzi A C. Carbon and nitrogen dynamics during forest stand development:A global synthesis[J]. New Phytologist, 2011, 190(4):977-989.
[41] Naranjo D L F, Salgado -Garcia S, Lagunes -Espinoza L C, et al. Changes in the properties of a Mexican Fluvisol following 30 years of sugarcane cultivation[J]. Soil & Tillage Research, 2006, 88(1):160-167.
[42] Cynthia K, Stuart A G. Controls over soil microbial biomass responses to carbon amendments in agricultural systems:A meta-analysis[J]. A-griculture Ecosystems & Environment, 2011, 144(1):241-252.
[43] Fierer N, Strickland M S, Liptzin D, et al. Global patterns in belowground communities[J]. Ecology Letters, 2009, 12(11):1238-1249.
[44] Trasar-Cepeda C, Leirós M C, Seoane S, et al. Biochemical properties of soils under crop rotation[J]. Applied Soil Ecology, 2008, 39(2):133-143.
[45] Farah A, Iqbal A, Khan M S. Screening of free-living rhizospheric bacteria for their multiple plant growth promoting activities[J]. Microbiological Research, 2008, 163(2):173-181.
[46] Shen J P, Zhang L M, Guo J F, et al. Impact of long-term fertilization practices on the abundance and composition of soil bacterial communities in Northeast China[J]. Applied Soil Ecology, 2010, 46(1):119-214.
[47] Wu M N, Qin H L, Chen Z, et al. Effect of long-term fertilization on bacterial composition in rice paddy soil[J]. Biology and Fertility of Soil, 2011, 47(4):397-405.
[48] Wessén E, Hallin S, Philippot L. Differential responses of bacterial and archaeal groups at high taxonomical ranks to soil management[J]. Soil Biology and Biochemistry, 2010, 42(10):1759-1765.
Soil Pseudomonas spp., Bacillus spp., and microbial communities under tomato continuous cropping in greenhouse production
GE Xiao-ying1,2, SUN Zhi-gang1, LI Tao1,2, OUYANG Zhu1*
(1. Key Laboratory of Ecosystem Network Observation and Modeling / Institute of Geographic Sciences and Natural Resources Research, Chinese Academy of Sciences, Beijing 100101, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
Abstract:Long-term continuous cropping is unsustainable for vegetable production, especially for greenhouse vegetables. Most researchers have attributed the harmful effects of continuous cropping to the changes in soil microbial ecology. However, soil Pseudomonas spp. and Bacillus spp., two most important PGPR(plant growth promoting rhizobacteria)and dominant bacteria, have seldom been examined in investigating the microbial processes of continuous cropping obstacles until now. In this study, we investigated changes in soil Pseudomonas spp. and Bacillus spp. populations under continuous cropping and their relationships with soil microbial community using samples from 54 greenhouse tomato fields across continuous cropping years of 1~21 in Shouguang County and Yucheng County, Shandong, China. Results show that the number of total soil bacteria decreased as continuous cropping years increased, whereas the populations of Bacillus spp. and Pseudomonas spp. increased when continuous cropping years were shorter than 6~10 and then decreased after that. Results from PCR-DGGE (Denaturing Gradient Gel Electrophoresis)profile and sequence showed that Bacillus spp. and Pseudomonas spp. decreased after 4~5-year continuous cropping, which was similar to the actual period during which continuous cropping obstacles commonly occur(mainly 5~10book=515,ebook=113years). Soil organic carbon and C/N ratio significantly increased with the extension of continuous cropping time, and soil microbial C and N were a logarithmic function of continuous cropping year(R2were 0.20 and 0.30, respectively, P<0.001). Soil bacteria were significantly negatively correlated to soil C/N. Our investigation indicates that the occurrence of continuous cropping obstacles closely relates to the dynamic changes in these two dominant populations, suggesting that soil Bacillus spp. and Pseudomonas spp. play vital roles in maintaining soil ecology and soil health under long-term continuous cropping.
Keywords:greenhouse tomato; continuous cropping; microbial community structure; Bacillus spp.; Pseudomonas spp.
*通信作者:欧阳竹E-mail:ouyz@igsnrr.ac.cn
作者简介:葛晓颖(1984—),女,内蒙古巴彦淖尔市人,博士研究生,主要研究方向为农田土壤养分及土壤微生物。E-mail:xiaoying_ge@126.com
基金项目:国家高技术研究发展计划(863计划)之作物健康生长农艺调控技术项目(2013AA102903)
收稿日期:2015-10-14
中图分类号:S154.3
文献标志码:A
文章编号:1672-2043(2016)03-0514-10
doi:10.11654/jaes.2016.03.015
