格雷夫甲亢合并慢性丙型肝炎的老年女性干扰素抗病毒治疗1例
2016-04-21康姚洁张婷婷刘立畅
康姚洁,刘 伟,王 煊,张婷婷,齐 晶,晁 华,刘 娜,刘立畅
(解放军第302医院:内分泌科1,综合内科2, 北京 100039)
干扰素(interferon, IFN)-α联合利巴韦林(ribavirin,RBV)是目前我国慢性丙型肝炎(chronic hepatitis C, CHC)的经典治疗方案,但甲状腺疾病在相当程度上限制了IFN-α的临床应用。现普遍认为,在IFN-α治疗前或治疗过程中出现的甲状腺功能亢进(甲亢)、尤其是毒性弥漫性甲状腺肿(Graves disease,GD),为IFN治疗的禁忌证。本文报道1例GD合并CHC的采用抗甲状腺药物(ATD)与IFN联合治疗的病例。
1 临床资料
患者老年女性,65岁,于2014年5月因心慌、乏力、消瘦就诊于当地医院,门诊甲状腺功能(甲功)提示甲状腺激素水平(thyroid hormone,TH)升高,诊断“Graves甲亢”并住院治疗,期间发现肝功转氨酶轻度升高(具体不详),丙肝抗体阳性,乙肝五项、甲肝IgM抗体、丁肝抗体、戊肝抗体IgM、庚肝抗体阴性,丙肝病毒核酸定量HCV RNA 4.24×104IU/ml,腹部超声提示肝脏形态欠规则,予甲巯咪唑(MMI,赛治)10 mg口服,3次/d,水飞蓟宾胶囊保肝、降酶治疗。出院后定期复查甲功和肝功,MMI逐渐减量,至2014年9月15日改为5 mg,2次/d,2014年9月27日于解放军第302医院肝病科住院,预行IFN-α抗病毒治疗。
既往病史。否认“高血压、冠心病、糖尿病”病史。1989年因“宫外孕”于当地医院行“右侧输卵管切除术”。1990年因“肠梗阻”于当地医院行“肠切除术”。2004年因“胆囊结石”于当地医院行“胆囊切除术”。“青霉素”过敏史。体格检查:体温36.3℃,脉搏90次/min,呼吸16次/min,血压130/77 mmHg,身高164 cm,体质量65 kg,体质量指数24.16 kg/m2,发育正常,营养中等,步入病房,神清语利,皮肤无多汗,肝掌可疑阳性,未见蜘蛛痣。巩膜无黄染,面部无浮肿,眉毛无脱落,双眼突眼(-),甲状腺相关眼征(-)。听力正常,双侧甲状腺Ⅰ度肿大,质韧,无触痛,可闻及血管杂音,心率90次/min,律齐,心肺无异常,右上腹、中腹、下腹各有一手术瘢痕,未见腹壁浅静脉曲张,双手细颤(+),胫前无黏液性水肿,余无特殊。实验室检查:HCV RNA1.61×107IU/ml,丙肝病毒分型1b,甲状腺相关抗体见表1(2014-10-03), 甲功回报见表2(2014-09-28)。腹部超声:(1)肝实质弥漫性损害;(2)胆囊切除术后。心电图、胸片未见异常。甲状腺超声:甲状腺实质弥漫性病变。肝脏穿刺病理检查:慢性病毒性肝炎,丙型,G1S3。初步诊断“慢性丙型病毒性肝炎、甲状腺功能亢进症”。患者及家属要求IFN-α治疗。告知病情:如IFN-α治疗可能出现(1)甲亢加重而终止治疗;(2)外周血细胞减少。患者及家属均签订IFN-α使用知情同意书。2014年10月3日开始Peg-IFN-α-2a注射液(上海罗氏公司)135 μg/周+RBV 300 mg(3次/d)治疗。10月6日本科会诊,考虑Graves甲亢诊断明确,建议131I治疗后再行IFN-α治疗,患者及家属拒绝,继续维持现治疗方案。10月11日出院。随后每1~3个月于本院肝病科住院复查甲功、肝功、血常规等,内分泌科门诊随诊。4支IFN-α后(2014-10-30)HCV RNA 7.92×102IU/ml,TH水平较前升高(表2),MMI改为10 mg,2次/d,12月29日12支IFN-α后HCV RNA<15 IU/ml,MMI 10 mg,1次/d。于2015-04-10复查血常规:白细胞(1.37×109/L),中性粒细胞(0.59×109/L),红细胞(2.36×109/L)及血红蛋白(82 g/L),血小板(70×109/L),呈不同程度降低。间断发热,体温最高达38.6℃,可自行下降。给予口服益血升片、利可君片、银耳孢糖肠溶胶囊,间断皮下注射重组人粒细胞刺激因子、促红细胞生成素,提升白细胞、纠正贫血等治疗,肌注白介素-11,胸腺五肽注射液调节免疫治疗,1次/月复查血常规,继续上述治疗,2015年6月25日RBV调整为300 mg/d,MMI 5 mg,1次/d。至2016年3月15日完成IFN-α治疗疗程,共68周。
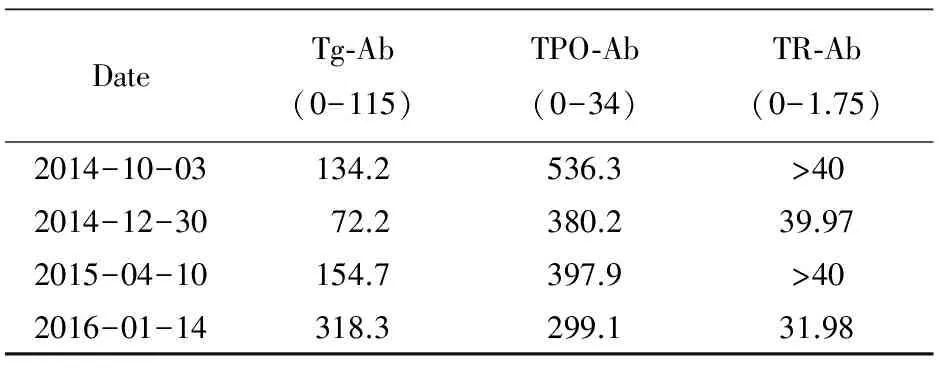
表1 甲状腺相关抗体
Tg-Ab: thyroglobulin antibody; TPO-Ab:thyroid peroxidase antibody; TR-Ab:thyrotropin receptor antibody
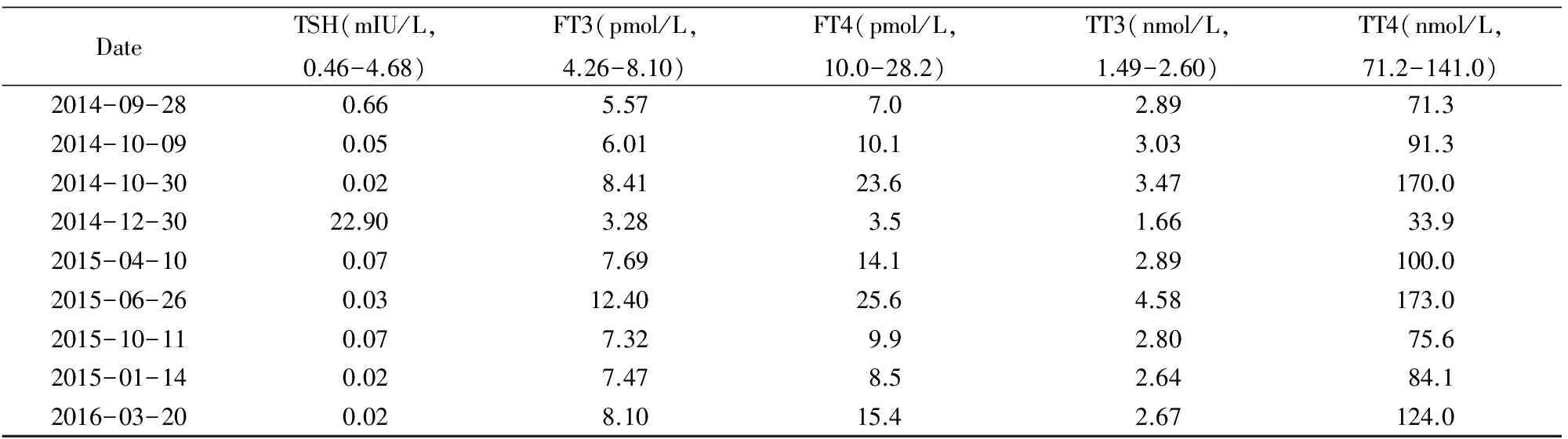
表2 甲状腺功能相关指标
TSH: thyropin; FT3: free triiodothyronine; FT4: free thyroxine; TT3: triiodothyronine; TT4: thyroid hormone
2 讨 论
我国最新版《丙型肝炎防治指南》指出,在直接抗病毒药物(DAAs)上市前, Peg-IFN-α+RBV仍是CHC主要的抗病毒治疗方案[1]。Peg-IFN-α有较多的相对禁忌证和绝对禁忌证。未控制的甲状腺疾病为相对禁忌证,常见的有甲状腺功能减退(甲减)和甲亢。甲减不是IFN治疗的禁忌证[2],而对于治疗前发现的TH水平升高(又称甲状腺毒症)则为IFN治疗的最大障碍[2]。
GD治疗方法包括131I、ATD和手术治疗,各有利弊。近几年,因131I应用日渐广泛,已很少采用手术治疗方法。我国对131I治疗甲亢的态度相对保守,ATD在许多时候仍在治疗中占主导地位。ATD治疗持续时间长(1.5~2.0年),不良反应多,疗程结束后复发率高,尤其是年轻且TRAb高滴度的患者[3,4],因此对亟待IFN-α治疗的患者应尽早采取131I治疗,待甲亢缓解后启动IFN治疗。不主张ATD治疗的同时行IFN-α治疗,主要原因:(1)IFN-α可直接作用于甲状腺细胞或通过诱导生成甲状腺自身抗体,使Graves病情加重[5];(2)Graves甲亢可导致肝功能异常,机制可能与甲状腺毒症、自身免疫反应等因素相关;(3)常用的ATD有丙基硫氧嘧啶(PTU)和MMI,均可导致肝损害,MMI肝损害以黄疸为主要表现,PTU引起的肝损害以肝细胞损害为主,发生率及严重程度高于MMI[6];(4)ATD和IFN-α的不良反应多有交叉与重叠,如均可对皮肤系统、血液系统和免疫系统等产生不良反应[1,3,6]。因此,现尚无GD患者ATD治疗的同时IFN-α治疗并且完成整个疗程治疗的病例报道。
资料表明ATD和IFN-α的不良反应女性显著高于男性,并和年龄的增长直接相关,老年女性CHC患者IFN-α治疗后发生甲状腺功能紊乱比例明显高于其他人群[7]。本例患者Graves甲亢合并CHC诊断明确,老年女性,但其耐受性好,ATD治疗4个月无不良反应发生,起始IFN-α治疗时TH水平已接近正常,既往无糖尿病、高血压及心脏疾病,尤其是患者及其家属的乐观、坚持以及对医护人员的绝对信任,这些都是最终治疗成功的基本保证,虽然患者在治疗中外周血白细胞一度降至低限,在给予积极有效的治疗后,并没有终止治疗。或许随着DAAs的上市,IFN-α在CHC中的应用会逐渐减少,但在药物获取困难、经济状况一般、儿童、慢性乙型肝炎的患者中仍会继续应用。因此本例患者的治疗仍具有特殊意义,为类似患者的临床治疗开拓了一个新的治疗模式。
【参考文献】
[1] Chinese Society Hepatology Diseases, Chinese Medical Association. The guideline of prevention and treatment for chronic hepatitis C: 2015 update[J]. Chin J Hepatol, 2015, 23(12): 889-905.[中华医学会肝病学分会. 丙型肝炎防治指南(2015更新版)[J]. 中华肝脏病杂志, 2015, 23(12): 889-905.]
[2] Li J, Li CL, Shao YH,etal. Influence of interferon α therapy on thyroid function in patients with hepatitis C[J]. Infect Dis Information, 2010, 23(4): 239-241.[李 剑, 李春霖, 邵迎红, 等. 干扰素α治疗丙型肝炎对甲状腺功能的影响[J]. 传染病信息, 2010, 23(4): 239-241.]
[3] Writing Group of Guidelines of Diagnosis and Management of Thyroid Disease in China,Chinese Society of Endocrinology Diseases, Chinese Medical Association. Guidelines of Diagnosis and Management of Thyroid Disease in China—hyperthyroidism[J]. Chin J Intern Med, 2007, 46(8): 876-882.[中华医学会内分泌学分会《中国甲状腺疾病诊治指南》编写组. 中国甲状腺疾病诊治指南——甲状腺功能亢进症[J]. 中华内科杂志, 2007, 46(8): 876-882.]
[4] Sundaresh V, Brito JP, Wang Z,etal. Comparative effectiveness of therapies for Graves’hyperthyroidism: a systematic review and network meta-analysis[J]. J Clin Endocrinol Metab, 2013, 98(9): 3671-3677.
[5] Kong YC, Wei WZ, Tomer Y. Opportunistic autoimmune disorders: from immunotherapy to immune dysregulation[J]. Ann N Y Acad Sci, 2010, 1183(2): 222-236.
[6] Lian XL. Safety issues of thiourea antithyroid drugs[J].Adverse Drug React J, 2011, 13(4): 232-235.[连小兰.硫脲类抗甲状腺药物的安全性问题[J].药物不良反应杂志, 2011, 13(4): 232-235.]
[7] Mandac JC, Chaudhry S, Sherman KE,etal. The clinical and physiological spectrum of interferon-alpha induced thyroiditis: toward a new classification[J]. Hepatology, 2006, 43(4): 661-672.
