子宫内膜异位组织中VEGF、c-fos表达及意义
2016-04-18潘虹刁静汤蕴琦潘颖琳李佳蕊张萍上海交通大学医学院附属新华医院上海200092
潘虹,刁静,汤蕴琦,潘颖琳,李佳蕊,张萍(上海交通大学医学院附属新华医院,上海200092)
子宫内膜异位组织中VEGF、c-fos表达及意义
潘虹,刁静,汤蕴琦,潘颖琳,李佳蕊,张萍(上海交通大学医学院附属新华医院,上海200092)
摘要:目的探讨子宫内膜异位组织中血管内皮生长因子(VEGF)、c-fos表达及意义。方法选择23例子宫内膜异位症(EMs)患者异位内膜组织23例份(异位内膜组)及在位内膜组织20例份(在位内膜组),正常子宫内膜组织21例份(对照组)。采用免疫组化SP法检测各组VEGF表达,蛋白免疫印迹法检测各组c-fos表达,并分析内膜组织VEGF与c-fos蛋白表达的关系。结果异位内膜组和在位内膜组VEGF、c-fos表达均高于对照组,P均<0.05;异位内膜组和在位内膜组VEGF、c-fos表达比较,P均>0.05。子宫内膜组织中VEGF与c-fos表达呈正相关(r=0.425,P<0.05)。结论EMs患者在位及异位内膜组织中VEGF与c-fos表达均升高;c-fos可能通过上调VEGF表达,促进子宫内膜组织血管生成,继而引起EMs的发生。
关键词:子宫内膜异位症;血管内皮生长因子;c-fos
子宫内膜异位症(EMs)是指具有生长功能的子宫内膜组织,如腺体和间质,出现在子宫腔被覆内膜及宫体肌层以外的其他部位。育龄期妇女EMs的发病率为10%~15%[1],不孕症患者发病率高达40%[2]。EMs是一种良性疾病,但具有转移、侵袭等恶性生物学行为。研究发现,血管形成与EMs的发生密切相关[3,4]。c-fos、血管内皮生长因子(VEGF)是调节血管形成的重要因子,但其与EMs发病的关系鲜见报道。为此,我们进行了如下研究。
1资料与方法
1.1临床资料选取2010年6月~2012年6月在我院行腹腔镜和开腹手术的EMs患者23例,年龄24~47岁、平均35.6岁,均为卵巢子宫内膜异位囊肿,无其他合并症;既往月经规律,术前6个月未服用任何激素类药物,术后病理检查确诊为EMs;参照1985年美国生育学会修订的EMs分期标准(r-AFS),均为Ⅱ、Ⅲ期。术后取其异位内膜组织23例份(异位内膜组),其中增生期12例份、分泌期11例份,HE染色后均可见子宫内膜腺体;取其在位内膜组织20例份(在位内膜组),其中增生期11例份、分泌期9例份。选取正常子宫内膜组织21例份(对照组),均由其他良性疾病行子宫切除或宫腔镜检查刮宫所得,病理检查证实均无子宫内膜病变,其中增生期11例份、分泌期10例份。患者年龄26~48岁,平均36.3岁。
1.2VEGF表达检测各组标本分为两份,一份立即浸泡在10%甲醛中固定,常规石蜡包埋,4 μm厚连续切片。采用免疫组化SP法检测VEGF表达,操作步骤严格按试剂盒说明书进行。采用Image-Pro Plus6.0软件分析显微镜下放大400倍的VEGF免疫组化图像。分析前先对阳性目标彩色分割、编辑,获得满意图形、图像,选取相应区域,测量其积分光密度(IOD)及面积,以IOD值除以测量面积得到平均光密度。每张切片在高倍镜下选取10个视野,计算10次平均光密度,取平均值。
1.3c-fos表达检测将另一份标本立即放入液氮中,置于-80 ℃超低温冰箱保存,采用蛋白免疫印迹法检测c-fos表达。加入组织裂解液后提取蛋白,测定蛋白浓度,裂解组织以每孔30 μg上样,行聚丙烯酰胺凝胶电泳。电转移至硝酸纤维素膜,封闭后依次加入兔抗人c-fos多克隆抗体、兔抗人actin多克隆抗体和辣根过氧化物酶标记的羊抗兔IgG,最后经化学荧光发光法显影试剂盒显影,操作过程按说明书进行。采用数字凝胶成像系统对结果进行灰度扫描分析,相对表达量以c-fos灰度面积积分与内参照肌动蛋白actin的比值表示。
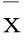
2结果
异位内膜组和在位内膜组VEGF、c-fos表达均高于对照组,P均<0.05;异位内膜组和在位内膜组VEGF、c-fos表达比较,P均>0.05。见表1。直线相关分析显示,子宫内膜组织VEGF与c-fos表达呈正相关(r=0.425,P<0.05)。
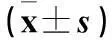
表1 各组VEGF、c-fos表达比较
注:与对照组比较,*P<0.05。
3讨论
EMs是雌激素依赖性良性病变,但具有一些类似恶性肿瘤的生物学行为,特别是组织侵袭和血管形成能力。目前EMs发病机制尚未明确,以Sampson的经血逆流种植学说为主。但经血逆流至盆腔是普遍的生理现象,其中发生EMs者只占10%~15%[5],提示经血逆流可能只是诱因。因此,探讨子宫内膜在腹腔内种植生长的机制才是阐明EMs发病的关键。目前认为,黏附、侵袭、血管形成是内膜异位种植的病理生理过程[6],其中黏附和侵袭的过程很短暂,而异位种植病灶的发生和发展依赖于充足的血液供应,故认为血管异常增生是EMs发病的重要原因[7]。
VEGF具有多种生物学效应,被认为是调节血管生长作用最强的因子[8,9]。原癌基因c-fos是受雌激素作用的靶基因之一,人类和小鼠c-fos基因启动子区域存在功能性雌激素反应元件,雌激素作用后c-fos表达显著上升,并与Jun蛋白形成转录因子AP-1,调节细胞侵袭、生长及血管形成等相关靶基因的表达。因此,c-fos被认为是雌激素早期应答基因,可作为雌激素作用的早期感受分子[10,11]。“在位内膜决定论”认为, EMs患者在位内膜组织VEGF表达明显高于非EMs[6]。本研究异位内膜组和在位内膜组VEGF、c-fos表达均显著高于对照组,而异位内膜组与在位内膜组VEGF、c-fos表达比较无统计学差异,与史淑红等[12]研究结论一致,均支持“在位内膜决定论”,提示EMs患者在位内膜组织血管生成能力较正常子宫内膜组织增强,一旦逆流进入腹腔,很容易产生新生血管,并进一步侵袭、发展,促使异位内膜的成功种植和发展。Rein等[13]研究显示,异位内膜组织VEGF表达高于在位内膜组织,本研究结果与其不同。可能与本研究采集异位内膜标本不同有关,新形成的异位内膜组织VEGF表达可能偏高,而陈旧性异位内膜组织VEGF表达可能下降。
研究显示,雌二醇通过c-fos上调乳腺癌组织VEGF表达,从而促进乳腺癌组织的血管形成[14]。Catar等[15]研究发现,TGF-β1可诱导腹膜间皮细胞表达VEGF,电泳迁移率试验显示TNF-α或IL-1β与TGF-β1共同作用后,通过c-fos激活VEGF基因启动子区域,而小干扰RNA抑制c-fos表达或c-fos抑制剂则降低VEGF基因启动子活性,并下调VEGF表达水平;提示c-fos是介导TNF-α、IL-1β与TGF-β1促进腹膜间皮细胞表达VEGF的重要分子。本研究结果显示,子宫内膜组织中VEGF与c-fos表达呈正相关,说明c-fos可能通过上调VEGF表达而促进异位子宫内膜组织血管生成,继而导致EMs的发生。本研究为探讨EMs的发病机制提供了新思路,有望为EMs临床治疗提供新靶点。
参考文献:
[1] Missmer AS, Hankinson SE, Spiegelman D, et al. Reproductive history and endometriosis among premenopausal women[J]. Obstet Gynecol, 2004,104(5):965-974.
[2] Bruner-Tran KL, Zhang Z, Eisenberg E, et al. Down-regulation of endometrial matrix metalloproteinase-3 and -7 expression in vitro and therapeutic regression of experimental endometriosis in vivo by a novel nonsteroidal progesterone receptor agonist, tanaproget[J]. J Clin Endocrinol Metab, 2006,91(4):1554-1560.
[3] May K, Becker CM. Endometriosis and angiogenesis[J]. Minerva Ginecol, 2008,60(3):245-254.
[4] Lockwood CJ. Mechanisms of normal and abnormal endometrial bleeding[J]. Menopause, 2011,18(4):408-411.
[5] 徐丛剑,程明军,黄宇婷,等.子宫内膜异位症病因学研究进展[J].中国实用妇科与产科杂志,2009,25(9):712-714.
[6] 仝佳丽,郎景和.子宫内膜异位症的在位内膜病变研究进展[J].现代妇产科进展,2010,19(6):465-467.
[7] Xu H, Zhang T, Man GC, et al. Vascular endothelial growth factor C is increased in endometrium and promotes endothelial functions, vascular permeability and angiogenesis and growth of endometriosis[J]. Angiogenesis, 2013,16(3):541-551.
[8] 汪俊元,王安才,曹蘅,等.血管内皮生长因子与血管重构的关系及阿托伐他汀干预作用[J].中国现代医学杂志,2009,19(9):1379.
[9] Wu Ming, Yih Ho, Hong Nerng. The role of cytokines in endometriosis[J]. Am J Reprod Immunol, 2003,49(5):285-296.
[10] Gilabert-Estellés J, Ramón LA, Espana F, et al. Expression of angiogenic factors in endometriosis: relationship to fibrinolytic and metalloproteinase systems[J]. Hum Reprod, 2007,22(8):2120-2127.
[11] John S, Nayvelt I, Hsu HC, et al. Regulation of estrogenic effects by beclin 1 in breast cancer cells[J]. Cancer Res, 2008,68(19):7855-7863.
[12] 史淑红,高秀娟,李艳芳,等.sflt-1、VEGF在子宫内膜异位组织中的表达及意义[J].山东医药,2014,54(36):30-32.
[13] Rein DT, Schmidt T, Bauerschmitz G, et al. Treatment of endometriosis with a VEGF-targeted conditionally replicative adenovirus[J]. Fertil Steril, 2010,93(8):2687-2694.
[14] De Francesco EM, Pellegrino M, Santolla MF, et al. GPER mediates activation of HIF1α/VEGF signaling by estrogens[J]. Cancer Res, 2014,74(15):4053-4064.
[15] Catar R, Witowski J, Wagner P, et al. The proto-oncogene c-Fos transcriptionally regulates VEGF production during peritoneal inflammation[J]. Kidney Int, 2013,84(6):1119-1128.
中图分类号:R711.71
文献标志码:B
文章编号:1002-266X(2016)08-0063-03
doi:10.3969/j.issn.1002-266X.2016.08.025
通信作者:张萍(E-mail: shxinhuazp@163.com)
基金项目:国家自然科学基金青年科学基金资助项目(81100410);上海市自然科学基金资助项目(10ZR1420200)。
