胃癌组织TRAF3、TRAF6阳性表达及意义
2016-04-18刘鹏军石红建张利霞张中平薛志新葛亚强许丽娟江苏大学附属武进医院江苏常州213002
刘鹏军,石红建,张利霞,张中平,薛志新,葛亚强,许丽娟(江苏大学附属武进医院,江苏常州213002)
胃癌组织TRAF3、TRAF6阳性表达及意义
刘鹏军,石红建,张利霞,张中平,薛志新,葛亚强,许丽娟(江苏大学附属武进医院,江苏常州213002)
摘要:目的探讨胃癌组织肿瘤坏死因子受体相关因子3(TRAF3)、肿瘤坏死因子受体相关因子6(TRAF6)阳性表达与肿瘤浸润、转移的关系。方法选择胃癌组织及配对癌旁正常组织标本各87份。制作组织芯片,采用免疫组化微阵列技术检测TRAF3、TRAF6表达,分析TRAF3、TRAF6阳性表达与胃癌浸润、转移的关系。结果胃癌组织TRAF3阳性表达率明显低于癌旁正常组织(P<0.01),TRAF6阳性表达高于癌旁正常组织(P<0.05)。TRAF3阳性表达与胃癌组织分化程度、TNM分期、淋巴结转移有关(P均<0.05),TRAF6阳性表达与胃癌组织分化程度、TNM分期有关(P均<0.05)。结论胃癌组织TRAF3阳性表达下调、TRAF6阳性表达上调,其表达变化可能参与胃癌的浸润及转移。
关键词:胃癌;肿瘤坏死因子受体相关因子;组织微阵列技术;免疫组织化学
近年来胃癌的发病率呈逐年上升趋势。多数胃癌患者起病隐匿,就诊时已有浸润及转移[1,2]。临床研究发现,肿瘤浸润及转移与多种因子密切相关,如肿瘤坏死因子受体家族。肿瘤坏死因子受体相关因子3(TRAF3)能促进细胞凋亡[3,4];肿瘤坏死因子受体相关因子6(TRAF6)可与某些蛋白配体特异性结合,阻断该配体诱导的肿瘤细胞凋亡[5,6]。但胃癌组织TRAR3、TRAR6表达与胃癌浸润、转移的关系鲜见报道。为此,我们进行了如下研究。
1资料与方法
1.1临床资料 选择2008年10月~2012年9月在我院行胃癌根治术的胃癌患者87例,男48例、女39例,年龄45~80岁、平均56.3岁。术前未行放化疗,且未服用任何靶向治疗药物。所有患者经术后组织病理学检查明确诊断,TNM分期:Ⅰ、Ⅱ期40例,Ⅲ、Ⅳ期47例;有淋巴转移44例,远处转移46例。
1.2胃癌组织TRAF3、TRAF6表达检测采用组织微阵列技术。所有患者术后留取胃癌组织及癌旁正常组织,制备行HE染色的组织蜡块,并在蜡块上进行靶点标记[7]。借助Beecher(微阵列制作仪)钻取靶点组织,并转移至相应蜡块的位孔。按照试剂盒说明进行HE染色,确定微阵列中的组织样本与形态学特征。TRAF3、TRAF6阳性主要定位于细胞质内,为棕黄色染色颗粒,阳性细胞分布呈弥散性片状或散在分布。阳性判定:结果由两位病理科医师采用盲法判定。根据染色面积和染色强度综合计分。染色面积:<2%为0分,≥2%~<25%为1分,≥25%~<50%为2分,≥50%~<75%为3分,≥75%为4分。染色强度:无染色为0分,浅棕黄色为1分,棕黄色为2分,棕褐色为3分。总分<2分为阴性,≥2~<4分弱阳性,≥4~<8分为阳性,≥8~<12分为强阳性。
1.3统计学方法采用SPSS17.0统计软件。计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2结果
2.1胃癌组织及癌旁正常组织TRAF3、TRAF6阳性表达比较胃癌组织中TRAF3阳性表达率为16.1%(14/87),癌旁正常组织为74.7%(65/87),二者比较P<0.01;胃癌组织中TRAF6阳性表达率为69.0%(60/87),癌旁正常组织为34.5%(30/87),二者比较P<0.05。
2.2胃癌组织TRAF3、TRAF6阳性表达与患者临床病理参数的关系TRAF3、TRAF6阳性表达与胃癌患者性别、年龄均无关。TRAF3阳性表达与组织分化程度、TNM分期、淋巴结转移有关(P均<0.05),TRAF6阳性表达与组织分化程度、TNM分期有关(P均<0.05)。见表1。
3讨论
组织微阵列技术最早由Kononen于1998年报道,该技术具有高通量、大样本、可信度较高等优点[8]。目前已广泛用于肿瘤标记物的筛选,对肿瘤分子诊断及治疗靶点定位等具有重要意义[9,10]。
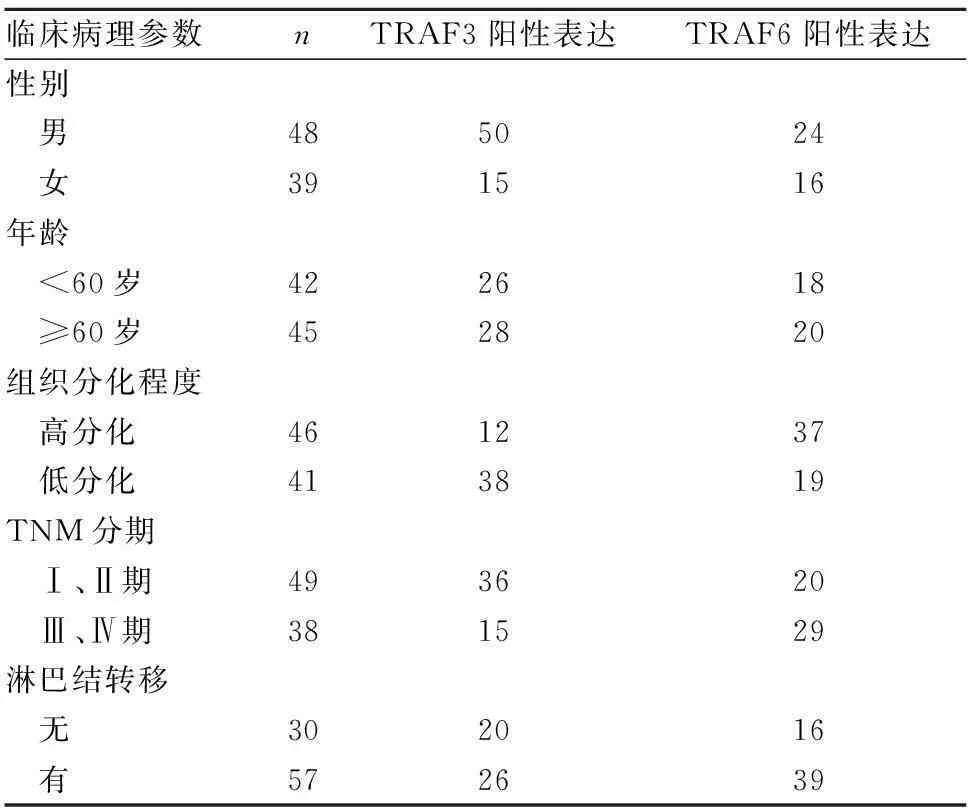
表1 胃癌组织TRAF3、TRAF6阳性表达与患者
TRAF3、TRAF6均为肿瘤坏死因子受体家族成员。临床研究表明,TRAF3、TRAF6表达变化与多种恶性肿瘤的发生、发展密切相关,如肝癌、膀胱癌等[11,12]。TRAF3可通过调控TNF受体家族信号通路与NF-κB信号通路,促进肿瘤细胞凋亡[13]。TRAF3还可在TLR4信号通路调控中发挥重要作用。如TRAF3可负向调控MAPK信号通路,阻断JNK与p38磷酸化,进而参与肿瘤细胞凋亡。此外,TRAF3还可抑制TRAF2与TRAF5介导的NF-κB信号通路,参与肿瘤细胞凋亡。TRAF6与某些蛋白配体特异性结合,竞争性抑制配体诱导的肿瘤细胞凋亡[14]。研究表明,骨肉瘤组织TRAF6表达高于正常组织,且伴肺转移的骨肉瘤患者较未发生转移的患者水平升高,说明TRAF6可能与骨肉瘤细胞的侵袭有关[15]。TRAF6高表达的食管癌细胞株EC109经小分子RNA干扰技术沉默后,细胞增殖受到显著抑制,细胞凋亡进程加快。此外,晚期非小细胞肺癌患者TRAF6表达上调,且与化疗疗效呈负相关[16]。但目前TRAF3、TRAF6在胃癌组织中的表达鲜见报道,其与转移及预后的关系也不明确。
本研究采用组织微阵列技术检测胃癌组织TRAF3、TRAF6表达。结果显示,与癌旁正常组织比较,胃癌组织TRAF3阳性表达下调、TRAF6阳性表达上调;TRAF3阳性表达与胃癌组织分化程度、TNM分期、淋巴结转移有关,TRAF6阳性表达与胃癌组织分化程度、TNM分期有关。由此推测,胃癌组织TRAF3阳性表达下调、TRAF6阳性表达上调可能参与抑制胃癌细胞凋亡,进而促进胃癌的浸润及转移。
综上所述,胃癌组织TRAF3阳性表达下调、TRAF6阳性表达上调,其表达变化可能与胃癌浸润及转移有关。
参考文献:
[1] Gotoda T. Endoscopic resection of early gastric cancer[J]. Gastric Cancer, 2007,10(1):1-11.
[2] Roder DM. The epidemiology of gastric cancer[J]. Gastric Cancer, 2002,5(1):5-11.
[3] Marsters SA, Sheridan JP, Donahue CJ, et al. Apo-3, a new member of the tumor necrosis factor receptor family, contains a death domain and activates apoptosis and NF-kappa B[J]. Curr Biol, 1996,6(12):1669-1676.
[4] Liao G, Zhang M, Harhaj EW, et al. Regulation of the NF-kappaB-inducing kinase by tumor necrosis factor receptor-associated factor 3-induced degradation[J]. J Biol Chem, 2004,279(25):26243-26250.
[5] Yu KY, Kwon B, Ni J, et al. A newly identified member of tumor necrosis factor receptor superfamily (TR6) suppresses LIGHT-mediated apoptosis[J]. J Biol Chem, 1999,274(20):13733-13736.
[6] Bradley JR, Pober JS. Tumor necrosis factor receptor-associated factors (TRAFs)[J]. Oncogene, 2001,20(44):6482-6491.
[7] Kononen J, Bubendorf L, Kallioniemi A, et al. Tissue microarrays for high-throughput molecular profiling of tumor specimens[J]. Nat Med, 1998,4(7):844-847.
[8] Kallioniemi OP, Wagner U, Kononen J, et al. Tissue microarray technology for high-throughput molecular profiling of cancer[J]. Hum Mol Genet, 2001,10(7):657-662.
[9] Torhorst J, Bucher C, Kononen J, et al. Tissue microarrays for rapid linking of molecular changes to clinical endpoints[J]. Am J Pathol, 2001,159(6):2249-2256.
[10] Petrocca F, Visone R, Onelli MR, et al. E2F1-regulated microRNAs impair TGFbeta-dependent cell-cycle arrest and apoptosis in gastric cancer[J]. Cancer Cell, 2008,13(3):272-286.
[11] Georgopoulos NT, Steele LP, Thomson M, et al. A novel mechanism of CD40-induced apoptosis of carcinoma cells involving TRAF3 and JNK/AP-1 activation[J]. Cell Death Differ, 2006,13(10):1789-1801.
[12] Häcker H, Vabulas RM, Takeuchi O, et al. Immune cell activation by bacterial CpG-DNA through myeloid differentiation marker 88 and tumor necrosis factor receptor-associated factor (TRAF) 6[J]. J Exp Med, 2000,192(4):595-600.
[13] Baud V, Karin M. Signal transduction by tumor necrosis factor and its relatives[J]. Trends Cell Biol, 2001,11(9):372-377.
[14] Takeda K, Stagg J, Yagita H, et al. Targeting death-inducing receptors in cancer therapy[J]. Oncogene, 2007,26(25):3745-3757.
[15] Meng Q, Zheng M, Liu H, et al. TRAF6 regulates proliferation, apoptosis, and invasion of osteosarcoma cell[J]. Mol Cell Biochem, 2012,371(1):177-186.
[16] Liu H, Zhang T, Ye J, et al. TNF receptor-associated factor 6 in advanced non-small cell lung cancer: clinical and prognostic implications[J]. J Cancer Res Clin Oncol, 2012,138(11):1853-1863.
(收稿日期:2015-09-15)
中图分类号:R735.2
文献标志码:B
文章编号:1002-266X(2016)08-0042-02
doi:10.3969/j.issn.1002-266X.2016.08.016
基金项目:常州市武进区科技项目(WS201421)。
