治疗性抗体纯化色谱填料
2016-04-16孙国威刘晓庆杨蒙蒙无锡加莱克色谱科技有限公司无锡214092
孙国威 刘晓庆 杨蒙蒙 穆 宁(无锡加莱克色谱科技有限公司,无锡 214092)
治疗性抗体纯化色谱填料
孙国威 刘晓庆 杨蒙蒙 穆 宁
(无锡加莱克色谱科技有限公司,无锡 214092)

孙国威,硕士,毕业于江南大学食品学院,后于无锡加莱克色谱科技有限公司工作至今,主要从事生物层析介质应用开发工作。
E-mail:guowei.sun@galak-tech.com

穆宁,1992年获美国普渡大学化学博士学位。在普渡大学求学期间,师从世界著名液相色谱专家Fred Regnier教授,从事用于单克隆抗体分离的大孔聚苯乙烯微球液相色谱填料合成和表面化学研究,以及高纯度球形多孔硅胶合成和表面化学研究,对世界著名的贯流色谱技术的发展做出了突出贡献。并先后在美国著名企业PerSeptive Biosystems、Applied Bisystems、Perkin Elmer、Vydac和W.R.Grace从事研发工作。2009年回国后组建了创业团队,创办了无锡加莱克色谱科技有限公司。
E-mail:ning.mu@galak-tech.com
以蛋白A亲和色谱为核心的纯化技术在治疗性单抗工业生产中通常是第一个步骤。离子交换、疏水和混合型色谱技术作为精制手段也得到了广泛应用。文章以较短的篇幅简单介绍了各种用于治疗性单抗工业生产的色谱填料的特性和使用方法。
治疗性单抗经过近30年的发展,在生物医药领域已经占据了举足轻重的地位。像所有生物药物一样,它们必须经过液相色谱纯化。从现有的纯化流程来看,可以分为由蛋白A亲和色谱主导和由非蛋白A亲和色谱组合两个类别。毫无疑问,前者占据了统治性地位。这种现象的出现主要归因于蛋白A亲和色谱的高倍数纯化效果。通常,大部分高分子量抗体分子聚集体、宿主细胞蛋白和蛋白A亲和色谱填料产生的泄漏蛋白A、宿主细胞DNA均可在蛋白A亲和色谱这一步除去,得到纯度高达90%的单抗溶液,由于亲和色谱本身所具备的浓缩效应,所需处理的样品体积也成倍地减小,这些都是有利于下面的精制色谱步骤的重要因素。大量使用亲和色谱和它所带来的巨大成功在生物制药工业领域是一个创举。但是业内人士同时也指出:治疗性单抗的工业生产上游技术的发展速度高于下游技术,使得下游纯化成为整个流程的瓶颈。如何更加快速高效完成纯化对蛋白A亲和色谱填料的动态载量(dynamic binding capacity,DBC)提出了更高要求。此外,蛋白A亲和色谱填料价格很高,通常是其他色谱填料的10倍或更多,占了整个生产所需耗材成本的25%左右,这一点对发展中国家是一个不小的挑战。现在市场上各种品牌的色谱填料种类很多,容易让使用者产生困惑。本文试图将蛋白A亲和色谱填料以及与之配套使用的色谱填料的基本使用范围做一个梳理,供读者参考。
1 蛋白A亲和色谱填料
1.1 蛋白A配基
源于金黄色葡萄球菌(stapgylococcus aureus)细胞壁的天然蛋白A在20世纪60年代被发现。
1972年,科学家们发表了有关天然蛋白A的进一步研究,揭示了它的结构和对IgG分子的特异识别,并在此基础上,首次提出了将天然蛋白A偶联到色谱填料上制成亲和色谱填料的概念①。天然蛋白A的分子量约为42 000Da,1977年的文献报道了它的N端和C端功能迥异:在N端,存在4个结构域(从N端起依次为D、A、B、C),每个结构域约为7000Da,这些结构域都具有与抗体分子Fc部分结合的能力;而C端的15 000Da的部分完全不具备Fc结合能力,其功能是使天然蛋白A分子能够结合到金黄色葡萄球菌的细胞壁上②③。20世纪80年代,蛋白A的氨基酸序列全部揭晓,能够在大肠杆菌中实现蛋白A表达的基因克隆被首次发表④。同时,N端第5个Fc识别结构域E也被发现⑤。这些坚实的成果奠定了应用基因工程方法规模化生产蛋白A的基础,美国Repligen公司首先实现了重组蛋白A的生产。20世纪90年代,美国FDA要求用于治疗性单抗纯化色谱填料采用的蛋白A配基不能与动物源的任何分子产生接触,这一要求改变了蛋白A的生产流程和纯化方法。现在,天然蛋白A已经退出了治疗性单抗纯化色谱填料配基市场。另一个引起人们高度关注的研究结果是基因工程方法制成的具有耐碱结构的蛋白A,它是由4个或5个改造过的B结构域(叫做Z结构域)组合制成。其中,对B结构域中不稳定的天冬酰胺-赖氨酸二肽改造为天冬酰胺-丙氨酸二肽⑥。这一成果奠定了在强碱条件下比较稳定的蛋白A构建的基础,对工业生产中实现直接使用氢氧化钠溶液作为在位清洗(clean-in-place,CIP)具有重大意义。有2个或多个C结构域的蛋白A也是多个研究机构和公司的研发对象,结果已经公布⑦。在蛋白A与抗体分子的特异识别机理方面的探索也有了进展⑧。研究发现,IgG分子的Fc部分存在较为稳定的含组氨酸的结构,而蛋白A的IgG分子识别结构域中也存在类似的稳定组氨酸结构,两者的咪唑分子能够实现面对面的排列,在中性pH条件下,两者的咪唑分子都没有带电荷,咪唑环之间的疏水作用对蛋白A和IgG的非共价键结合起到了加强作用,氢键的形成也促进了蛋白A与IgG分子的结合。在pH下降到酸性条件时,两者组氨酸的咪唑环呈完全带电荷的状态,彼此相斥,使蛋白A和IgG的非共价键结合体分开⑨。也有文献报道蛋白A与人类IgG的不同亚型的亲和力存在差别。一般说来,蛋白A对人的IgG1 和IgG4结合力强于IgG2,而对IgG3的结合力最差。研究发现,IgG的糖基化程度对其和蛋白A的结合没有影响⑩。理论上,由于蛋白A具有4个或5个识别IgG分子的结构域,蛋白A应该可以同时与4个或5个IgG分子结合,但实际上,这种现象不可能实现。文献报道,在溶液中,每个蛋白A只能与平均“2.0~3.3”个IgG分子结合,这说明不是每个结构域都能够同时与IgG分子产生相互作用⑪⑫。当蛋白A偶联到色谱填料表面上时,每个蛋白A分子可能同时作用的IgG分子数目会更少。
参考文献① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑪ ⑫ ⑬ ⑭ ⑮ ⑯ ⑰ ⑱ ⑱ ⑳ ㉑ ㉒ ㉓ ㉔ ㉕ ㉖ ㉗ ㉘ ㉙ ㉚ ㉛ ㉜ ㉝ ㉞ ㉟ ㊱ ㊲ ㊳ ㊴ ㊵ ㊶ ㊷ ㊸ ㊹ ㊺ ㊻ ㊼ ㊽ ㊾ ㊿
BJÖRK I,PETERSSON B A,SJÖQUIST J.Some physicochemical properties of protein A from Staphylococcus aureus.European Journal of Biochemistry,1972,29(29):579-584.
SJÖDAHL J.Repetitive sequences in protein A from Staphylococcus aureus.arrangement of five regions within the protein,four being highly homologous and Fc-binding.European Journal of Biochemistry,1977,73(2):343-351.
SJÖDAHL J.Structural studies on the four repetitive units Fc-binding regions in protein A from Staphylococcus aureus.European Journal of Biochemistry,1977,78(2):471-490.
LÖFDAHL S,GUSS B,UHLEN M,et al.Gene for staphylococaal protein A.Proceedings of the National Academy of Sciences of the United States of America,1983,80(3):697-701.
GUSS B,UHLÉN M,NIL SSON B,et al.Region X,the cell-wall-attachment part of staphylococcal protein A.European Journal of Biochemistry,1984,138(2):413-420.
NILSON B,MOKS T,JANSSON B,et al.A synthetic lgG-binding domain based on staphylococcal protein A.Protein Engineering,1987,1(2):107-113.
通用电气健康护理生物科学股份公司.用于抗体分离的色含来自金黄色葡萄球菌A蛋白的结构域C的层析配体:中国,200780036281.4.2009-09-02.
DIENSENHOFER J.Crystallographic refinement and atomic models of a human Fc fragment and its complex with fragment B of protein A from Staphylococcus aureus at 2.9 and 2.8 A resolution.Biochemistry,1981,20(9):2361-2370.
LI R,DOWD V,STEWART D,et al.Design,synthesis and application of a protein A mimetic.Nature Biotechnology,1998,16(2):190-195.
⑩ 参考文献
LEATHERBARROW R,DWEK R.The effect of glycosylation on the binding of mouse IgG to staphylococcal protein A.FEBS Letters,1983,164(2):227-230.
JUNGBAUER A,HAHN R.Engineering protein A affinity chromatography.Current Opinion in Drug Discovery and Development,2004,7(2):248-256.
GHOSE S,HUBBARD B,CRAMER S M.Binding capacity differences for anti-bodies and Fc-fusion proteins on protein A chromatographic materials.Biotechnology and Bioengineering,2007,96(4):768-779.
MCCUE J T,KEMG G,LOW D,et al.Evaluafion of protein A chromatography media.Journal of Chromatography A,2003,989(1):139-153.
LOW D,O’LEARY R,PUJAR N S.Future of antibody puri fi cation.Journal of Chromatography B,2007,848(1):48-63.
HAN R,WANG G F,QI S D,et al.Electrophoretic migration and axial diffusion of individual nanoparticles in cylindrical nanopores.The Journal of Physical Chemistry C,2012,116(34):18460-18468.
HAHN R,SCHLEGEL R,JUNGBAUER A.Comparison of protein A af fi nity sor-bents.Journal of Chromatography B,2003,790(1-2):35-51.
HAHN R,SHIMAHARA K,STEINDL F,et al.Comparison of protein A affinity sorbents Ⅲ.life time study.Journal of Chromatography A,2006,1102(1):224-231.
STABY A,JENSEN I H,MOLLERUP I.Comparison of chromatographic ion-exchange resins.Ⅰ.srtong anion-exchange resins.Journal of Chromatography A,2000,897(1-2):99-111.
STABY A,JENSEN I H.Comparison of chromatographic ion-exchange resins.Ⅱ.more strong anion-exchange resins.Journal of Chromatography A,2001,908(1-2):149-161.
1.2 蛋白A亲和色谱填料的主要种类
目前,GE Haelthcare、Merck-Millipore和Thermo3个公司的蛋白A亲和色谱填料产品在美国治疗性单抗的工业生产中得到了应用。这些产品在基材和采用的蛋白A配基性质上迥异,造成它们在耐压性能、动态载量和所能够承受CIP条件上有明显不同,由此对生产效率产生影响。
1.2.1 GE Healthcare公司的产品
该公司早期是瑞典Pharmacia公司,所有蛋白A亲和色谱填料产品由琼脂糖经过交联制成。早期的产品是rProtein A Sepharose,由多孔琼脂糖微球制成,交联度较低,耐压不超过2个大气压,使用时必须严格控制操作压力,属于典型的可压缩型填料。这个产品使用的是重组蛋白A,通过位于C端的半胱氨酸与CNBr活化的琼脂糖多孔微球以硫醚键偶联。这种偶联方式后来被不断改进,蛋白A通过单个硫醚键与活化臂相连,保证蛋白A的N端向外的伸展,从而增加与抗体分子的接触机会。使用CNBr活化虽然有效,但必须使用有毒化学品,操作危险性较高。
与rProtein A Sepharose FF产品一样,20世纪后推出的MabSelect仍然使用重组蛋白A,但活化臂改为含醚结构的环氧化合物,重组蛋白A通过位于C端的半胱氨酸与环氧基团活化臂以硫醚键偶联。通过增加交联度,MabSelect的耐压稍有提高,达到3个大气压以上。MabSelect Xtra是MabSelect的改进版,它的配基密度更高,所以动态载量更高,但在耐压性能上没有改观。
MabSelect SuRe是继MabSelect Xtra以后推出的产品,它所采用的琼脂糖微球和MabSelect Xtra一样,与众不同之处是采用了前面提到过的将4个Z结构域组合而成的耐碱蛋白A。由于可以用0.1~0.5mol/L NaOH溶液做CIP,简化了生产步骤。它是第一个此类产品。
1.2.2 Merck-Millipore公司的产品
该公司的产品冠以ProSep A商标。虽然Merck-Millipore公司在不断开发新产品,如近几年推出的P VA基材的Eshmuno,但真正用于治疗性单抗的还是源于BioProcessing公司的蛋白A亲和色谱填料产品。BioProcessing曾是一个英国公司,后来被Millipore收购。这个系列产品的确有特独之处。从颗粒的形状上就可见一斑,是基于多孔玻璃(control pore glass,CPG)基材。这种材料是用特殊工艺破碎的玻璃颗粒经过筛分得到具有一定分布范围的玻璃颗粒,完全是不规则形状的,而玻璃颗粒上面的孔是由化学方法处理得到的。ProSep-vA的孔径为100nm,而ProSep-vA Ultra的孔径为70nm。后者由于采用了较小孔径,获得了较高比表面积,能够负载更多的蛋白A⑬。通过没有对外公布的专有技术去除玻璃表面的非特异蛋白吸附,优点是能够在较高流速下使用,提高了单位时间内单位柱体积填料的产能。但多孔玻璃在碱性条件下不稳定,ProSepA系列产品不能够使用碱性CIP。由于该填料为形状不规则的玻璃颗粒,装柱过程中除了加压外,还需要使用震荡器形成稳定的柱床。
1.2.3 Thermo公司的产品
该公司的产品以POROS为商标,于20世纪90年代推出,与其他POROS产品一样,采用贯流色谱的理念设计了聚苯乙烯-二乙烯基苯(polystyrenedivinylbenzene,PS-DVB),其特点是微球中除了孔径80nm左右的微孔外,还含有贯穿孔,减低了微球内的孔内传质障碍。此外,采用表面涂覆富含羟基的化合物去除了聚苯乙烯-二乙烯基苯的非特异蛋白吸附。
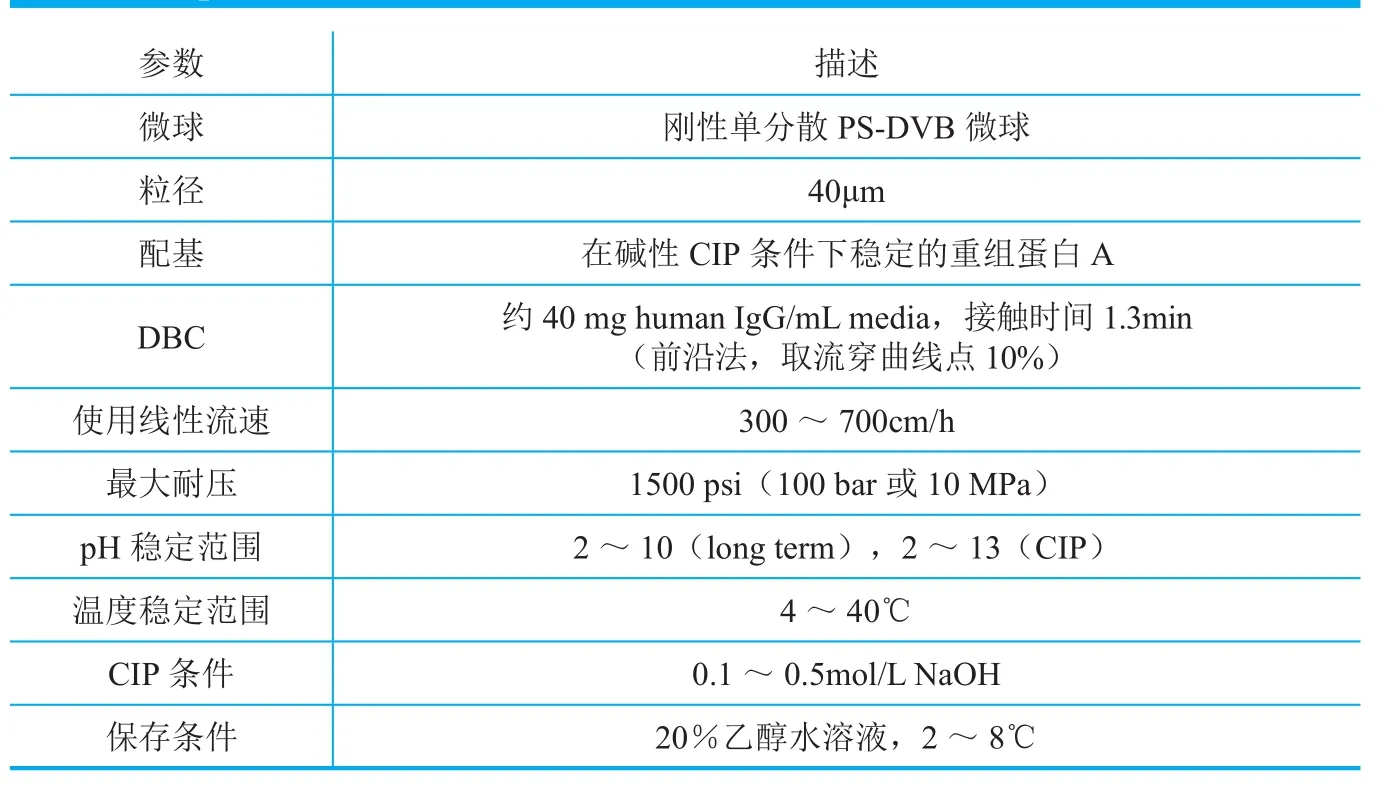
表1 Sepromax®A40 Plus性能参数
1.3 动态载量
抗体分子的亲和纯化都是在一定流速下进行的,所以用动态载量(dynamic binding capacity,DBC)来表征一种蛋白A亲和填料在某种流速或接触时间(residence time,RT)条件下,单位体积能够“捕获”多少抗体分子,具有直接的实际意义。为了能够提高亲和色谱的效率,研究人员认为最佳的情形是在较短的接触时间条件下得到较高的动态载量⑭。然而,这两者之间有着不可兼得的矛盾,较高的动态载量常常需要较长的接触时间才能获得,其中的主要问题是抗体分子在填料孔内的传质障碍,这是液相色谱,特别是大规模制备色谱面临的最大挑战之一,也是科学家多年来力图解决的难题。液相色谱流速与谱带展宽的基础van Deemter公式中的C相以及后来在此基础上建立的理论对此给出了详尽描述。
van Deemter公式:
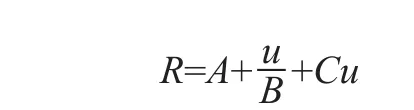
其中,R是谱带展宽的度量;u是流速;A和B为常量,与流速无关,在大规模制备中可以忽略;C相为与传质障碍相关的系数。可见流速增高,Cu项也增高,对谱带展宽的贡献增大。无锡加莱克色谱科技有限公司(以下简称加莱克或Galak)在这个领域做了新的尝试。该公司推出的Sepromax®A40 Plus蛋白A亲和色谱填料的主要参数如表1所示。该填料使用了与POROS系列类似的表面亲水处理。由于大多数蛋白A分子都是偶联到填料的孔内,抗体分子必须扩散到孔内才能与蛋白A产生相互作用。抗体分子的分子量高于150kDa,扩散速率较低。Yeung等⑮在2012年发表了类似蛋白分子在色谱填料孔内扩散模拟实验的结果,表面类蛋白分子在色谱填料孔内扩散速率较溶液中慢20倍。综合这一研究结果和前人的工作,加莱克的研究人员使用粒径高度均一的微球作为基材,能够保证微球间的孔隙高度一致,由此推理,使用此类微球,在保证一定反压时,所用微球粒径将是最小的,即孔内扩散的路径长度降至最低且是几乎一致,孔内扩散是同步化的。使用粒径分布很宽的填料,如MabSelect SuRe,孔内抗体分子的扩散则是非同步的(图1)。如果这类微球的孔径足够大,抗体分子扩散至微球中心的传质障碍将下降至最低,将实现在较低接触时间获得较高动态载量的目标。加莱克的实验结果证实了这一点。在同样试验条件下,获得40mg/mL动态载量,MabSelect SuRe需要2.4min的接触时间,而采用均一微球的Sepromax A40 Plus只需要1.3min接触时间(图2)。

图1 部分蛋白A亲和色谱填料的显微镜照片

图2 动态载量与接触时间的关系
STABY A,SAND M B,HANSEN R G,et al.Comparison of chromatographic ion-exchange resins.Ⅲ.strong cation-exchange resins.Journal of Chromatography A,2004,1034(1):85-97.
STABY A,SAND M B,HANSEN R G,et al.Comparison of chromatographic ion-exchange resins.IV.strong and weak cation-exchange resins and heparin resins.Journal of Chromatography A,2005,1069(1):85-97.
STABY A,JACOBSEN J H,HANSEN R G,et al.Compari-son of chromatographic ionexchange resins.V.strong and weak cationexchange resins.Journal of Chromatography A,2006,1118(2):168-179.
STABY A,JACOBSEN R H,BENSCH M,et al.Comparison of chromatographic ion-exchange resins.VI.weak anion-exchange resins.Journal of Chromatography A,2007,1164(1-2):82-94.
COFFMAN J,KELLEY B,KRAMARCZYK J.High-throughput screening of resins and excipients for optimization of selectivity.// Presentation at Recovery of Biological Products XI,Banff,2003.
CURLING J.The development of antibody puri fi cation technologies//Process Scale Puri fi cation of Antibodies,Wiley,2008:25-52.
CURTIS S,LEE K,BLANK G S,et al.Generic/matrix evaluation of SV40 clearance by anion exchange chromatography in flow-through mode.Biotechnology and Bioengineering,2003,84(2):179-186.
KELEY B D,TOBLER S A,BROWN P,et al.Weak partitioning chromatography for anion exchange purification of monoclonal antibodies.Biotechnology and Bioengineering,2008,101(3):553-566.
KELLEY B.Very large scale monoclonal antibody puri fi cation:the case for conventional unit operations.Biotechnology Progress,2007,23(5):995-1008.
1.4 去除宿主细胞蛋白质和DNA的能力
经过20年的技术进步和工艺开发,治疗性抗体的工业化纯化流程已经基本实现了“模块化”,即由亲和、离子交换和疏水等方法合理搭建而成。大多数纯化流程的第一步是蛋白A亲和色谱法,该方法中蛋白A只捕获抗体分子,因而具有优异的去除宿主细胞蛋白质(host cell proteins,HCP)和DNA的能力。使用ELISA方法能够准确测定样品上清液和经过蛋白A亲和色谱纯化以后洗脱液中HCP含量,表2给出Sepromax®A40 Plus与某品牌产品在HCP纯化效率方面的比较数据。
测试DNA杂质的方法也已经非常成熟,表3给出Sepromax®A40 Plus与某品牌产品在DNA纯化效率方面的比较数据。
残留宿主细胞蛋白质、DNA、脱落的蛋白A分子、表达过程中产生的抗体片段、病毒以及内毒素等等还必须经过蛋白A亲和法以后的精制纯化手段才能达到最终纯度要求。

表2 Sepromax®A40 Plus去除宿主细胞蛋白质的结果

表3 Sepromax®A40 Plus去除DNA的结果
1.5 蛋白A配基脱落
所有蛋白A亲和色谱填料在与抗体分子接触后的洗脱过程都会产生蛋白A配基脱落。脱落的蛋白A通常与目标抗体同时洗脱,这也是使用蛋白A亲和色谱纯化抗体遇到的问题之一。脱落的分子既可以是蛋白A整体,也可以是蛋白A分子的片段,分子量在6k~40kDa⑯,但脱落程度不同。有文献报道,ProSep-vA Ultra的脱落量高于MabSelect SuRe,而且在多次重复的纯化过程中,ProSep-vA Ultra的脱落量呈现开始高、中间低、后程再升高的情况⑰
。MabSelect SuRe由于使用了单个共价键偶联蛋白A,表现出较低的脱落量,因此从稳定性方面看,使用单个共价键偶联蛋白A的方法并不比多个共价键偶联蛋白A的方法差,那么后者优于前者的说法不攻自破。多孔玻璃基材的ProSep-vA Ultra在酸性洗脱抗体时出现脱落量较高的情形,而多孔玻璃基材本身在酸性条件下是稳定的,所以蛋白A脱落应该与基材分解无关,可能与蛋白A结构有关。蛋白A脱落的机理并不明确,仍需进一步研究。
以上所提到的各种蛋白A亲和色谱填料的简介见表4。
GAGNON P.Purification tools for monoclonal antibodies.Validated Biosystems,Tucson,1996.
STEIN A,KIESEWETTER A.Cat-ion exchange chromatography in antibody puri fi cation:pH screening for optimized binding and HCP removal.Journal of Chromatography B,2007,848(1):151-158.
DUNN L,ABOUELEZZ M,CUMMINGS L,et al.Characterization of synthetic macroporous ion-exchange resins in low-pressure cartridges and columns.Evaluation of the performance of Macro-Prep 50 S resin in the puri fi cation of anti-Klenow antibodies from goat serum.Journal of Chromatography,1991,548(1-2):165-178.
SHUKLA A A,HAN X S.Screening of chromatographic stationary phases// SHUKLA A A,ETZEL M R,GADAM S.Process Scale Bioseparations for the Biopharmaceutical Industry,CRC,2007:227-244.
HARINARAYAN C,MUELLER J,LJUNGLOF A,et al.An exclusion mechanism in ion exchange chromatography.Biotechnology and Bioengineering,2006,95(5):775-787.
BURTON S,HARDING D.Hydrophobic charge induction chromatography:salt independent protein adsorption and facile elution with aqueous buffers.J Chromatography A,1998,814(1-2):71-81.
MOUNTFORD S J,DALY R,ROBINSON A J,et al.Design,synthesis and evaluation of pyridine-based chromatography sorbents for antibody puri fi cation.J Chromatography A,2014,1355:15-25.
QING-HONG S,ZHENG C,YAN S.4-(1H-imidazol-1-yl) aniline:a new ligand of mixed-mode chromatography for antibody puri fi cation.J Chromatography A,2009,1216(33):6081-6087.
2 离子交换色谱填料
如果采用蛋白A亲和色谱作为纯化流程的第一步,那么接下来使用离子交换(ion exchange,IEX)色谱作为精制的第一步是较为常见的模式。离子交换色谱法的基本原理是基于色谱填料表面的离子基团与目标分子所携带的粒子之间的相互作用,利用这种相互作用的差异即可达到分离纯化的目的。诸多因素可以影响离子交换色谱对抗体分子的分离效果,如选用哪一种离子交换填料(阳离子交换或阴离子交换可进一步细分为强阳离子交换和弱阳离子交换、强阴离子交换和弱阴离子交换)、填料表面离子基团密度和离子基团的三维分布、基材类型、孔隙率和孔径等。所有这些因素都必须仔细考察⑱~㉔。在治疗性单抗的工业纯化实践中,虽然较为罕见,但确有直接采用离子交换色谱法取代蛋白A的成功实例㉕。限于篇幅,本文不做详细介绍。

表4 部分应用于治疗性单抗纯化的蛋白A亲和色谱填料
LIU T,LIN D Q,ZHANG Q L,et al.Characterization of immunoglobulin adsorption on dextran-grafted hydrophobic charge-induction resins:cross-effects of ligand density and pH/salt concentration.J Chromatography A,2015,1396:45-53.
GUERRIER L,GIROT R,SCHWARTZ W,et al.New method for the selective capture of antibodies under physiological conditions.Bioseparation,2000,9(4):211-221.
GHOSE S,HUBBARD B,CRAMER S M.Evaluation and comparison of alternatives to protein A chromatography:mimetic and hydrophobic charge-induction chromatographic stationary phases.J Chromatography A,2006,1122(1):144-152.
BOSCHETTI E.The use of thiophilic chromatography for antibody puri fi cation:a review.J Biochem Biopham Methods,2001,49(1-3):361-389.
CHEN J,TETRAULT J,LEY A.Comparison of standard and new generation hydrophobic interaction chromatography resins in the monoclonal antibody purification process.J Chromatography A,2008,1177(2):272-281.
程华,闫静辉,吴萌,等.盐析与疏水电荷诱导层析相结合快速纯化单克隆抗体.细跑与分子免疫学杂志,2007,22(6):809-810.
庄甜甜,夏海锋,林东强,等.混合模式吸附层析从猪血浆中分离免疫球蛋白.化工学报,2010(2):336-341.
XIA H F,LIN D Q,CHEN Z M,et al.Influences of ligand structure and pH on the adsorption with hydrophobic charge induction adsorbents:a case study of antibody IgY.Sep Sci Technol,2011,46(12):1957-1965.
XIA H F,LIN D Q,CHEN Z M,et al.Purification of immtmoglobulin of egg yolk with hydrophobic charge induction chromatography:comparison of operation modes with packed bed and expanded bed.Sep Sci Technol,2012,47(16):2366-2372.
2.1 阴离子交换色谱填料
阴离子交换法(anion exchange,AEX)是最常用的单抗精制纯化方法之一。由于治疗性单抗的等电点通常较高,在pH为7~7.5的缓冲液条件下,单抗分子不会与阴离子交换色谱填料产生任何离子间的相互作用,通常称为流穿模式(flow-through mode)。而杂质,如DNA、宿主细胞蛋白质和内毒素在这个pH范围都带有负电荷,与阴离子交换色谱填料产生较强的离子相互作用,保留在色谱柱上。如果使用pH更高的缓冲液,单抗可以带足够的负电荷,将保留在阴离子交换色谱柱上,称之为结合模式(binding mode)。但是,过高的pH,有导致单抗分子产生变异的可能性,所以结合模式的使用率少于流穿模式。阴离子交换法在流穿模式下还能够去除病毒㉖,但它的不足之处在于对去除单抗分子多聚体和脱落的蛋白A分子效果不佳。在流穿模式下,由于蛋白A亲和色谱步骤已经大幅度地去除了DNA和宿主细胞蛋白质,要求阴离子交换色谱填料对这些杂质分子有很强的吸附能力,但并不需要很高的动态载量。对于在较高pH条件下仍能保持稳定性的单抗,可以考虑采用结合模式。被称之为弱配分色谱法(weak-partitioning chromatography,WPC)是一种新的结合模式精制单抗的方法㉗。此方法先是选择合适缓冲液pH条件使目标单抗在阴离子交换色谱柱上产生结合,然后使用一定电导率的盐溶液进行等度洗脱。由于目标单抗的等电点较所有杂质分子更高,杂质分子在阴离子交换色谱柱上的结合更强,也就是说,在等度洗脱时,目标单抗分子被先洗脱,而杂质分子在后面洗脱。有文献报道,采用这种方法作为精制手段,改善了阴离子交换色谱流穿模式去除单抗分子多聚体和脱落的蛋白A分子的缺陷,同时保持了流穿模式去除DNA、宿主细胞蛋白质和内毒素的优势㉘
。表5列出了部分阴离子交换色谱填料的有关指标。

表5 部分应用于治疗性单抗纯化的强阴离子交换色谱填料
2.2 阳离子交换色谱填料
阳离子交换(cation exchange,CEX)法也是最常用的单抗精制纯化方法之一。如前面所述,治疗性单抗的等电点通常较高,所以,在单抗精制流程中采用阳离子交换法都是结合模式而非流穿模式。这一特点要求阳离子交换色谱填料必须具备优秀的选择性和动态载量,这两项成为衡量这类填料的最重要指标。在很多应用实例中,对比阴离子交换法,阳离子交换法展示了更好的去除宿主细胞蛋白质、脱落蛋白A和高分子量单抗分子多聚体的能力㉙~㉛。值得注意的是,在现有的治疗性单抗生产中,大孔聚合物基材强阳离子交换色谱填料得到了大范围成功应用。主要原因是这些填料显示了更好的选择性和更高的动态载量,有研究人员指出,正是大孔聚合物基材强阳离子交换色谱填料本身具有的非特异疏水性质使得它们具有更好的选择性㉜。GE Healthcare后来专门把疏水特征引入离子交换色谱填料,开发了Capto等混合型色谱填料正是为了补上这个短板。这两个重要指标还没有理论方法可以直接预测,必须通过实验来测定,这是使用者必须仔细考虑的。比如如何获得最高动态载量。早期通常认为较低的缓冲液电导率和pH应该是最有利于单抗分子与阳离子交换色谱填料实现相互作用。后来的研究证明并非如此。有文献称,适当增加溶液电导率和适宜的pH可以增加动态载量。一种解释是,在较低的电导率和pH条件下,先结合到填料表面和孔内的单抗分子对后来的单抗分子都带有负电荷而且电荷排斥现象比较严重,导致载量下降;而在较高电导率的缓冲液和较高pH条件下,这种负电荷之间的排斥下降,增加了动态载量㉝。加莱克推出的Sepromax S40在去除单抗多聚体方面表现出优异性能(图3)。图4给出了该填料的DBC与POROS HS50和POROS XS50的比较。可以看出,在300cm/h或更高流速下,Sepromax S40表现出更高的DBC。表6列出了部分阳离子交换色谱填料的有关指标。

图3 Sepromax S40去除单抗片段杂质
施伟,林东强,姚善泾.疏水性电荷诱导扩张床吸附分离免疫IgY.化工学报, 2013,65(1):198-204.
PHOTTRAITHIP W,LIN D Q,SHI F,et al.New hydrophobic charge induction resin with 2-mercaptoimidazole as the ligand and its separation characteristics for porcine IgG.Biotechn Bioprocess Eng,2013,18(6):1169-1175.
童红飞,林东强,姚善泾.疏水性电荷诱导层析纯化免疫球蛋白IgY.化工学报,2011,62(6):1574-1580.
REN J,JIA L Y,XU X,et al.Removal of auto antibodies by 4-mercaptoethylpyridine-based adsorbent.J Chromatography B,2009,877(11):1200-1204.
REN J,YAO P,CAO Y,et al.Application of cyclodextrin-based eluents in hydrophobic chargeinduction chromatography:elution of antibody at neutral pH.J Chromatography A,2014,1352:62-68.
(51)参考文献
LIN D Q,TONG H F,WANG H Y,et al.Molecular mechanism of hydrophobic chargeinduction chromatography:interactions between the immobilized 4-mercaptoethyl-pyridine ligand and IgG.J Chromatography A,2012,1260:143-153.
(52)参考文献
CHENG F,LI M Y,WANG,H Q,et al.Antibody ligand interactions for hydrophobic charge-induction chromatography:a surface plasmon resonance study.Langmuir,2015,31(11):3422-3430.
(53)参考文献
LIN D Q,TONG H F,WANG H Y,et al.Molecular insight into the ligand IgG interactions for 4-mercaptoethyl-pyridine based hydrophobic charge-induction chromatography.J Phys Chem B,2012,116(4):1393-1400.

图4 Sepromax S40与POROS HS50和POROS XS50的DBC比较

表6 部分应用于治疗性单抗纯化的强阳离子交换色谱填料
3 疏水色谱填料
疏水色谱(hydrophobic interaction chromatography,HIC)是基于填料表面由共价键偶联的疏水基团(如直链饱和碳烷烃基团或芳烃基团)与蛋白质分子表面的疏水部分的相互作用的分离纯化色谱方法。这种疏水相互作用在高离子强度条件下较强,随着离子强度下降而下降,洗脱是由降低离子强度来实现的。通常,含较多疏水结构域的蛋白在高离子强度条件下保留在疏水填料上。由于疏水色谱与离子交换的纯化机理完全不同,它们可以作为互补的方法使用。如离子交换色谱对DNA、蛋白A残留和内毒素纯化效果较好,而疏水色谱对这些杂质纯化效果不佳。但疏水色谱的优势在于它对高分子量单抗分子聚集体有较好的纯化效果,其主要原因是单抗分子聚集体通常疏水性很强,在高离子强度条件下在疏水色谱填料上的保留更强。疏水色谱填料的动态载量往往远低于离子交换色谱填料,所以在单抗纯化中不像离子交换法使用那样普遍。另外,由于疏水色谱必须使用离子强度较高的溶液,如果离子强度不够,则不能使杂质分子在疏水填料上产生足够的保留;而如果离子强度过高,单抗会出现沉淀现象。所以,必须建立单抗分子在不同离子强度和pH条件下的浑浊度(在410nm波长条件下用分光光度计检测单抗沉淀表征)曲线。使用者还应该通过线性洗脱试验来选择填料。在结合洗脱模式下,一般不应选择目标单抗很早洗脱的填料(即疏水性很弱的填料),就是说,必须在很高的离子强度条件下,目标单抗才可能有保留。相反,疏水性非常强的填料也不是好的选择,使用这类填料往往导致回收率下降。表7列出了部分疏水色谱填料的有关指标。
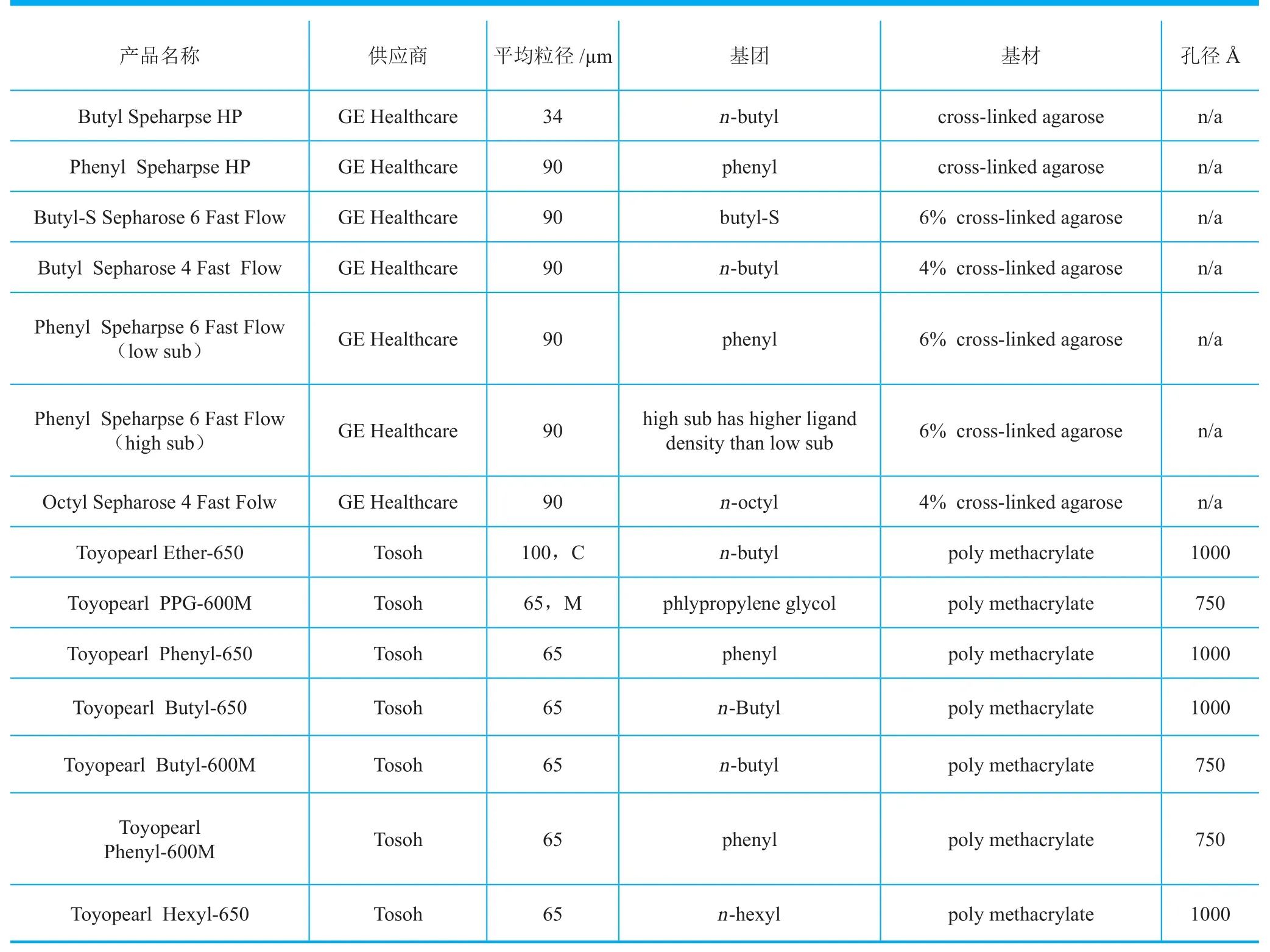
表7 部分应用于治疗性单抗纯化的疏水色谱填料
4 疏水性电荷诱导色谱
疏水性电荷诱导色谱(hydrophobic charge-induction chromatography,HCIC)是一种相对新的分离方法,现在还没有得到大规模工业应用。该方法最初由Burton和Harding提出㉞。其配基兼有疏水和静电相互作用,属于混合模式色谱范畴。HCIC利用高密度的疏水基团实现目标物的疏水作用结合,通常具有耐盐吸附的特性;再通过调节溶液pH,使配基荷电基团带有和蛋白分子电性相同的电荷,借助两者间的静电排斥力实现洗脱。目前由美国波尔(Pall)公司推出的商品化介质MEP HyperCel®,其配基为4-巯乙基吡啶(4-mercaptoethylpyridine,MEP)。结构中含有吡啶环、疏水长链和硫原子,能够在中性pH条件下通过疏水作用和亲硫作用吸附抗体;当溶液pH降低到4.8以下,吡啶环上的氮原子被质子化,配基带上正电,此时蛋白质也带正电,两者产生静电排斥而得到解离。由此可见,HCIC对抗体分子实现吸附的功能来自具有特定结构的功能配基。吡啶和咪唑等含氮杂环基团及其衍生物,具有一定的疏水性和芳香性,适当改变pH则表现出带电性质,符合HCIC的吸附和解吸的基本特征,因此该类化合物常用作HCIC配基。Mountford等㉟合成一系列吡啶基琼脂糖介质,发现硫原子直接连接在吡啶环的配基分离IgG效果较好。Shi等㊱将4-(1氢-咪唑-1-基)苯胺固定在琼脂糖基材上,研究表明这种介质能耐盐上样,对IgG有一定的选择性吸附,动态载量可达59mg/mL。Liu等㊲以2-巯基-1-甲基咪唑为配基制备系列HCIC介质,考察了配基密度对IgG吸附的影响,结果表明较高配基密度有利于抗体吸附。
HCIC层析具有独特的分离性能,已在实验室规模抗体分离中得到应用。Guerrier等㊳采用MEP HyperCel介质从细胞培养液中分离IgG,无需调节料液pH和离子强度,分离纯度可达70%~99%。Ghose等㊴探讨了HCIC分离抗体的纯度不及蛋白A亲和层析。Boschetti㊵指出MEP HyperCel从原料液中捕获抗体的纯度要低于蛋白A亲和介质,但是产品中的聚集体残留量小于蛋白A亲和层析产品中的聚集体含量。Chen等㊶比较了HCIC与传统HIC在单抗分离方面的效果,发现MEP HyperCel选择性好,简化分离步骤,并且提高了分离效率。程华等㊷利用MEP HyperCel结合盐析从小鼠腹水中分离纯化单克隆抗体,纯度大于90%。庄甜甜等㊸采用MEP HyperCel从猪血浆中分离免疫球蛋白IgG,发现填料吸附量较高,具有非盐赖性,而且在pH=4条件下可实现蛋白的有效洗脱,IgG纯度达到77.4%。Xia等㊹㊺制备了以4-巯乙基吡啶、2-巯基-1-甲基咪唑和2-巯基苯并咪唑为配基的HCIC扩张床介质,分离卵黄抗体IgY,纯度约90%,收率约60%。施伟等㊻采用2-巯基-1-甲基咪唑为配基的HCIC介质,从鸡血浆中分离IgY,纯度达到98.9%,收率80.5%。Phottraithip等㊼制备了以2-巯基咪唑为功能配基的Cell-TuC-N-DVS-MI介质,从猪血浆中分离免疫球蛋白,纯度为81%~90%。童红飞等㊽采用以2-巯基-1-甲基咪唑为功能配基的介质分别从鸡血和鹅血中分离得到相应的免疫球蛋白,纯度高于92%,收率大于8 5%。Ren等㊾制备了MEPSepharose介质,用于血清中自身免疫抗体的去除,发现MEP介质对类风湿因子和抗双链DNA抗体的去除率分别达到96%和80%,并且研究IgG抗体纯化过程中在洗脱液中添加4种环糊精,使得IgG能够在较为温和的条件下洗脱,提高了抗体的稳定性㊿。
总的来说,虽然HCIC分离抗体的选择性不如蛋白A亲和层析,并且分离效果受原料、抗体种类和操作条件等因素影响,但是HCIC操作简便、介质制备容易、配基价格低廉且稳定等优点使其在抗体分离过程中是一种良好的辅助手段,在抗体的分离纯化中具有良好的应用前景。进一步加强HCIC分离机理的认识将有助于分离工艺的优化和新型配基的设计。目前,很多研究试图从微观分子尺度研究配基与抗体分子之间的识别和作用模式,揭示HCIC的分离机理(51)~(53)。这种分子模拟理论和方法的发展为从微观水平研究配基-蛋白之间的分子相互作用提供了良好的平台。
5 结 语
与治疗性抗体生产相关的色谱填料工业是当今色谱技术发展的重点之一。它的技术高度集中,但这对整个产业的发展并不是福音。事实上,治疗性抗体上游表达技术的发展速度比下游色谱纯化发展速度快得多。如何改变这个现状,是很多人关注的事情。
作者简介
doi:10.3969/j.issn.1674-0319.2016.01.003
