IL-6和AG490对Burkitt淋巴瘤细胞生长的影响*
2016-04-15李品浩杨文秀裴媛媛
李品浩, 杨文秀, 陈 琴, 裴媛媛
(贵阳医学院病理学教研室,贵州 贵阳 550004)
IL-6和AG490对Burkitt淋巴瘤细胞生长的影响*
李品浩,杨文秀△,陈琴,裴媛媛
(贵阳医学院病理学教研室,贵州 贵阳 550004)
[摘要]目的: 观察IL-6和AG490对Raji细胞生长的影响,探讨信号转导及转录激活因子3(STAT3)及survivin在Burkitt淋巴瘤发生发展中的作用,为寻找淋巴瘤生物治疗的新靶标提供实验依据。方法: 培养Raji细胞,分别加入STAT3的激动剂IL-6和抑制剂AG490,用real-time PCR和Western blot检测STAT3、survivin的表达情况及STAT3的磷酸化,MTT法检查细胞活力,流式细胞术检测细胞凋亡和细胞周期变化。结果: 培养细胞中加入IL-6或AG490后,细胞生长受明显影响并呈现药物浓度依赖关系(P<0.05);与相应的对照组比较, IL-6组Raji细胞中STAT3、survivin mRNA的表达明显升高, AG490组Raij细胞中STAT3、survivin的mRNA表达明显降低。不同浓度的IL-6组之间、不同浓度的AG490组之间,STAT3和survivin mRNA的表达亦有显著差异(P<0.05),且2种基因mRNA表达都呈现出药物浓度依赖关系。p-STAT3、STAT3和survivin的蛋白水平在IL-6 作用下表达增高,AG490 作用下表达降低;细胞凋亡率在IL-6作用下逐渐降低,在AG490作用下逐渐升高,且都呈现出药物浓度依赖关系;经AG490处理后,G1期Raji细胞明显增加,S期细胞无明显改变,G1/S比值增加,而在IL-6组中,S期细胞明显降低。结论: IL-6和AG490对Raji细胞生长有明显影响,STAT3及其下游靶基因survivin的表达改变可能是IL-6及AG490影响Raji细胞生长的重要分子机制。
[关键词]Burkitt淋巴瘤细胞; 信号转导及转录激活因子3; Survivin
信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)是STATs家族的重要成员,其基因是一个重要的癌基因。在多种肿瘤细胞中均已发现有STAT3的持续性过度激活。临床研究发现:肝癌、结肠癌、乳腺癌、肺癌、胃癌和前列腺癌等肿瘤中的 STAT3 活性均发生高频率的异常活化,且其活化程度与患者的预后呈显著负相关[1-6]。
由于 STAT3 是EGFR、IL-6/JAK、Src 等多个致癌性酪氨酸激酶信号通道的汇聚焦点[7],阻断 STAT3传导通路便可以诱导肿瘤细胞凋亡,抑制肿瘤细胞生长。近年来,以 STAT3 为靶点的肿瘤治疗研究逐渐被重视[8]。
在淋巴造血组织肿瘤中STAT3异常的研究主要集中在白血病这一非实体性的肿瘤,而在淋巴瘤这类实体性肿瘤中的研究较少见。Soldini等[9]报道,Burkitt淋巴瘤中发现STAT3的异常活化,然而其活化对Burkitt淋巴瘤影响的分子机制尚未完全清楚。本研究观察了STAT3激动剂IL-6和抑制剂AG490对Raji细胞生长的影响,并进一步探讨了其分子机制,为寻找临床治疗Burkitt淋巴瘤可能的基因靶点提供实验依据。
材料和方法
1实验材料
Burkitt细胞株Raji细胞购自中国科学院上海细胞库。培养所用培养基RPMI-1640购自HyClone;总RNA提取试剂盒购自上海碧云天公司;real-time PCR试剂盒购自Invitrogen;抗STAT3、survivin和β-actin抗体购自Santa Cruz;抗p-STAT3 购自CST; AG490购自Sigma;IL-6购自 Pepro TECH。PCR引物由上海生工合成。
2方法
2.1细胞培养和实验分组将Raji细胞置于含10%胎牛血清和1%青霉素/链霉素的RPMI-1640培养液中,并于37 ℃、5% CO2饱和湿度的恒温培养箱中培养,每2~3 d换液1次,待细胞计数大于1×109/L时,按 1∶2 ~1∶3传代培养。收集细胞并调节浓度为2×108/L,根据加入药物AG490(0、25、50、75、100 mg/L)和IL-6(0、50、100、150、200 μg/L)进行分组,分别于培养24 h、48 h、72 h后测定并统计。
2.2细胞活力的检测细胞生长活力采用MTT法进行检测。实验时收集Raji细胞,于无血清培养基中培养24 h,同步化后96孔板布板,根据上述分组,分别于培养24 h、48 h、72 h后测定并统计,测定每孔加入20 μL MTT溶液(5 g/L,即0.5% MTT),继续培养4 h,每孔加入150 μL三联溶剂(SDS 10 g, 异丁醇 5 mL, 10 mol/L HCl 0.1 mL,用双蒸水溶解配成100 mL溶液),置摇床上低速振荡10 min,镜下观察结晶物充分溶解后在酶标仪490 nm处测量各孔的吸光度(A)。每组5个复孔,实验重复3次。
2.3STAT3和survivin的mRNA检测细胞总RNA由碧云天总RNA提取试剂盒提取,测定RNAA260/A280比值处于1.8~2.2之间,符合下续实验要求。逆转录为cDNA后real-time PCR测定mRNA相对表达量。PCR循环参数:95 ℃ 10 min;9 ℃ 15 s ,60 ℃ 1 min,40个循环。结果用相对定量分析方法计算并以2-ΔΔCt表示。 用β-actin 作为内参照计算STAT3和survivin的mRNA相对表达量。PCR引物序列和产物见表1。
表1Real-time PCR引物序列及产物
Table 1.The sequences of the primers for real-time PCR and corresponding products

NamePrimersequence(5'-3')Products(bp)STAT3CAGTCCGTGGAACCATACA-CAAAGC154CAATACTTTCCGAATGCCTCCTC-CTTSurvivinGCCAGATTTGAATCGCGGGA185GCAGTGGATGAAGCCAGCCTβ-actinTGGCACCCAGCACAATGAA186CTAAGTCATAGTCCGC-CTAGAAGCA
2.4Western blot测定STAT3、p-STAT3和survivin的蛋白水平由前面实验数据得出细胞的药物最佳处理浓度,AG490最佳浓度取50 mg/L,IL-6最佳浓度取100 μg/L。 收集足量该浓度下培养48 h 的细胞, PBS充分洗涤去除药物及培养液后,加入适量的细胞裂解液及相应的蛋白酶抑制剂,于冰上充分裂解30 min,并不时振荡,12 000 r/min离心5 min取上清,即为所得蛋白样品。样品溶液用BCA法进行定量,每孔上样量为30 mg,然后进行SDS-PAGE,电泳后转至PVDF膜, p-STAT3用5% BSA封闭,其它目的蛋白用5%脱脂牛奶封闭后,分别加 I 抗孵育过夜,STAT3 (1∶500稀释), p-STAT3 (1∶500稀释),survivin (1∶500稀释),β-actin (1∶1 000稀释),洗膜后,加辣根过氧化酶偶联的II抗(1∶5 000稀释)孵育1.5 h,再洗膜后加 ECL 发光液显色,暗室曝光,得到STAT3、p-STAT3和survivin的条带胶片。胶片扫描后用Gelpro32软件分析。
2.5细胞周期和细胞凋亡的检测培养细胞,根据加入药物AG490(0、25、50、75 mg/L)和IL-6(50、100、150 μg/L)药物浓度进行分组,分别于培养24 h、48 h、72 h后收集细胞。加入70%冰乙醇固定过夜,离心后弃上清,PBS 洗涤3遍,加入200 μL碘化丙啶 (propidium iodide,PI) 染色,37 ℃避光孵育15 min,过滤后用流式细胞仪检测细胞周期各期分布。收集各组细胞悬液,离心弃上清,200 μL binding buffer 重悬,5 μL Annexin V-FITC 染色孵育10 min,离心弃上清,200 μL binding buffer 重悬,10 μL PI染色,用流式细胞仪检测各组细胞凋亡率。
3统计学处理
所有数据均使用均数±标准差(mean±SD)表示。数据统计使用SPSS 20.0统计软件包。比较STAT3和survivin的mRNA及蛋白水平采用两独立样本t检验;不同浓度药物作用的多组间比较采用单因素方差分析,多组间均数每两个均数比较(两两比较)采用q检验,多组均数与一个对照样本均数比较采用Dunnettt检验,以P<0.05为差异有统计学意义。
结果
1细胞活力
MTT法检测结果显示与对照组相比较,Raji细胞490 nm处吸光度值在加入IL-6培养后显著增高,加入AG490则明显降低(P<0.05),并且均呈浓度依赖性,见图1。
2STAT3和survivin的mRNA表达
与相应的对照组之间比较, IL-6组Raji细胞中STAT3和survivin的mRNA表达明显升高, AG490组Raij细胞中STAT3和survivin的mRNA表达明显降低。不同浓度的IL-6组之间、不同浓度的AG490组之间,STAT3和survivin的mRNA表达亦有显著差异(P<0.05),且均呈现出药物浓度依赖关系,见表2、3。
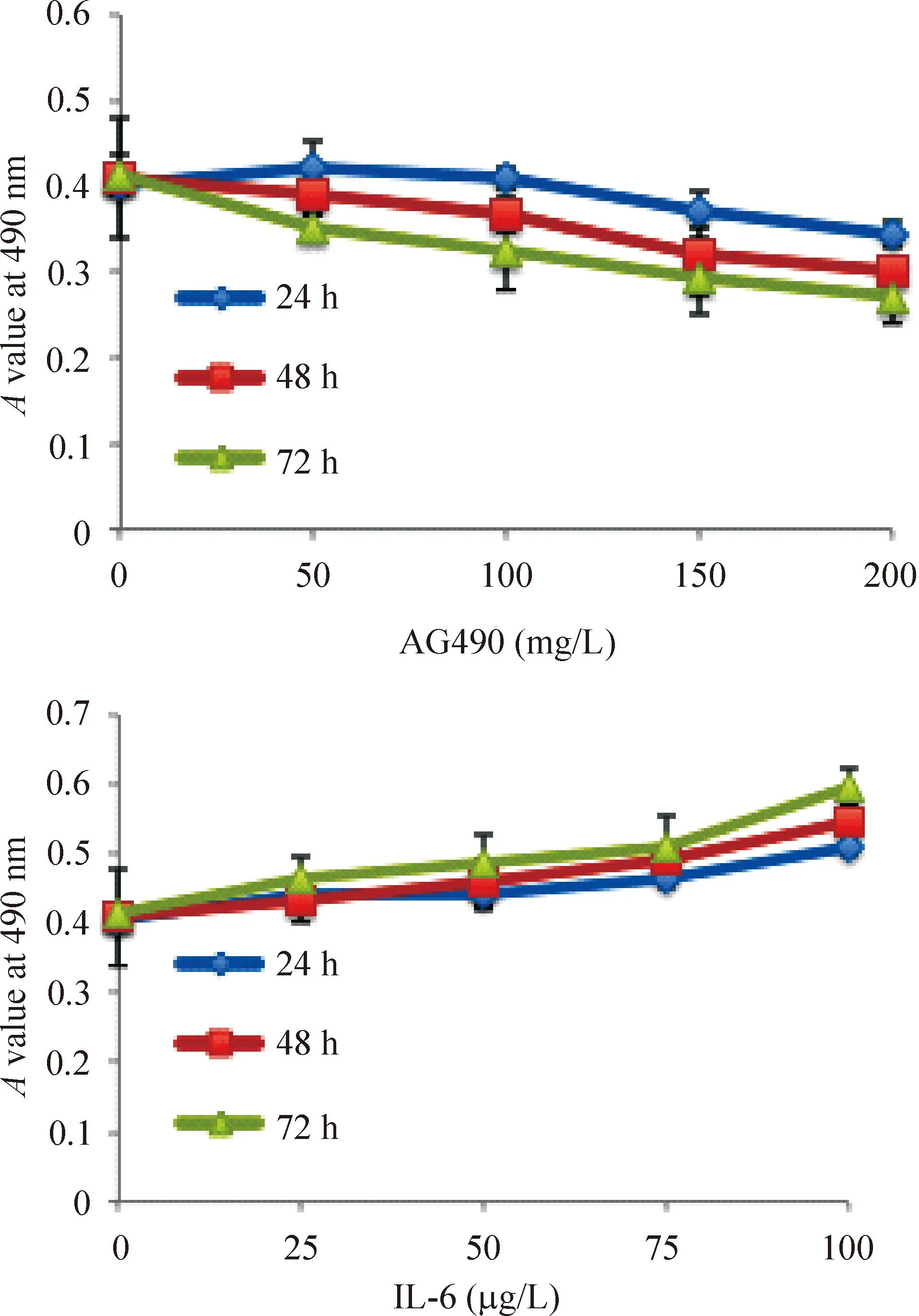
Figure 1.The effects of AG490 or IL-6 at different concentrations for different time on the growth of Raji cells. Mean±SD.n=3.
图1AG490和IL-6对Raji细胞活力的影响

表2 加入IL-6处理Raji细胞48 h后的STAT3和survivin的mRNA相对表达量
*P<0.05vs0 μg/L.

表3 加入AG490处理Raji细胞48 h后STAT3和survivin的mRNA相对表达量
*P<0.05vs0 mg/L.
3p-STAT3和survivin蛋白水平的比较
Western blot检测显示,与相应的对照组相比,Raji细胞的p-STAT3及STAT3蛋白在AG490处理组明显降低(P<0.05),在IL-6处理组升高(P<0.05),见图2。
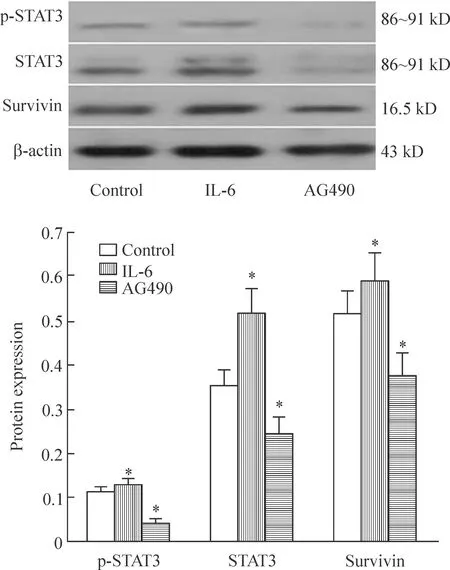
Figure 2.The protein levels of STAT3, p-STAT3 and survivin in the Raji cells with different treatments. Mean±SD.n=3.*P<0.05vscontrol group.
图2Western blot检测Raji细胞中STAT3、p-STAT3和survivin的蛋白水平
4细胞凋亡的检测
流式细胞术检测显示,在IL-6和AG490处理的细胞和对照组细胞之间凋亡水平有明显差异(P<0.05)。细胞凋亡水平呈现出药物浓度依赖关系,见图3。
5细胞周期的检测
与相应对照相比,AG490组G1期细胞百分率明显升高(P<0.05),S期细胞百分率无明显变化,G2/M期细胞百分率明显降低(P<0.05);IL-6组G0/G1期细胞百分率明显降低(P<0.05),S期细胞百分率明显升高(P<0.05),G2/M期细胞百分率无明显变化,见图4、表4。
讨论
Burkitt淋巴瘤是生发中心细胞来源的高侵袭性B细胞非霍奇金淋巴瘤,具有很差的预后。肿瘤细胞的倍增时间很短,与myc基因有关的染色体易位是该肿瘤的显著特征,很多病例存在EB病毒感染。有研究发现, JAK/STAT3信号转导通路在淋巴瘤[10-11]如弥漫大B细胞淋巴瘤侵袭及转移过程中发挥重要作用[12], 该通路持续激活可导致细胞异常增殖或恶性转化,应用该通路的抑制剂可抑制 STAT3 在侵袭性恶性淋巴瘤细胞系中的活性。Survivin是凋亡抑制蛋白家族中的一个成员[13],它在多种肿瘤组织中高表达,而在癌旁组织及正常组织中无表达或低表达[14]。Survivin具有抑制细胞凋亡和调节细胞有丝分裂的双重功能[15-16]。它主要通过多条通路的调节抑制caspase级联反应中caspase-9、caspase-3、caspase-7的活性而发挥抗凋亡作用;在G2/M期特异性的表达,加快肿瘤细胞由G1/S期的转换,通过有丝分裂促进转化细胞的异常增殖。有报道survivin在侵袭性的非霍奇金淋巴瘤中表达并能预测一些非霍奇金淋巴瘤的临床过程和预后,它的表达预示着非霍奇金淋巴瘤较差的预后[17-18]。同时有文献报道在侵袭性淋巴瘤中survivin基因与cyclin B的结合在促进G2/M期的转化中起重要作用[19]。多项研究表明[20-21]:survivin可能是STAT3信号通路下游靶基因之一。survivin基因的启动子上含有STAT3的结合位点,活化的STAT3可直接与survivin基因的启动子结合,调控survivin蛋白的表达,而向细胞中转入survivin基因并稳定表达后,可逆转STAT3抑制剂诱导的促凋亡作用。我们采用Burkitt淋巴瘤细胞行研究,用STAT3的小分子抑制剂AG490和激活剂IL-6,了解它们对肿瘤细胞生长的影响,并探讨2种药物对Raji细胞生长的影响是否与STAT3和survivin的变化有关,为寻找淋巴瘤生物治疗的新靶标提供实验依据。
AG490 是一种人工合成的苯亚甲基丙二腈的脂类衍生物,可以和受体酪氨酸激酶竞争结合位置,是JAK/STAT通路的特异性抑制剂[22],应用AG490作用于肿瘤细胞而起抗瘤作用的研究陆续见诸报道,而作用于Burkitt 淋巴瘤的研究尚未见到。IL-6是IL-6/JAK信号通路的激活剂[23-24],激活JAK后可激活STAT3的表达及磷酸化,形成二聚体结构进入细胞核,与下游凋亡及细胞周期调控基因、基质金属蛋白酶等靶基因的启动子结合,调节肿瘤细胞的增殖凋亡和迁移等过程。
本研究发现加入AG490后Raji细胞生长活力降低,在IL-6的作用下,细胞生长活力增强,都呈现出药物浓度依赖关系。流式细胞术检测发现加入AG490 48 h后,G0/G1期细胞比率由46.19%上升至51.65%,虽然S期细胞百分率下降不明显,但G2/M期百分率明显降低;加入IL-6 48 h后,G0/G1期的Raji细胞出现下降趋势,S期细胞明显增多。细胞的凋亡检测分析发现在加入药物24 h、48 h、72 h后,AG490组细胞凋亡率明显增高,IL-6组凋亡率则明显降低,两者都呈现出药物浓度依赖关系。这表明JAK/STAT3信号通路对Raji细胞的生长活力、细胞凋亡和细胞周期都产生明显的影响。
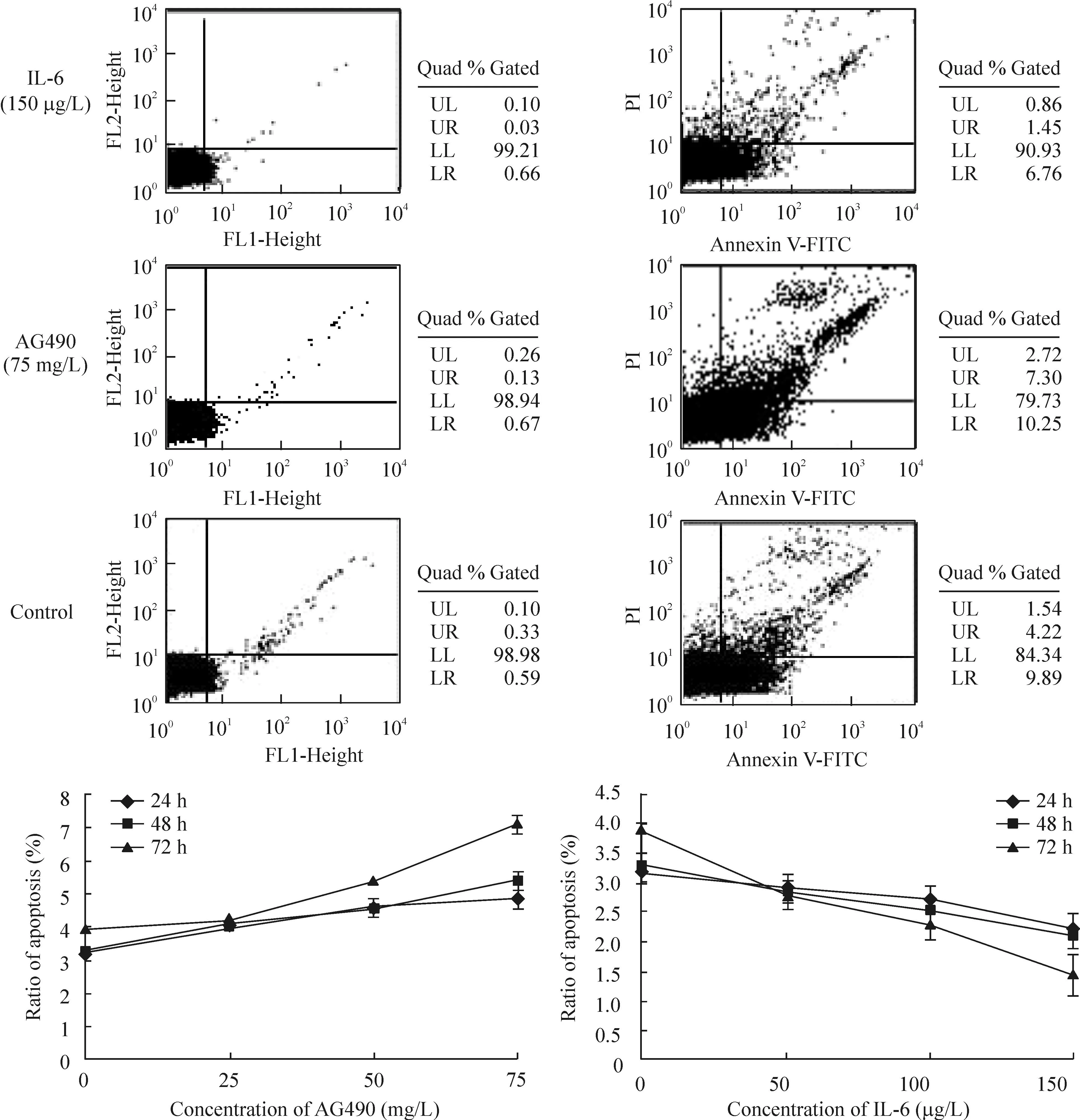
Figure 3.The apoptotic levels of Raji cells treated with AG490 or IL-6 were analyzed by flow cytometry. Mean±SD.n=3.
图3AG490或IL-6作用的各组Raji细胞的凋亡水平
为进一步探讨IL-6和AG490影响Raji细胞生长的相关分子机制,我们用实时荧光定量PCR和Western blot检查了survivin和STAT3的mRNA及蛋白表达水平。检测分析发现,Raji细胞STAT3 mRNA的表达水平在AG490 作用后显著降低,而IL-6作用后则明显升高。STAT3和survivin mRNA的表达呈现药物浓度依赖关系。与对照组相比,细胞内p-STAT3、STAT3和survivin蛋白表达在AG490作用 48 h后显著降低, IL-6作用48 h后明显升高,各组的STAT3、p-STAT3 与survivin蛋白变化都表现出一致性,提示survivin的蛋白表达可能与STAT3的活化有关。

Figure 4.The cell cycle distribution in the Raji cells under different treatments for 48 h. A: the Raji cells treated with AG490 at 50 mg/L; B: the Raji cells treated with IL-6 at 100 μg/L; C: control group.
图4不同处理情况下Raji细胞培养48 h后细胞周期的变化
表4不同处理条件下Raji细胞培养48 h后细胞周期变化
Table 4.Proportion of the cell cycle in the Raji cells with diffe-rent treatment for 48 h (%. Mean±SD.n=3)

GroupG0/G1SG2/MControl46.51±2.0344.31±1.019.18±1.90AG49051.95±2.21*44.37±1.843.68±0.33*IL-640.81±2.29*49.94±2.59*9.25±1.71
*P<0.05vscontrol group.
实验结果表明IL-6和AG490对Raji细胞的生长有明显影响,其影响可能与STAT3分子活化及其上调survivin分子的表达密切相关。Survivin的上调表达可能是肿瘤细胞内STAT3 信号传导途径活化的结果,STAT3的活化通过上调survivin表达而抑制了肿瘤细胞的凋亡和促进细胞周期进程,从而影响Raji细胞的生长活力。抑制STAT3分子活化可能通过直接抑制STAT3活性、抑制survivin表达双重作用对细胞生长产生明显的抑制作用,这可能是Burkitt淋巴瘤治疗的新思路。
[参考文献]
[1]Morikawa T, Baba Y, Yamauchi M, et al. STAT3 expression, molecular features, inflammation patterns, and prognosis in a database of 724 colorectal cancers[J]. Clin Cancer Res, 2011, 17(6): 1452-1462.
[2]Becker C, Fantini MC, Schramm C, et al. TGF-beta suppresses tumor progression in colon cancer by inhibition of IL-6 trans-signaling[J]. Immunity, 2004, 21(4): 491-501.
[3]Grivennikov S, Karin E, Terzic J, et al. IL-6 and Stat3 are required for survival of intestinal epithelial cells and development of colitis-associated cancer[J]. Cancer Cell, 2009, 15(2): 103-113.
[4]Lou W, Ni Z, Dyer K, et al. Interleukin-6 induces prostate cancer cell growth accompanied by activation of Stat3 signaling pathway[J]. Prostate, 2000, 42(3): 239-242.
[5]Berishaj M, Gao SP, Ahmed S, et al. Stat3 is tyrosine- phosphorylated through the interleukin-6/glycoprotein 130/Janus kinase pathway in breast cancer[J]. Breast Cancer Res, 2007, 9 (3):R32.
[6]Kim DY, Cha ST, Ahn DH, et al. STAT3 expression in gastric cancer indicates a poor prognosis[J]. J Gastroenterol Hepatol, 2009, 24(4):646-651.
[7]侯嘉杰,孙倍成. STAT3:慢性炎症介导肿瘤发生和进展的关键节点[J]. 生物化学与生物物理进展, 2014, 41(1):69-78.
[8]Jing N, Tweardy DJ. Targeting STAT3 in cancer therapy[J]. Anticancer Drugs, 2005, 16(6):601-607.
[9]Soldini D, Montagna C, Schüffler P, et al. A new diagnostic algorithm for Burkitt and diffuse large B-cell lymphomas based on the expression of CSE1L and STAT3 and on MYC rearrangement predicts outcome[J]. Ann Oncol, 2013, 24(1):193-201.
[10]Al Zaid Siddiquee K, Turkson J. STAT3 as a target for inducing apoptosis in solid and hematological tumors[J]. Cell Res, 2008, 18(2):254-267.
[11]Siveen KS, Sikka S, Surana R, et al. Targeting the STAT3 signaling pathway in cancer: role of synthetic and natural inhibitors[J]. Biochim Biophys Acta, 2014, 1845(2):136-154.
[12]Lam LT, Wright G, Davis RE, et al. Cooperative signaling through the signal transducer and activator of transcription 3 and nuclear factor-κB pathways in subtypes of diffuse large B-cell lymphoma[J]. Blood, 2008, 111(7):3701-3713.
[13]Altieri DC. Survivin-The inconvenient IAP[J]. Semin Cell Dev Biol, 2015, 39:91-96.
[14]Mobahat M, Narendran A, Riabowol K. Survivin as a preferential target for cancer therapy[J]. Int J Mol Sci. 2014,15(2):2494-2516.
[15]Huang J, Lyu H, Wang J, et al. MicroRNA regulation and therapeutic targeting of survivin in cancer[J]. Am J Cancer Res, 2014, 5(1):20-31.
[16]Rödel F, Sprenger T, Kaina B, et al. Survivin as a prognostic/predictive marker and molecular target in cancer therapy[J]. Curr Med Chem, 2012, 19(22):3679-3688.
[17]Kaneko N, Mitsuoka K, Amino N, et al. Combination of YM155, a survivin suppressant, with bendamustine and rituximab: a new combination therapy to treat relapsed/refractory diffuse large B-cell lymphoma[J]. Clin Cancer Res, 2014, 20(7):1814-1822.
[18]Kaneko N, Kita A, Yamanaka K, et al. Combination of YM155, a survivin suppressant with a STAT3 inhibitor: a new strategy to treat diffuse large B-cell lymphoma[J]. Leuk Res, 2013, 37(9):1156-1161.
[19]Nefedova Y, Nagaraj S, Rosenbauer A, et al. Regulation of dendritic cell differentiation and antitumor immune response in cancer by pharmacologic-selective inhibition of the janus-activated kinase 2/signal transducers and activators of transcription 3 pathway[J]. Cancer Res, 2005 , 65(20):9525-9535.
[20]Scheper MA, Nikitakis NG, Sauk JJ. Survivin is a downstream target and effector of sulindac-sensitive oncogenic Stat3 signaling in head and neck cancer[J]. Int J Oral Maxillofac Surg, 2007, 36(7):632-639.
[21]Kanda N, Seno H, Konda Y, et al. STAT3 is constitutively activated and supports cell survival in association with survivin expression in gastric cancer cells[J]. Oncogene, 2004, 23(28):4921-4929.
[22]何平,李丹,李德天,等. 乙肝病毒X蛋白通过激活JAK2/STAT3信号通路调节肾小管上皮细胞凋亡[J]. 中国病理生理杂志, 2014,30(8):1451-1460.
[23]Garbers C, Aparicio-Siegmund S, Rose-John S. The IL-6/gp130/STAT3 signaling axis: recent advances towards specific inhibition[J]. Curr Opin Immunol, 2015, 34: 75-82.
[24]Munoz J, Dhillon N, Janku F, et al. STAT3 inhibitors: finding a home in lymphoma and leukemia[J]. Oncologist, 2014, 19(5):536-544.
(责任编辑: 林白霜, 余小慧)
Effects of IL-6 and AG490 on Burkitt lymphoma cell growth
LI Pin-hao, YANG Wen-xiu, CHEN Qin, PEI Yuan-yuan
(DepartmentofPathology,GuiyangMedicalUniversity,Guiyang550004,China.E-mail:ypq1964@163.com)
[ABSTRACT]AIM: To observe the influences of IL-6 and AG490 on the growth of Raji cell line (Burkitt lymphoma cell, BL). METHODS: Raji cells were cultured. IL-6, an activator of signal transducer and activator of transcription 3 (STAT3), and AG490, a specific inhibitor of STAT3 were added into the medium respectively. The expression of STAT3 and survivin at mRNA and protein levels was detected by real-time PCR and Western blot. The cell viability was measured by MTT assay. Apoptosis and cell cycle were examined by flow cytometry. RESULTS: IL-6 or AG490 affected the growth of Raji cells significantly in a dose-dependent manner (P<0.05). The mRNA expression of STAT3 and survivin in Raji cells was higher in IL-6 group, and lower in the AG490 group than that in the corresponding control group. The statistical differences were found in the mRNA expression of STAT3 and survivin among different IL-6 or AG490 groups (P<0.05). The concentration dependent relationship was also presented in IL-6 and AG490 groups by the regression analysis. The results of Western blot showed that the protein levels of phosphorylated STAT3 (p-STAT3), STAT3 and survivin were increased in IL-6 group, and decreased in AG490 group. The apoptotic rate of Raji cells was gradually reduced with the increasing concentration of IL-6. The opposite results were detected in the Raji cells treated with AG490. There was significant difference in constitute of the cell cycle between the groups treated with IL-6 or AG490 and corresponding control group. The cells at G1-phase and G1/S were significantly increased, while those at S-phase had no obvious change under treating with AG490. The cells at S-phase decreased obviously in the Raji cells treated with IL-6. CONCLUSION: IL-6 and AG490 distinctly affect the growth of Raji cells. The mechanism may be associated with the activation of STAT3 and survivin.
[KEY WORDS]Burkitt lymphoma cells; Signal transducer and activator of transcription 3; Survivin
doi:10.3969/j.issn.1000- 4718.2016.03.008
[中图分类号]R730.23;R392.12
[文献标志码]A
通讯作者△Tel: 0851-86752735; E-mail: ypq1964@163.com
*[基金项目]国家自然科学基金资助项目(No. 81160299);贵州省优秀人才省长基金资助项目(No. 2011,125)
[收稿日期]2015- 04- 13[修回日期] 2016- 01- 21
[文章编号]1000- 4718(2016)03- 0432- 07
杂志网址: http://www.cjpp.net
