N-乙酰半胱氨酸对抗丙酮醛引起的心肌细胞损伤*
2016-04-15董小变庄晓东黄泽娜廖新学
董小变, 吴 娟,2, 庄晓东, 黄泽娜, 胡 洵, 廖新学△
(1中山大学附属第一医院心血管内科,广东 广州 510080; 2江门市中心医院心血管内科,广东 江门529030)
N-乙酰半胱氨酸对抗丙酮醛引起的心肌细胞损伤*
董小变1,吴娟1,2,庄晓东1,黄泽娜1,胡洵1,廖新学1△
(1中山大学附属第一医院心血管内科,广东 广州 510080;2江门市中心医院心血管内科,广东 江门529030)
[摘要]目的: 观察N-乙酰半胱氨酸(N-acetylcysteine, NAC)对抗丙酮醛诱导的H9c2心肌细胞损伤及相关机制。方法: 实验分为正常对照组、丙酮醛损伤组(不同浓度丙酮醛处理)、NAC+丙酮醛组(NAC与丙酮醛共处理)、SP600125预处理+丙酮醛组、NAC组和SP600125组。H9c2心肌细胞常规消化种板,经相应处理24 h后:应用CCK-8法检测心肌细胞的存活率;Western blot法检测H9c2心肌细胞内磷酸化和总的c-Jun 氨基端激酶(p-JNK、t-JNK)表达水平;双氯荧光素(DCFH-DA)染色法检测心肌细胞内活性氧(ROS)水平;罗丹明123(Rh123) 染色法检测细胞线粒体膜电位(MMP);Hoechst 33258染色法观察H9c2心肌细胞凋亡形态学变化。结果: 与对照组相比,不同浓度的丙酮醛均能够降低H9c2心肌细胞存活率,且呈剂量依赖性(P<0.01), NAC在一定浓度范围内(500~1 500 μmol/L)可对抗丙酮醛引起心肌细胞损伤(P<0.01),抑制丙酮醛引起细胞内ROS水平升高,对抗丙酮醛引起细胞内MMP降低,抑制丙酮醛诱导细胞内JNK蛋白的磷酸化(P<0.01)。与NAC的细胞保护作用类似,选择性JNK抑制剂SP600125也可抑制丙酮醛诱导的细胞损伤,包括减轻氧化应激、改善线粒体膜电位及抑制细胞凋亡。结论: N-乙酰半胱氨酸能够保护H9c2心肌细胞对抗丙酮醛引起的损伤,其机制可能与其降低细胞内ROS水平、改善MMP、抑制JNK磷酸化和抗凋亡有关。
[关键词]H9c2细胞; N-乙酰半胱氨酸; 丙酮醛; c-Jun 氨基端激酶
糖尿病心肌病(diabetic cardiomyopathy, DCM)是糖尿病患者的一种心脏并发症,其发病机制复杂,涉及多种病理机制,如微血管病变、心肌纤维化、间质炎症、氧化应激损伤、凋亡、自噬、内质网应激及钙内稳态异常等[1-2]。但引起上述心脏功能异常或损伤的信号通路尚未完全阐明。晚期糖基化终产物(advanced glycosylation end-products, AGEs)是一类非酶催化的大分子糖基化产物,并随着年龄而增加。大量研究已经证实,AGEs及AGEs受体系统是参与糖尿病并发症的重要原因[3]。而丙酮醛(methyl-glyoxal, MG)是AGEs的前体[4],糖尿病患者体内的MG水平与糖尿病慢性并发症的发生发展直接相关[4-6]。因此,本实验拟选用MG来建立心肌细胞糖尿病损伤模型,更能直接反映糖尿病心肌损伤的本质。
N-乙酰半胱氨酸(N-acetylcysteine, NAC)是还原性谷胱甘肽的前体,是一种含有巯基的活性氧清除剂,在临床上也是一种很好的祛痰剂,具有对抗各种原因所致的氧化损伤、调节基因的表达和信号转导系统、抗细胞凋亡等作用[7-8]。
目前临床上也无专门针对糖尿病心肌病的特效药物,只能通过控制血糖、控制血压及改善微循环等方法对症治疗,但总体治疗效果欠佳。本研究旨在观察N-乙酰半胱氨酸对抗丙酮醛诱导的心肌细胞损伤及相关机制,为临床治疗糖尿病心肌病提供新的实验依据。
材料和方法
1材料及试剂
H9c2心肌细胞购自上海中科院细胞库;DMEM/F12培养基、胎牛血清和胰蛋白酶均购自Gibco;CCK-8细胞计数试剂盒购自Dojindo;丙酮醛、N-乙酰半胱氨酸、Hoechst 33258、罗丹明123(rhodamine 123, Rh123)和双氯荧光素(2′, 7′-dichlorofluorescein diacetate, DCFH-DA)购自Sigma;SP600125(JNK抑制剂)、总JNK抗体(t-JNK)和磷酸化JNK(p-JNK)抗体均购自CST;实验用水为双蒸水;BCA蛋白浓度检测试剂盒购自上海碧云天生物技术有限公司。
2主要方法
2.1H9c2心肌细胞培养用含10%胎牛血清的DMEM/F12培养基培养H9c2心肌细胞,置于37 ℃、5% CO2的饱和湿度培养箱培养。每2~3 天进行细胞传代,取对数生长期的心肌细胞进行下列实验。
2.2MG对H9c2心肌细胞存活率的影响实验分为正常对照组和不同浓度的MG处理组,取对数生长期的H9c2心肌细胞,0.25%胰蛋白酶消化成单细胞悬液,以1×108/L的细胞密度接种于96孔板中,每孔100 μL。每组设5个复孔。培养24 h后,用不同浓度的MG (0、100、200、400、600、800 μmol/L)处理H9c2心肌细胞24 h。然后吸出上清液,每孔加入含10% CCK-8的无血清培养基,37℃孵育3 h,用酶标仪在测量波长450 nm处测量各孔的吸光度(A),按照以下公式计算细胞存活率:细胞存活率(%) =处理组A值/对照组A值×100%。以上实验重复3次。
2.3MG与NAC共处理对H9c2心肌细胞存活率影响实验分为正常对照组、MG (400 μmol/L)处理组、MG+NAC (0、500、750、1 000、1 500 μmol/L)共处理组,取对数生长期的H9c2心肌细胞,0.25%胰蛋白酶消化后以1×108/L的细胞密度接种于96孔板中,每孔100 μL,每组设5个复孔。培养24 h后,在400 μmol/L MG处理细胞的同时,加入不同浓度的NAC (0、500、750、1 000、1 500 μmol/L)处理H9c2细胞24 h,CCK-8法测定细胞存活率。以上实验重复3次。
2.4Western blot法检测p-JNK和t-JNK的表达实验分为正常对照组、MG处理组、NAC (1 500 μmol/L) +MG组和NAC组,H9c2心肌细胞接种于35 mm培养皿内,当细胞生长到培养皿约80%面积时,进行上述实验分组处理24 h。处理完成后,用预冷的PBS洗2次,加入细胞裂解液,4 ℃静置30 min,然后刮下细胞,12 000 r/min离心10 min,取上清,采用BCA法进行蛋白定量。总蛋白经SDS-PAGE分离后,转移至PVDF膜上。用5%脱脂牛奶封闭1~2 h,随后加入p-JNK或t-JNK抗体(Ⅰ抗滴度均为1∶1 000),4 ℃摇床孵育过夜;然后用TBST洗3次,每次10 min;再加入相应的荧光Ⅱ抗(荧光Ⅱ抗滴度为1∶10 000),室温避光孵育1~2 h后,TBST漂洗3次,每次10 min。曝光时使用双色红外荧光成像系统,按照坐标放好PVDF膜,蛋白面朝下,设置好软件参数,扫描完成后直接获得图片。使用ImageJ 1.41o软件进行灰度分析。
2.5H9c2心肌细胞内的活性氧簇(reactive oxygen species,ROS)水平的检测实验分为正常对照组、MG处理组、MG+NAC共处理组、SP600125预处理+MG组、NAC处理组和SP600125处理组,其中MG、NAC处理浓度分别为400 μmol/L、1 500 μmol/L;SP600125(25 μmol/L)预处理30 min后PBS洗2次。以上组均按相应处理因素培养24 h。将赖氨酸包被的盖玻片置于6孔培养板内,H9c2心肌细胞均匀接种于盖玻片上。当细胞生长到培养孔约80%面积时,给予相应处理24 h,每组均包括3个复孔。处理完成后,用PBS漂洗盖玻片2次,用10 μmol/L DCFH-DA染液于37 ℃孵育30 min。在荧光显微镜下随机选取5个不重复区域拍照,用ImageJ 1.41o软件计算出5个视野绿色荧光强度的平均值,再对每组的样本进行统计分析。
2.6H9c2心肌细胞内线粒体膜电位(mitochondral membrane potential,MMP)的检测实验分组具体见2.5。将赖氨酸包被的盖玻片置于6孔培养板内,H9c2心肌细胞均匀接种于盖玻片上,给予相应药物处理24 h,盖玻片用PBS洗2次,在含100 μg/L Rh123的无血清培养基中37℃孵育30 min,在荧光显微镜下随机选取5个不重复区摄片,细胞核周围绿色的亮点即为摄取了Rh123的线粒体。用ImageJ 1.41o软件分析5个视野的绿色荧光强度平均值,再对每组的样本进行统计分析。
2.7Hoechst33258染色法检测H9c2心肌细胞凋亡实验分组具体见2.5。H9c2心肌细胞经不同因素处理后,小心弃去培养基, PBS洗1遍,4%多聚甲醛固定10 min,PBS漂洗后,加入5 μg/L Hoechst 33258试剂,室温避光染色10 min;再用PBS洗2次,每次5 min;然后在荧光显微镜下观察并拍照。Hoechst 33258不能被正常细胞所摄取,仅被凋亡细胞摄取。染色后,正常细胞核出现弥散均匀的低密度荧光;典型凋亡细胞核可见染色质高度凝聚、固缩、边缘化,进而细胞核裂解为碎块,呈现颗粒状荧光,有些会产生凋亡小体。
3统计学处理
采用SPSS 17.0统计软件进行统计学分析,统计资料用均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(one-way ANOVA)检验,两两比较采用LSD检验,以P<0.05表示差异有统计学意义。
结果
1MG呈剂量依赖性降低H9c2心肌细胞存活率
如图1所示,与对照组相比,不同浓度的丙酮醛均能够降低H9c2心肌细胞存活率,且呈剂量依赖性(P<0.01)。其中400 μmol/L MG作用24 h后,H9c2心肌细胞存活率为(50.04±2.06)%,本研究选择此浓度作为后续实验的损伤浓度。
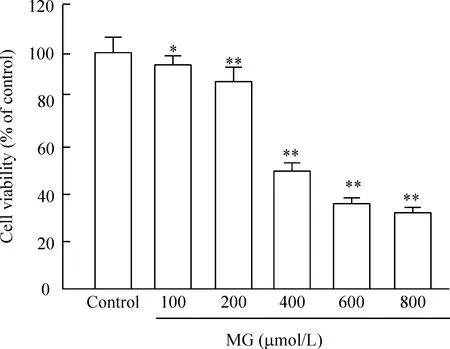
Figure 1.Effects of MG at different concentrations on viability of H9c2 cells. H9c2 cells were treated with increasing concentrations (ranging from 0 to 800 μmol/L) of MG for 24 h. Cell viability was measured by CCK-8 assay. Mean±SD.n=5.*P<0.05,**P<0.01vscontrol group.
图1MG对H9c2心肌细胞存活率的影响
2NAC保护H9c2心肌细胞对抗MG引起的细胞存活率降低
如图2所示,与对照组相比,NAC在一定浓度范围内(500~1 500 μmol/L)可对抗MG引起心肌细胞损伤(P<0.01),其中1 500 μmol/L NAC对心肌细胞的保护作用比较显著,可提高细胞存活率30%左右,在后续的实验中选择1 500 μmol/L作为NAC有效保护浓度。

Figure 2.Effects of NAC at different concentrations in combination with MG on viability in H9c2 cells. H9c2 cells were treated with increasing concentrations (ranging from 500 to 1 500 μmol/L) of NAC and 400 μmol/L MG for 24 h. Cell viability was measured by CCK-8 assay. Mean±SD.n=5.**P<0.01vscontrol group;##P<0.01vsMG group.
图2MG与NAC共处理对H9c2心肌细胞存活率的影响
3MG诱导H9c2心肌细胞内JNK的磷酸化
H9c2 细胞分别经0、200、400及600 μmol/L MG处理24 h 后,细胞内总的JNK蛋白表达水平无明显改变,而磷酸化JNK蛋白表达水平逐渐升高,差异有统计学意义(P<0.01),见图3。
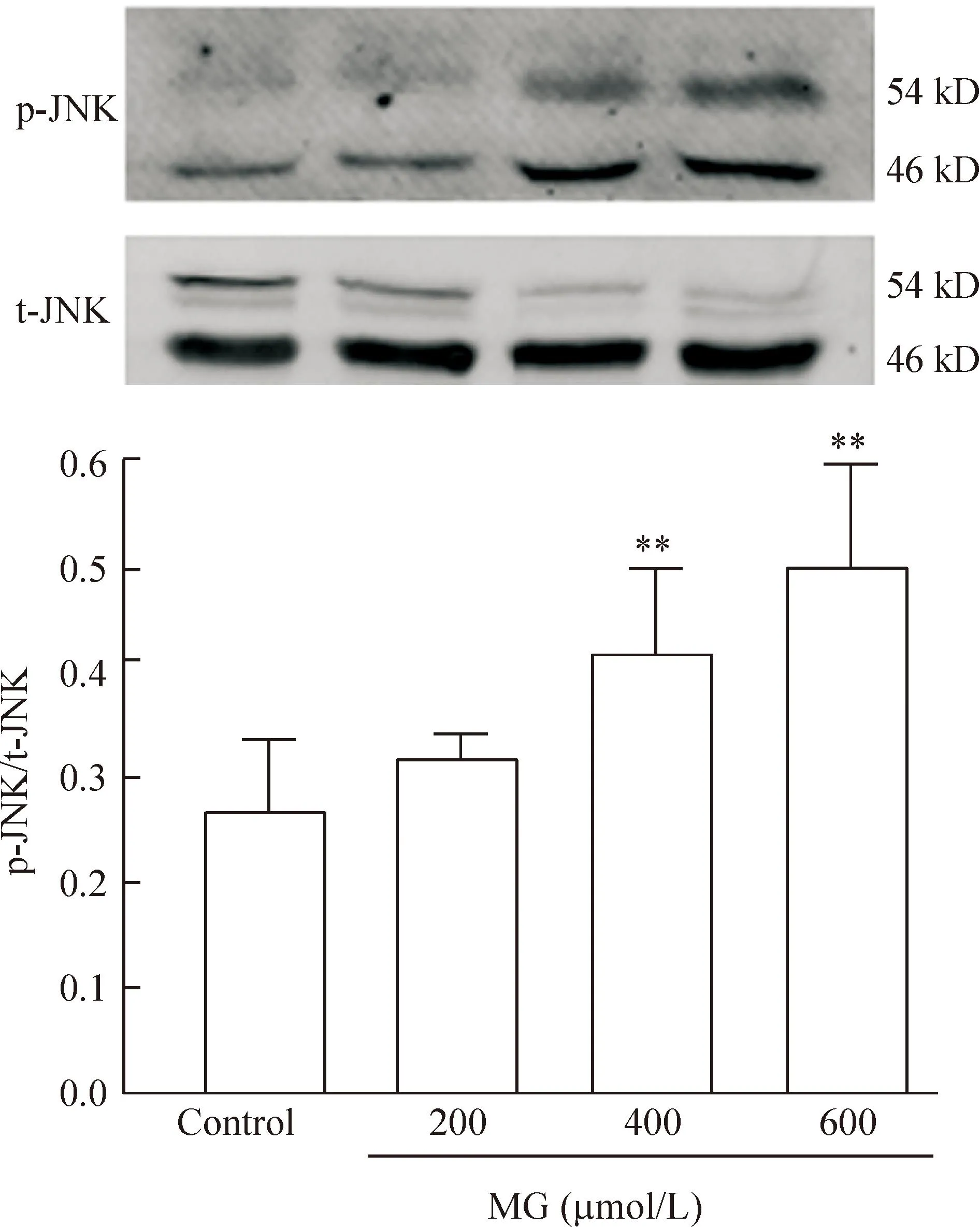
Figure 3.Effects of MG at different concentrations on JNK phosphorylation. Mean±SD.n=3.**P<0.01vscontrol group.
图3不同浓度的MG对磷酸化JNK蛋白表达的影响
4NAC抑制MG诱导的H9c2心肌细胞内JNK蛋白的磷酸化
图4显示,静息状态的H9c2心肌细胞有少量的p-JNK表达,经400 μmol/L MG损伤后p-JNK的表达明显增加(P<0.01),而加入1 500 μmol/L NAC共处理后可抑制MG诱导的p-JNK的表达上调,差异有统计学意义(P<0.01)。NAC本身对心肌细胞p-JNK表达无明显影响。
5抑制JNK活化介导NAC保护H9c2细胞对抗MG引起的ROS水平升高
如图5所示,细胞内的ROS水平通过DCFH-DA染色进行检测,DCF的荧光强度与ROS的水平呈正比,即绿色荧光越强,提示ROS的生成越多。正常H9c2细胞内仅有少量ROS生成;与对照组相比,经400 μmol/L MG损伤24 h后,心肌细胞内ROS生成水平明显升高(P<0.01);但在MG作用同时用1 500 μmol/L NAC共处理,可明显抑制MG诱导的ROS的生成增加,差异有统计学意义(P<0.01); 25 μmol/L的SP600125预处理亦可抑制MG诱导的ROS的生成增多;NAC和SP600125本身不影响心肌细胞内ROS的生成。

Figure 4.Effects of NAC on MG-induced increase in phosphorylation of JNK in H9c2 cells.Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsMG group.
图4NAC对 MG诱导的磷酸化JNK表达上调的影响
6抑制JNK活化介导NAC对抗MG引起的MMP降低
如图6显示,线粒体膜受到损伤后膜电位就会降低。Rh123荧光染色法可检测细胞内MMP的改变。与对照组相比,H9c2心肌细胞经400 μmol/L MG损伤24 h后,MMP 明显降低,差异有统计学意义(P<0.01) ,但同时给予1 500 μmol/L NAC,H9c2细胞的MMP降低较MG损伤组明显改善(P<0.01);用25 μmol/L SP600125预处理30 min,亦可改善400 μmol/L MG 引起的MMP降低;NAC和SP600125本身不影响心肌细胞的MMP。
7抑制JNK活化介导NAC的抗凋亡作用
采用Hoechst 33258核染色法检测H9c2心肌细胞凋亡。正常的心肌细胞染色质分布均匀,呈现弥散的低密度蓝色荧光,MG处理组心肌细胞大部分呈现典型的凋亡特征,即细胞核固缩、出现颗粒状荧光,1 500 μmol/L NAC可明显地抑制MG诱导的致凋亡作用,使凋亡细胞数目减少;在MG处理前,用25 μmol/L SP600125预处理细胞30 min,亦可对抗MG引起的心肌细胞凋亡;NAC和SP600125本身对心肌细胞凋亡无明显影响,见图7。

Figure 5.Effects of NAC and MG treatment on ROS level of H9c2 cells (×100). ROS were measured by DCFH-DA staining followed by photofluorography. Mean±SD.n=5.**P<0.01vscontrol group;##P<0.01vsMG group.
图5MG与NAC对H9c2心肌细胞内ROS水平的影响
讨论
实验结果表明,丙酮醛能够抑制H9c2心肌细胞的存活率并诱导心肌细胞氧化应激,并且呈浓度依赖性,提示丙酮醛具有心肌细胞毒性作用,这与国内外研究结论一致[9-11]。丙酮醛的细胞毒性可能与其诱导细胞氧化应激反应有关,表现为丙酮醛能使H9c2心肌细胞内ROS生成增多, MMP降低,提示丙酮醛一方面可增加细胞内氧自由基的生成,另一方面使心肌细胞内抗氧化能力减弱,从而损伤心肌细胞的线粒体功能。课题组前期研究证实,与丙酮醛相类似,二氯化钴通过促进细胞内ROS生成、降低MMP引起H9c2心肌细胞损伤[12],与本实验结果相一致。
NAC可以对抗丙酮醛对心肌细胞的毒性作用,明显地抑制丙酮醛对细胞内ROS生成的促进作用,改善细胞MMP。上述结果表明,NAC的抗丙酮醛心肌细胞毒性作用可能与其抑制心肌细胞的氧化应激反应有关。NAC是一种疗效较好的祛痰剂,有研究表明NAC还具有较强的抗氧化功能,可清除已生成的自由基、抗细胞凋亡等作用[7, 13-14],本研究结果证实,NAC可通过抑制心肌细胞的氧化应激反应发挥抗丙酮醛对心肌细胞的毒性作用。

Figure 6.Effects of NAC and MG treatment on MMP level of H9c2 cells (×100). MMP of H9c2 cells was detected using the fluorescent dye Rh123. Mean±SD.n=5.**P<0.01vscontrol group;#P<0.05vsMG group.
图6MG与NAC对H9c2心肌细胞内线粒体膜电位(MMP)的影响
此外,JNK属于丝分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)家族中的一个重要成员,JNK信号通路是糖尿病发病机制的重要通路[15]。本实验结果表明,丙酮醛能够促进心肌细胞c-Jun N端激酶(c-Jun N-terminal kinase, JNK)的活化,NAC则通过抑制JNK磷酸化对抗MG引起的心肌细胞损伤。与NAC类似,加入JNK抑制剂后可起到抗氧化应激、改善线粒体膜电位、抗凋亡的作用。以往多项研究表明,糖尿病状态下,氧化应激能导致JNK激活[16-17],这与本实验结果一致。因此我们推测丙酮醛损伤心肌细胞的机制可能与氧化应激进而活化JNK有关,而NAC可能通过清除细胞内活性氧抑制JNK磷酸化。
综上所述,丙酮醛对H9c2心肌细胞有损伤作用,这可能与其引起细胞内氧化应激及促进JNK磷酸化有关。NAC能对抗丙酮醛诱导的心肌细胞损伤作用,其机制可能与其抑制JNK磷酸化、抗氧化应激、抗凋亡有关。本实验将为NAC的进一步应用提供实验依据。
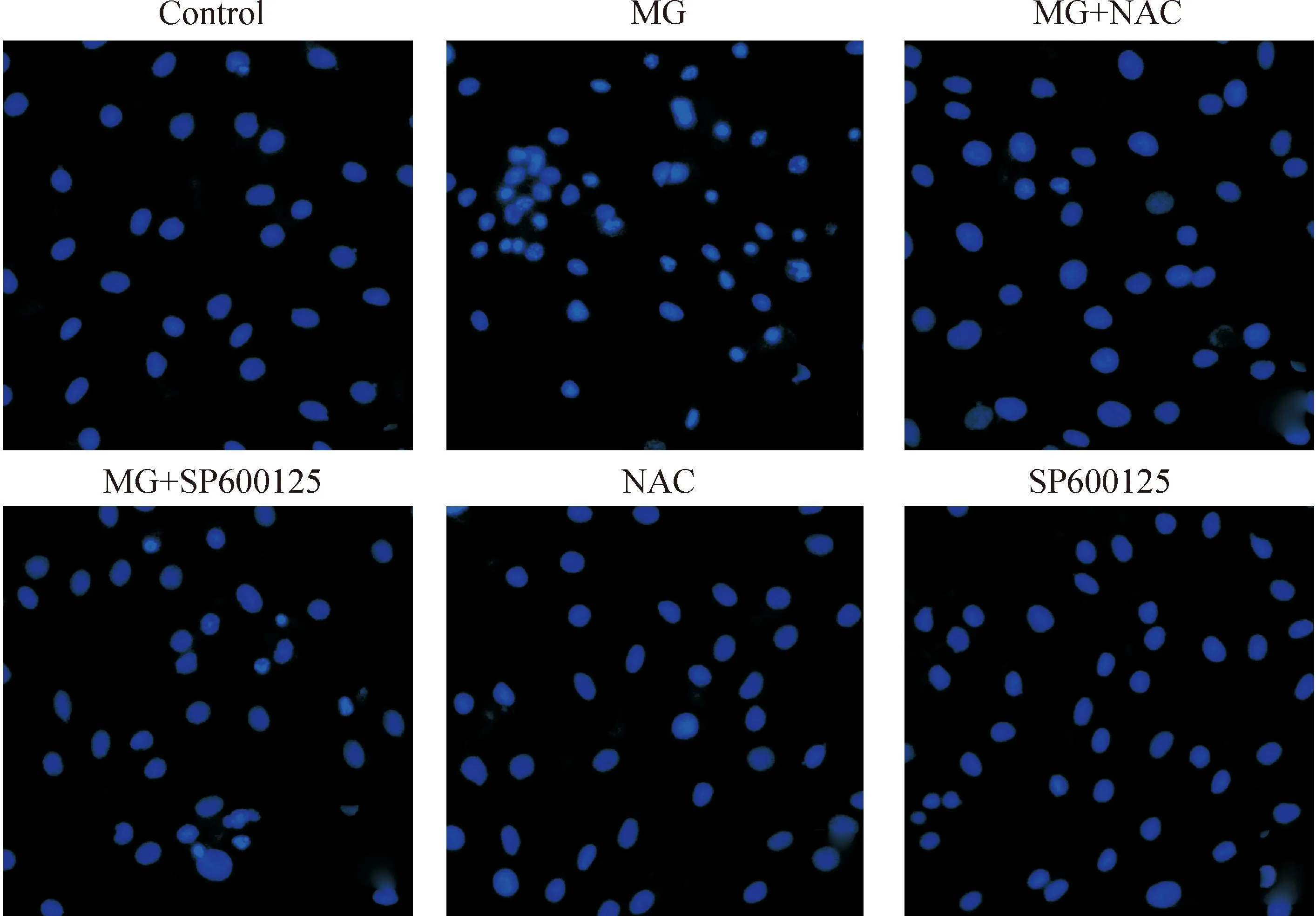
Figure 7.Effects of NAC on apoptosis (×100) .Morphological changes in cellular apoptosis in H9c2 cells were assessed by Hoechst 33258 staining.
图7NAC的抗凋亡作用
[参考文献]
[1]Bugger H, Abel ED. Molecular mechanisms of diabetic cardiomyopathy[J]. Diabetologia,2014,57(4):660-671.
[2]Boudina S, Abel ED. Diabetic cardiomyopathy revisited[J]. Circulation,2007,115(25):3213-3223.
[3]邓建新,刘文娟,林泽勋,等. 晚期糖基化终产物改变心肌细胞自发钙火花形态学[J]. 中国病理生理杂志,2014,30(11):2076-2078.
[4]Ramasamy R, Yan SF, Schmidt AM. Methylglyoxal comes of AGE[J]. Cell,2006,124(2):258-260.
[5]Goldin A, Beckman JA, Schmidt AM, et al. Advanced glycation end products: sparking the development of diabetic vascular injury[J]. Circulation,2006,114(6):597-605.
[6]Turk Z, Nemet I, Varga-Defteardarovic L, et al. Elevated level of methylglyoxal during diabetic ketoacidosis and its recovery phase[J]. Diabetes Metab,2006,32(2):176-180.
[7]Lasram MM, Dhouib IB, Annabi A, et al. A review on the possible molecular mechanism of action of N-acetylcysteine against insulin resistance and type-2 diabetes development[J]. Clin Biochem,2015,48(16-17):1200-1208.
[8]刘辉国,张志锋,高永平,等.N-乙酰半胱氨酸对慢性间歇缺氧大鼠海马神经元凋亡及氧化应激的影响[J]. 中国病理生理杂志,2008,24(1):36-39.
[9]Hong FY, Bao JF, Hao J, et al. Methylglyoxal and advanced glycation end-products promote cytokines expression in peritoneal mesothelial cells via MAPK signaling[J]. Am J Med Sci,2015,349(2):105-109.
[10]Allaman I, Bélanger M, Magistretti PJ. Methylglyoxal, the dark side of glycolysis[J]. Front Neurosci,2015,9:23.
[11]李汶潞,胡全,任夏,等. 氨基胍抑制丙酮醛介导的脑微血管内皮细胞缺糖缺氧损伤[J]. 浙江大学学报:医学版,2013,42(3):261-266.
[12]魏水生,廖新学,杨春涛,等. 活性氧清除剂保护心肌细胞对抗化学性缺氧损伤[J]. 南方医科大学学报,2009,29(10):1977-1981.
[13]Rushworth GF, Megson IL. Existing and potential therapeutic uses for N-acetylcysteine: the need for conversion to intracellular glutathione for antioxidant benefits[J]. Pharmacol Ther,2014,141(2):150-159.
[14]Samuni Y, Goldstein S, Dean OM, et al. The chemistry and biological activities of N-acetylcysteine[J]. Biochim Biophys Acta,2013,1830(8):4117-4129.
[15]Wold LE, Ceylan-Isik AF, Ren J. Oxidative stress and stress signaling: menace of diabetic cardiomyopathy[J]. Acta Pharmacol Sin,2005,26(8):908-917.
[16]Martinovic V, Grigorov I, Bogojevic D, et al. Activation level of JNK and Akt/ERK signaling pathways determinates extent of DNA damage in the liver of diabetic rats[J]. Cell Physiol Biochem,2012,30(3):723-734.
[17]Xuan YH, Huang BB, Tian HS, et al. High-glucose inhibits human fibroblast cell migration in wound healing via repression of bFGF-regulating JNK phosphorylation[J]. PLoS One,2014,9(9):e108182.
(责任编辑: 林白霜, 罗森)
N-acetylcysteine protects H9c2 cells against injuries induced by methyl-glyoxal
DONG Xiao-bian1, WU Juan1, 2, ZHUANG Xiao-dong1, HUANG Ze-na1, HU Xun1, LIAO Xin-xue1
(1DepartmentofCardiovasology,TheFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China;2DepartmentofCardiovasology,JiangmenCentralHospital,Jiangmen529030,China.E-mail:liaoxinx@mail.sysu.edu.cn)
[ABSTRACT]AIM: To investigate the protective effect of N-acetylcysteine (NAC) on H9c2 cells from injuries induced by methylglyoxal (MG) and the potential mechanism. METHODS: H9c2 cells were divided into control group, MG treatment group, NAC + MG treatment group, SP600125 pretreatment + MG group, NAC group and SP600125 group. The viability of the H9c2 cells was measured by CCK-8 assay. The protein levels of p-JNK and t-JNK were tested by Western blot. The changes of intracellular reactive oxygen species (ROS) were evaluated by 2′, 7′- dichlorofluorescein diacetate (DCFH-DA) staining. Mitochondrial membrane potential (MMP) was measured by rhodamine 123 (Rh123) staining. The morphological changes in apoptotic cardiomyocytes were detected by Hoechst 33258 staining. RESULTS: Du-ring 100~800 μmol/L concentration range, MG caused significantly reduced viability of the H9c2 cells in a dose-dependent manner. NAC had a protective effect on H9c2 cells against the injuries induced by MG during 500~1 500 μmol/L concentration range through raising cell viability, inhibiting cellular oxidative stress and improving MMP (P<0.01). SP600125,an inhibitor of JNK, showed the protective effect similar to NAC on H9c2 cells against MG-induced injuries, including attenuating oxidative stress, improving MMP and suppressing apoptosis.CONCLUSION: N-acetylcysteine offers obvious protective effect on H9c2 cells against the injuries induced by methylglyoxal. The underlying mechanisms may be associated with decreasing the production of ROS, ameliorating MMP, inhibiting the activation of JNK and suppressing apoptosis.
[KEY WORDS]H9c2 cells; N-acetylcysteine; Methylglyoxal; c-Jun N-terminal kinase
doi:10.3969/j.issn.1000- 4718.2016.03.003
[中图分类号]R363
[文献标志码]A
通讯作者△Tel: 020-87332200; E-mail: liaoxinx@mail.sysu.edu.cn
*[基金项目]国家自然科学基金资助项目(No. 81270296);广东省财厅社会发展项目(No.2014SC107)
[收稿日期]2015- 10- 19[修回日期] 2015- 12- 21
[文章编号]1000- 4718(2016)03- 0398- 07
杂志网址: http://www.cjpp.net
