硫化氢通过抑制坏死性凋亡对抗高糖引起的H9c2心肌细胞损伤*
2016-04-15梁伟杰何洁仪张稳柱余盛龙宋明才陈景福郑东诞廖新学
梁伟杰, 何洁仪, 张稳柱, 余盛龙, 陈 君, 宋明才, 陈景福, 郑东诞, 廖新学
(1广州市番禺区中心医院心血管内科, 2广州市番禺区心血管疾病研究所,广东 广州 511400; 3中山大学附属第一医院黄埔院区心血管内科CCU,广东 广州 510700; 4中山大学附属第一医院心血管内科,广东 广州 510080)
硫化氢通过抑制坏死性凋亡对抗高糖引起的H9c2心肌细胞损伤*
梁伟杰1,2,何洁仪1,2,张稳柱1,2,余盛龙1,2,陈君1, 2,宋明才1,2,陈景福3,郑东诞3,廖新学4△
(1广州市番禺区中心医院心血管内科,2广州市番禺区心血管疾病研究所,广东 广州 511400;3中山大学附属第一医院黄埔院区心血管内科CCU,广东 广州 510700;4中山大学附属第一医院心血管内科,广东 广州 510080)
[摘要]目的: 探讨硫化氢(hydrogen sulfide,H2S)能否通过调控坏死性凋亡(necroptosis)对抗高糖(HG)引起的H9c2 心肌细胞损伤。方法:应用Western blot法检测心肌细胞内能反映坏死性凋亡的RIP3蛋白和cleaved caspase-3蛋白的水平;细胞计数盒测定心肌细胞存活率;双氯荧光素染色荧光显微镜照相法检测细胞内活性氧簇(reactive oxygen species,ROS)水平;罗丹明 123染色荧光显微镜照相法测定线粒体膜电位(mitochondrial membrane potential,MMP);Hoechst 33258核染色荧光显微镜照相法测定凋亡细胞的数量。结果:应用HG (35 mmol/L葡萄糖)处理H9c2 心肌细胞3 h、6 h、9 h、12 h和24 h均能明显地上调RIP3蛋白的表达水平,其中24 h时RIP3蛋白水平增加最明显。400 μmol/L硫氢化钠(NaHS;为H2S的供体)预处理或坏死性凋亡的特异性阻断剂necrostatin-1(Nec-1;100 μmol/L)共处理心肌细胞均能明显地抑制HG对RIP3蛋白表达的上调作用。此外,NaHS预处理或Nec-1共处理心肌细胞均显著地抑制HG引起的心肌细胞损伤,使细胞存活率升高,ROS生成及MMP丢失减少。另一方面,400 μmol/L NaHS预处理心肌细胞能使凋亡细胞数量及cleaved caspase-3表达明显减少。结论:H2S可通过抑制坏死性凋亡保护心肌细胞,对抗高糖引起的损伤。
[关键词]坏死性凋亡; 硫化氢; 高糖; 心肌细胞
细胞是机体基本结构和功能单位。细胞死亡是生命的基本过程,对多细胞生物的发育和自稳平衡极其重要。细胞死亡可分为凋亡(apoptosis)、坏死(necrosis)、自噬(autophagy)和坏死性凋亡(necroptosis)[1-2]。细胞凋亡是主动的程序性死亡方式,细胞坏死一直被认为是一种随机且不受基因调控的细胞死亡方式。而坏死性凋亡是一种非凋亡性的程序性死亡方式,即细胞既具有坏死的形态学改变,又具有凋亡所具备的规律性调控机制[3]。坏死性凋亡是一种新发现的细胞死亡方式,参与缺血性心脑血管疾病、神经退行性疾病和肝、肾脏器损害等多种疾病的发生[3-6],深入研究坏死性凋亡的发生机制有助于更好地理解体内许多病理生理过程并寻找疾病治疗的新靶点。在坏死性凋亡的发生发展过程中,受体相互作用蛋白(receptor-interacting protein,RIP)发挥极其重要的调控作用,是反映坏死性凋亡的重要指标。目前,RIP蛋白家族由RIP1~RIP7共7个成员组成,其中RIP1和RIP3是参与坏死性凋亡的关键分子蛋白,其相互作用是启动坏死性凋亡的关键。RIP3的表达与坏死性凋亡呈正相关,下调RIP3后可以阻止细胞发生坏死性凋亡[3-4,6]。有研究指出,在链脲霉素(streptozotocin,STZ)诱导的糖尿病大鼠,心肌炎症、纤维化及肥厚的发生伴随着RIP3的大量表达[7],提示坏死性凋亡可能参与高血糖引起的心肌损伤,但该研究小组没有观察抑制坏死性凋亡活动后能否对抗高血糖引起的心肌损伤作用。因此,进一步证实这个问题,对防治糖尿病心血管并发症的发生有重要的意义。
硫化氢(hydrogen sulfide,H2S)是继NO和CO之后第3种内源性气体信号分子[8]。近年来,H2S在心血管系统的保护作用备受关注。我们已证实外源性H2S能保护H9c2 心肌细胞对抗高糖引起的心肌细胞毒性、氧化应激、线粒体损伤、炎症及致凋亡作用等一系列的损伤[9-12]。根据既往的研究[7],我们推测坏死性凋亡可能参与高血糖引起的心肌细胞损伤,但是,H2S能否通过对抗高糖引起的坏死性凋亡从而发挥其心肌保护作用,目前国内外尚未见报道。
为此,本研究建立高糖损伤H9c2心肌细胞模型[9],旨在探讨坏死性凋亡在高糖引起心肌细胞损伤中的作用及外源性H2S能否通过抑制坏死性凋亡对抗高糖引起的心肌细胞损伤。
材料和方法
1材料
抗RIP3抗体购自CST;necrostatin-1(Nec-1)、抗cleaved caspase-3抗体、硫氢化钠(NaHS)、双氯荧光素(2’, 7’-dichlorfluorescein diacetate,DCFH-DA)、Hoechst 33258和罗丹明123(rhodamine 123,Rh 123)购自Sigma;细胞计数试剂盒8(Cell Counting Kit-8, CCK-8)由Dojindo供应;DMEM培养基购自HyClone;特级胎牛血清购自Gibco。H9c2 心肌细胞由中山大学实验动物中心提供。
2方法
2.1细胞培养H9c2 心肌细胞来源于大鼠胚胎期的心脏组织,培养于含10%胎牛血清的DMEM培养基,置于5% CO2、37 ℃的细胞培养箱中培养。
2.2实验分组实验分为6组:(1)正常对照(control)组:DMEM培养基(5.5 mmol/L 葡萄糖)处理心肌细胞24 h;(2)高糖(high glucose,HG)损伤组:35 mmol/L 葡萄糖处理心肌细胞24 h;(3)NaHS+HG组:400 μmol/L NaHS作用心肌细胞30 min,撤去,PBS洗2次,接着用35 mmol/L葡萄糖处理24 h;(4)Nec-1+HG组:100 μmol/L Nec-1与35 mmol/L葡萄糖共处理心肌细胞24 h;(5)NaHS组:400 μmol/L NaHS作用心肌细胞30 min,撤去,PBS洗2次,接着DMEM培养基处理24 h;(6)Nec-1组:100 μmol/L Nec-1 与DMEM培养基共处理心肌细胞24 h。
2.3Western blot法检测RIP3和cleaved caspase-3的蛋白水平将H9c2 心肌细胞接种于60 mm的培养皿中,培养至80%时,各实验组给予不同的处理因素后,用预冷的PBS冲洗3次,加入裂解液,4 ℃静置30 min,12 000 r/min离心15 min,吸取上清液,采用BCA法进行蛋白定量。总蛋白经十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离后,转移到PVDF膜上。用5%脱脂奶粉封闭60 min,随后加入抗RIP3抗体或抗cleaved caspase-3抗体(1∶1 000),4 ℃摇床孵育过夜,然后用TBST洗3次,每次5 min,与相应的 II 抗(1∶2 500)在室温孵育1.5 h,用TBST洗3次,5 min/次。将PVDF膜用发光试剂ECL显色,暗室曝光到X线片上,凝胶成像系统扫描分析结果。实验重复5次。
2.4CCK-8测定细胞存活率将H9c2 心肌细胞接种于96孔培养板中,当心肌细胞生长到占培养孔面积大约80%时,按各分组处理后,于每孔中加入10 μL CCK-8和90 μL DMEM,轻摇,37 ℃孵育2.5 h,用酶标仪(λ=450 nm)记录各孔吸光度(A)。取5孔A值的平均数,按下列公式计算细胞存活率:细胞存活率(%)=处理组A值/对照组A值×100%。实验重复5次。
2.5DCFH-DA染色测定胞内ROS水平将H9c2 心肌细胞接种于24孔培养板中,当细胞生长到培养孔面积大约80%时,经上述各实验组不同的处理因素作用后,PBS冲洗3次,用10 μmol/L DCFH-DA染液于37 ℃温箱中孵育30 min,然后用PBS冲洗3次。在荧光显微镜(TE-2000 Nikon)下随机选取5个不重复区摄片,用ImageJ 1.47i软件分析5个视野绿色荧光强度的平均值[平均荧光强度(mean fluorescent intensity,MFI),间接反映ROS水平的指标],再对每组的各样本进行统计分析。实验重复5次。
2.6Rh 123染色测定线粒体膜电位(mitochondrial membrane potential,MMP)将H9c2 心肌细胞接种于24孔培养板中,当细胞生长到培养孔面积大约80%时,上述各实验组经不同的处理因素作用后,用PBS冲洗3次,用10 μg/L Rh 123的无血清培养基于37 ℃温箱中孵育45 min,然后用PBS冲洗3次。在荧光显微镜下随机选取5个不重复区摄片,细胞核周围绿色的亮点即为摄取了Rh 123的线粒体。用ImageJ 1.47i软件分析5个视野绿色荧光的MFI(数值大小可间接反映MMP水平),再对每组的各样本进行统计分析。实验重复5次。
2.7Hoechst 33258核染色检测细胞凋亡将H9c2心肌细胞接种于24孔培养板中,在细胞生长到占培养孔面积大约80%时,按各分组处理后,用PBS冲洗3次,然后用4%多聚甲醛于4 ℃环境中固定10 min,加入含5 mg/L Hoechst 33258试剂,于37 ℃温箱孵育30 min,在荧光显微镜(TE-2000 Nikon)下摄片,鉴别正常的心肌细胞和凋亡的心肌细胞,随机选取视野在荧光显微镜下摄片。实验重复5次。
3统计学处理
实验数据用 SPSS 17.0软件进行统计分析,所有结果以均数±标准误(mean±SEM)表示,组间比较采用单因素方差分析(one-way ANOVA),用SNK-q检验进行均数之间的两两比较,以P<0.05为差异有统计学意义。
结果
1Nec-1抑制HG对心肌细胞RIP3蛋白表达的上调作用
高糖分别处理H9c2 心肌细胞0~24 h,其中,3 h时RIP3蛋白的表达水平开始明显升高(P<0.01),6 h、9 h、12 h时进一步升高(P<0.01),HG作用24 h时,RIP3蛋白表达水平最高(P<0.01)。应用100 μmol/L坏死性凋亡的特异性阻断剂Nec-1与HG共处理心肌细胞24 h,能明显抑制HG对RIP3的上调作用,与HG损伤组比较,差异有统计学显著性(P<0.01)。100 μmol/L Nec-1本身对心肌细胞RIP3蛋白的基础表达水平无明显影响,见图1。

Figure 1.Necrostatin-1 (Nec-1; an inhibitor of necroptosis) attenuated high glucose (HG; 35 mmol/L glucose)-induced up-regulation of RIP3 expression in the H9c2 cardiac cells. Mean±SEM.n=5.**P<0.01vscontrol group;##P<0.01vsHG group.
图1Nec-1抑制高糖对H9c2 心肌细胞RIP3表达的上调作用
2H2S减弱高糖对心肌细胞RIP3蛋白表达的上调作用
HG处理心肌细胞24 h可使RIP3蛋白的表达明显增多,但是,在HG处理心肌细胞前,应用400 μmol/L NaHS预处理30 min可使HG对RIP3蛋白表达的上调作用显著减弱,与HG处理组比较,差异有统计学显著性(P<0.01)。400 μmol/L NaHS本身对心肌细胞RIP3蛋白的基础表达水平无明显的影响,见图2。

Figure 2.Hydrogen sulfide (H2S) attenuated HG-induced up-regulation of RIP3 expression in the H9c2 cardiac cells. Mean±SEM.n=5.**P<0.01vscontrol group;##P<0.01vsHG group.
图2H2S减弱高糖对心肌细胞RIP3表达的上调作用
3H2S和Nec-1抑制高糖引起的心肌细胞毒性
高糖处理H9c2 心肌细胞24 h,可诱导明显的细胞毒性,使细胞存活率明显降低,与正常对照组比较,差异有统计学显著性(P<0.01)。但是,应用400 μmol/L NaHS预处理心肌细胞30 min能明显地抑制HG引起的心肌毒性,使细胞存活率升高,与HG组处理组比较,差异有统计学显著性(P<0.01)。400 μmol/L NaHS本身不影响心肌细胞的存活率。
与NaHS的作用相类似,应用100 μmol/L Nec-1共处理心肌细胞24 h也能对抗HG对细胞存活率的抑制作用(P<0.01)。单纯予100 μmol/L Nec-1共处理心肌细胞对细胞存活率无明显的影响,见图3。
4H2S和Nec-1抑制高糖引起的心肌细胞氧化应激反应
高糖作用心肌细胞可引起明显的氧化应激反应,表现为MFI明显增强,与正常对照(control)组比较,差异有统计学显著性(P<0.01)。但是,HG+NaHS组显示400 μmol/L NaHS预处理心肌细胞30 min能使胞内ROS生成明显地减少,MFI从(30.60±1.25)%减少至(14.00±1.06)%,与HG组比较,差异有统计学显著性(P<0.01)。与NaHS的作用相类似,应用100 μmol/L Nec-1共处理心肌细胞24 h也能使细胞内氧化应激反应减轻,MFI减少至(13.60±1.38)%。分别应用400 μmol/L NaHS或100 μmol/L Nec-1处理心肌细胞对ROS的基础生成无明显的影响,见图4。

Figure 3.Hydrogen sulfide (H2S) and necrostatin-1 (Nec-1) inhibited HG-induced cytotoxicity in the H9c2 cardiac cells. Mean±SEM.n=5.**P<0.01vscontrol group;##P<0.01vsHG group.
图3H2S和Nec-1抑制高糖引起的心肌细胞毒性
5H2S和Nec-1减少高糖引起的心肌细胞线粒体膜电位丢失
如图5所示,采用HG作用H9c2心肌细胞24 h可使胞内Rh 123的MFI从(30.50±1.27)%降低至(9.57±0.90)%,2组差异有统计学显著性(P<0.01)。然而,400 μmol/L NaHS预处理心肌细胞30 min能显著地减少MMP的丢失,使MFI升高至(20.40±1.38)%,与HG处理组比较,差异有统计学显著性(P<0.01)。与NaHS的作用相类似,应用100 μmol/L Nec-1共处理心肌细胞24 h也能对抗HG对心肌细胞线粒体的损伤,使MFI增加至(20.50±1.20)%。分别应用400 μmol/L NaHS或100 μmol/L Nec-1处理心肌细胞对细胞MMP的大小无显著影响。
6H2S抑制高糖的致心肌细胞凋亡作用
Hoechst核染色的检测结果显示,正常H9c2心肌细胞的染色质分布均匀,呈现出弥散均匀的低密度荧光。应用HG处理心肌细胞24 h后,呈现典型的凋亡特征(即细胞核呈现浓缩致密的固缩形态或颗粒荧光)的细胞数量增多,与正常对照组比较,差异具有统计学显著性(P<0.01)。应用400 μmol/L NaHS预处理心肌细胞30 min能明显地减少凋亡细胞数量,与HG处理组比较,差异有统计学显著性(P<0.01)。
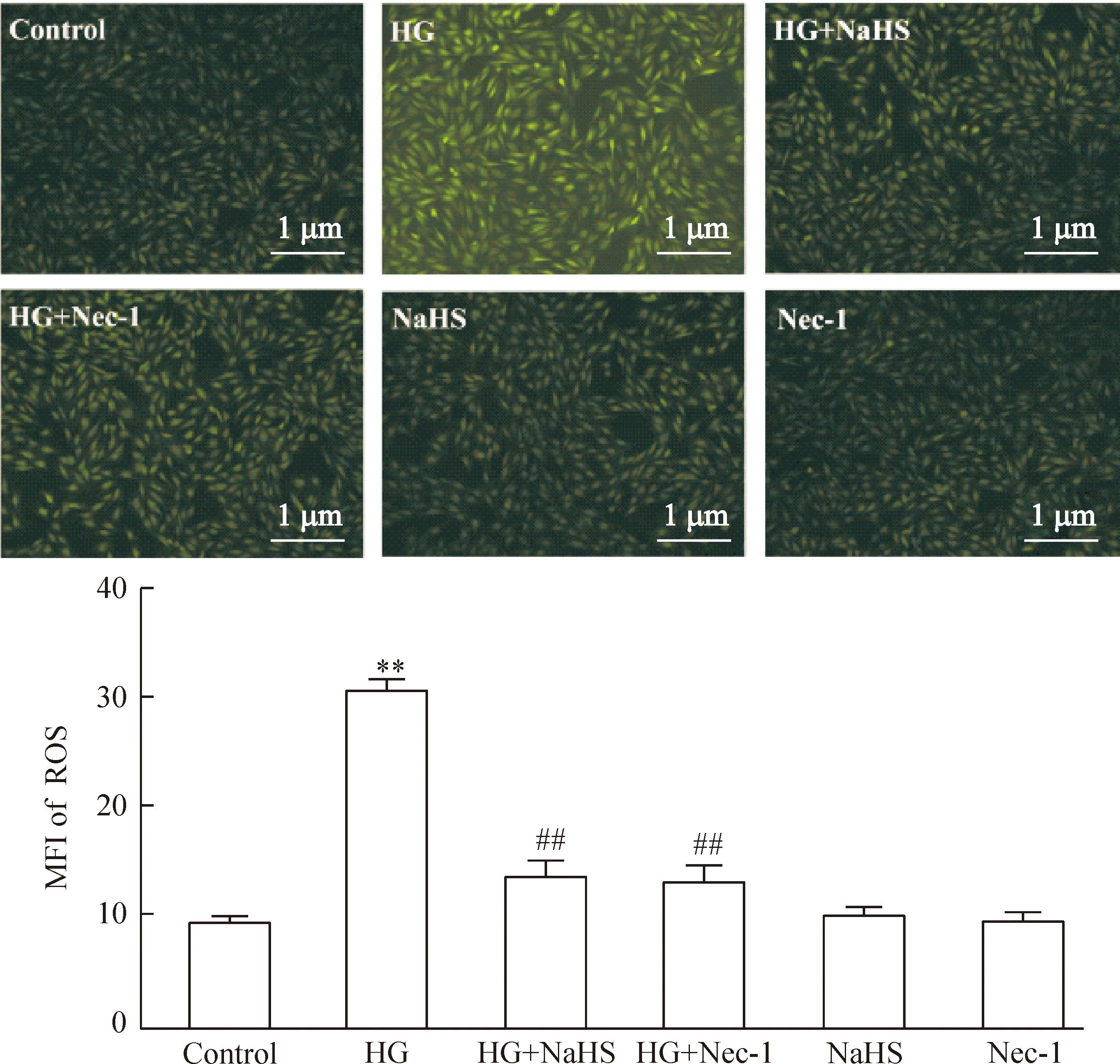
Figure 4.Hydrogen sulfide (H2S) and necrostatin-1 (Nec-1) inhibited HG-induced accumulation of intracellular reactive oxygen species (ROS) in the H9c2 cardiac cells. Mean±SEM.n=5.**P<0.01vscontrol group;##P<0.01vsHG group.
图4H2S和Nec-1抑制高糖引起的心肌细胞氧化应激反应

Figure 5.Hydrogen sulfide (H2S) and necrostatin-1 (Nec-1) inhibited HG-induced loss of mitochondrial membrane potential (MMP) in the H9c2 cardiac cells. Mean±SEM.n=5.**P<0.01vscontrol group;##P<0.01vsHG group.
图5H2S和Nec-1抑制高糖引起的心肌细胞线粒体膜电位丢失
同样地,HG处理心肌细胞24 h能明显增加cleaved caspase-3(为凋亡的终末效应器)的水平,应用400 μmol/L NaHS预处理心肌细胞30 min能使cleaved caspase-3的蛋白水平明显减少,与HG损伤组比较,差异有统计学显著性(P<0.01),见图6。

Figure 6.Hydrogen sulfide (H2S) reduced HG-induced apoptosis of H9c2 cells. A: Hoechst 33258 staining; B: cleaved caspase-3 protein expression detected by Western blot. Mean±SEM.n=5.**P<0.01vscontrol group;##P<0.01vsHG group.
图6H2S抑制高糖的致心肌细胞凋亡作用
讨论
坏死性凋亡是一种新发现的细胞死亡方式,既具有坏死的形态学特征,又具有凋亡所具备的程序性调控机制,其英文命名“necroptosis”就是由凋亡(aptoptosis)和坏死(necrosis)2个单词组合而成。研究证实:坏死性凋亡参与缺血性心脏血管疾病和神经退行性疾病等的发生[3-7],是目前国际上极其活跃的研究热点之一。研究表明,RIP1和RIP3是启动坏死性凋亡的关键蛋白分子[3-4,6,13]。Luedde等[13]证实:心肌梗死的大鼠,其心肌细胞的RIP3蛋白表达明显上调,而过量表达的RIR3可导致坏死性凋亡的发生。Liu等[7]报道:在链脲霉素诱导的糖尿病大鼠,心肌炎症、纤维化、肥厚的发生伴随着RIP3的大量表达,提示糖尿病大鼠的心肌存在坏死性凋亡。与他们的研究结果相类似,本研究观察到HG在引起心肌细胞损伤的同时,可呈时间依赖性地上调心肌细胞RIP3蛋白的表达水平,并从细胞学水平进一步证实,HG可引起心肌细胞坏死性凋亡的发生。为了进一步证实坏死性凋亡在HG损伤心肌细胞中的作用,本研究观察了坏死性凋亡的特异性抑制剂Nec-1对HG诱导的心肌细胞损伤的影响,结果表明,Nec-1在抑制RIP3蛋白表达上调的同时,还能减轻HG引起的心肌细胞多种损伤,使细胞存活率升高、ROS生成及MMP丢失减少。上述结果清晰地提示:坏死性凋亡介导HG导致的细胞毒性、氧化应激和线粒体损伤等心肌损伤,这进一步扩展了Liu等[7]的研究结果,为阐明坏死性凋亡在糖尿病心肌损伤中的作用提供了新的实验依据。
H2S是继NO和CO之后的第3种内源性气体信号分子,具有多种生理和病理生理功能。最近,H2S在糖尿病相关的心血管系统并发症中的防治作用得到了国内外学者的极大关注。我们已证实H2S通过调控p38 丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)、瘦素(leptin)、核因子κB(nuclear factor-κB,NF-κB)信号通路和ATP敏感性钾通道(ATP-sensitive K+channel, KATP通道)[9-12],保护心肌细胞对抗高糖引起的一系列损伤,包括抗细胞毒性、抗氧化、减轻线粒体损伤、抗炎症和抗凋亡等。但H2S的心肌细胞保护作用及机制是十分复杂的,可能涉及其它未知的作用和信号通路,因此,进一步深入探讨H2S的心肌保护作用及机制非常有意义。本研究重点探讨了H2S能否通过抑制坏死性凋亡对抗HG引起的心肌细胞损伤。我们首先观察了H2S对HG促进RIP3表达作用的影响。结果表明,H2S能抑制HG对心肌细胞RIP3蛋白表达的上调作用。此外,应用H2S预处理心肌细胞和应用Nec-1共处理心肌细胞均产生类似的心肌保护作用,表现为细胞存活率升高、ROS 生成及MMP丢失减少。这些结果充分地证明:H2S是坏死性凋亡的抑制剂之一,抑制坏死性凋亡可能是H2S心肌细胞保护作用的另一个重要机制。值得注意的是,Han等[14]报道,应用坏死性凋亡的抑制剂Nec-1可使紫草素诱导的肿瘤细胞(HL60细胞)坏死性凋亡转化为凋亡,即加重细胞凋亡的发生。但是,本研究并没有观察到H2S在抑制坏死性凋亡的同时,增加心肌细胞凋亡发生的情况。同时能抑制坏死性凋亡和细胞凋亡(表现为凋亡细胞数量及cleaved caspase-3表达减少),表明H2S是理想的心肌细胞保护剂。
[参考文献]
[1]Nunes T, Bernardazzi C, de Souza HS. Cell death and inflammatory bowel diseases: apoptosis, necrosis, and autophagy in the intestinal epithelium[J]. Biomed Res Int, 2014, 2014:218493.
[2]Fenton K. The effect of cell death in the initiation of lupus nephritis[J]. Clin Exp Immunol, 2015, 179(1):11-16.
[3]Golstein P, Kroemer G. Cell death by necrosis: towards a molecular definition[J]. Trends Biochem Sci, 2007, 32(1):37-43.
[4]Degterev A, Zhou W, Maki JL, et al. Assays for necroptosis and activity of RIP kinases[J]. Methods Enzymol, 2014, 545:1-33.
[5]Dmitriev YV, Minasian SM, Demchenko EA, et al. Study of cardioprotective effects of necroptosis inhibitors on isolated rat heart subjected to global ischemia-reperfusion[J]. Bull Exp Biol Med, 2013, 155(2):245-248.
[6]Cho YS, Challa S, Moquin D, et al. Phosphorylation-driven assembly of the RIP1-RIP3 complex regulates programmed necrosis and virus-induced inflammation[J]. Cell, 2009, 137(6):1112-1123.
[7]Liu YS, Huang ZW, Wang L, et al. Sitagliptin alleviated myocardial remodeling of the left ventricle and improved cardiac diastolic dysfunction in diabetic rats[J]. J Pharmacol Sci, 2015, 127(3):260-274.
[8]Kolesnikov SI, Vlasov BY, Kolesnikova LI. Hydrogen sulfide as a third essential gas molecule in living tissues[J]. Vestn Ross Akad Med Nauk, 2015(2):237-241.
[9]Xu W, Wu W, Chen J, et al. Exogenous hydrogen sulfide protects H9c2 cardiac cells against high glucose-induced injury by inhibiting the activities of the p38 MAPK and ERK1/2 pathways[J]. Int J Mol Med, 2013, 32(4):917-925.
[10]Zhuang XD, Hu X, Long M, et al. Exogenous hydrogen sulfide alleviates high glucose-induced cardiotoxicity via inhibition of leptin signaling in H9c2 cells[J]. Mol Cell Biochem, 2014, 391(1-2):147-155.
[11]梁伟杰,陈景福,张稳柱,等. ATP敏感性钾通道在硫化氢抑制高糖引起的心肌细胞损伤中的作用[J].中国病理生理杂志, 2015, 31(5):785-790.
[12]Xu W, Chen J, Lin J, et al. Exogenous H2S protects H9c2 cardiac cells against high glucose-induced injury and inflammation by inhibiting the activation of the NF-κB and IL-1β pathways[J]. Int J Mol Med, 2015, 35(1):177-186.
[13]Luedde M, Lutz M, Carter N, et al. RIP3, a kinase promoting necroptotic cell death, mediates adverse remodelling after myocardial infarction[J]. Cardiovasc Res, 2014, 103(2):206-216.
[14]Han W, Xie J, Li L, et al. Necrostatin-1 reverts shikonin-induced necroptosis to apoptosis[J]. Apoptosis, 2009, 14(5):674-686.
(责任编辑: 林白霜, 罗森)
Hydrogen sulfide protects H9c2 cardiomyocytes against high glucose-induced injury by inhibiting necroptosis
LIANG Wei-jie1,2, HE Jie-yi1,2, ZHANG Wen-zhu1,2, YU Sheng-long1,2, CHEN Jun1,2, SONG Ming-cai1,2, CHEN Jing-fu3, ZHENG Dong-dan3, LIAO Xin-xue4
(1DepartmentofCardiology,CentralHospitalofPanyuDistrict,2CardiovascularInstituteofPanyuDistrict,Guangzhou511400,China;3CardiacCareUnit,DepartmentofCardiology,HuangpuDivisionofTheFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510700,China;4DepartmentofCardiology,TheFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China.E-mail:liaoxinx@mail.sysu.edu.cn)
[ABSTRACT]AIM: To study whether hydrogen sulfide (H2S) protects H9c2 cardiomyocytes against high glucose (HG)-induced injury by inhibiting necroptosis. METHODS: The protein levels of RIP3 (an indicator of necroptosis) and cleaved caspase-3 were determined by Western blot. The cell viability was measured by CCK-8 assay. The intracellular le-vels of reactive oxygen species (ROS) were detected by 2’, 7’-dichlorfluorescein diacetate staining followed by photofluorography. Mitochondrial membrane potential (MMP) was examined by rhodamine 123 staining followed by photofluorography. The number of apoptotic cells was observed by Hoechst 33258 nuclear staining followed by photofluorography. RESULTS: After the H9c2 cells were treated with HG (35 mmol/L glucose) for 0~24 h, the protein expression of RIP3 in the H9c2 cells was significantly increased at 3 h, 6 h, 9 h, 12 h and 24 h, reaching the maximum level at 24 h. Pretreatment of the cells with 400 μmol/L NaHS (a donor of H2S) or co-treatment of the cells with necrostatin-1 (Nec-1; a speci-fic inhibitor of necroptosis) considerably blocked the up-regulation of RIP3 protein induced by HG. Moreover, pretreatment with NaHS or co-treatment with Nec-1 obviously inhibited HG-induced injuries, leading to an increase in the cell viability, and decreases in the generation of ROS and MMP loss. On the other hand, pretreatment with NaHS also reduced the number of apoptotic cells and the protein level of cleaved caspase-3 in the HG-treated H9c2 cardiomyocytes. CONCLUSION: H2S protects H9c2 cardiomyocytes against HG-induced injury by inhibiting necroptosis.
[KEY WORDS]Necroptosis; Hydrogen sulfide; High glucose; Cardiomyocytes
doi:10.3969/j.issn.1000- 4718.2016.03.001
[中图分类号]R363.2
[文献标志码]A
通讯作者△Tel: 020-87332628; E-mail: liaoxinx@mail.sysu.edu.cn
*[基金项目]国家自然科学基金资助项目(No. 81270296);广东省财政科技项目(No. 2014SC107)
[收稿日期]2015- 12- 24[修回日期] 2016- 01- 04
[文章编号]1000- 4718(2016)03- 0385- 07
杂志网址: http://www.cjpp.net
·论著·
