洋葱贮藏期青霉病病原菌的分离及鉴定
2016-04-14苏建红郭成张军高漆永红曹素芳李敏权
苏建红,郭成,张军高,漆永红,曹素芳,李敏权,
(1.甘肃农业大学草业学院,甘肃 兰州 730070; 2.甘肃省农业科学院植物保护研究所,甘肃 兰州 730070;
3.甘肃省农业科学院林果花卉研究所,甘肃 兰州 730070)
洋葱贮藏期青霉病病原菌的分离及鉴定
苏建红1,2,郭成2,张军高1,漆永红2,曹素芳3,李敏权1,2
(1.甘肃农业大学草业学院,甘肃 兰州730070; 2.甘肃省农业科学院植物保护研究所,甘肃 兰州730070;
3.甘肃省农业科学院林果花卉研究所,甘肃 兰州730070)
摘要:【目的】 明确甘肃洋葱贮藏期青霉病青霉菌的种类及其致病性.【方法】 采用常规组织分离法对甘肃省5个县区洋葱贮藏期青霉病病样进行病原物的分离、纯化培养,同时采用形态学和rDNA-ITS分子生物学方法进行鉴定.【结果】 共分离得到108株青霉菌菌株,分离频率为46.3%,其中青霉P1、P2、P3和P4的分离频率依次为30.5%、27.8%、22.2%和19.5%,P1为优势病原菌;结合形态学和rDNA-ITS分子生物学方法,鉴定出P1、P2、P3和P4分别为皮落青霉(Penicillium crustosum)、波兰青霉(Penicillium polonicum)、鲜绿青霉(Penicillium viridicatum)和光孢青霉(Penicillium glabrum).致病性测定结果表明,青霉菌P1、P2、P3和P4在有伤和无伤的条件下均能引起洋葱青霉病.【结论】 皮落青霉(P.crustosum)、波兰青霉(P.polonicum)、鲜绿青霉(P.viridicatum)和光孢青霉(P.glabrum)是洋葱贮藏期青霉病的病原菌.
关键词:洋葱;青霉病; 青霉菌种类;致病性
洋葱(Alliumcepa)又名圆葱、葱头等,为百合科葱蒜属,是具有保健功能的蔬菜之一[1].目前中国洋葱的种植面积位居世界第1位[2],甘肃省是西北洋葱的主要产区,2007年洋葱的种植面积达1.2万hm2,产量高达80万t左右,经济效益较为显著[3].
洋葱青霉病是洋葱储运期发生比较普遍且为害严重的病害之一,严重影响洋葱的商品价值,缩短其储藏期.青霉病菌在自然界适应性较强,分布极广,寄主范围也较广.不仅为害苹果和柑橘,还为害粮食、蔬菜等作物[4].由青霉菌引起的洋葱病害,在病部可产生青绿霉状物,并且散发出强烈的霉味.洋葱青霉病是洋葱贮藏期的主要病害之一,目前国内有关于洋葱贮藏期青霉病的相关报道较少[5].明确洋葱贮藏期青霉病病原菌的种类及其特性,对该病的防治以及洋葱储藏期的延长都具有重要指导意义.近年来,随着分子生物学的发展,在微生物的分类学中常引入分子手段,特别是rDNA基因簇区域被广泛地应用于真菌的分类鉴定系统中[6].常见青霉属病原菌有[7]:黑绿青霉(Penicilliumatramentosum)、短密青霉(P.brevicompactum)、皮落青霉(P.crustosum)、指状青霉(P.digitatum)、扩展青霉(P.expansum)、芬尼青霉(P.fennelliae)、光孢青霉(P.glabrum)、意大利青霉(P.italicum)、波兰青霉(P.polonicum)、鲜绿青霉(P.viridicatum)等.
本文对甘肃省不同产地洋葱贮藏过程中引起采后腐烂的青霉菌进行分离与纯化,筛选引起致病的青霉菌,测定其致病性,对分离到的青霉菌株进行鉴定,希望能为该病害的综合防治提供理论依据.
1材料与方法
1.1标本采集
2013年分别于甘肃省嘉峪关市、天水市、酒泉市、平凉市、兰州市采集洋葱青霉病样品,装入干净的塑料袋中,带回实验室.
1.2病原菌分离
病组织经75%的酒精消毒后,取鳞茎病健交界处的组织进行分离和纯化[8].将菌种上所产生的孢子用灭菌水洗下,适当的稀释后(每皿中约含有30~50个孢子),取1 mL的孢子悬浮液与已溶化的冷却至45 ℃左右的PDA培养基充分混匀后,倒在灭菌培养皿中,置于25 ℃下培养.48 h后用打孔器将形成的单个分散的菌落切下,移到PDA培养基上,25 ℃下培养2~3 d,即形成小菌落[9].分别统计各菌株的分离频率,编号后转管于PDA斜面培养基,待鉴定.
1.3致病性测定
1.3.1孢子悬浮液的配制将培养7 d的菌落用含0.05% Tween20的无菌水冲洗到三角瓶中,用3层纱布过滤,配制成孢子悬浮液.将孢子悬浮液的体积浓度调整为1.0×106个/mL.
1.3.2室内接种挑选采集地常用品种‘红太阳’的洋葱鳞茎,用75%的乙醇表面消毒,再用无菌水清洗干净后晾干,进行有伤接种和无伤接种.有伤接种:采用针刺法造伤后,再用喷雾法将孢子悬浮液接种到伤口处.无伤接种:将健康的鳞茎与接菌的培养皿密封同放在一个干燥器内进行培养.置25 ℃培养箱中,逐日观察鳞茎发病症状,并对发病鳞茎进行病原菌的再分离和纯化.观察菌落形态及孢子是否与所接病的原菌相同[10],确定致病菌.
1.4病原菌鉴定
1.4.1形态学鉴定将分离到的青霉菌株分别接种到CYA、CA、G25N和WA培养基上,参考相关文献[10]进行形态学鉴定.显微镜下分别观察分生孢子梗及分生孢子等特征,并记录拍照.根据病原菌的形态特征,进行病原菌种的鉴定.
Czapek浓缩液:NaNO330 g,KCl 5 g,MgSO4·7H2O 5 g,FeSO4·7H2O 5 g,H2O 100 mL;CYA培养基[4]:K2HPO41 g,Czapek浓缩液10 mL,酵母膏5 g,蔗糖30 g,琼脂20 g,H2O 1 000 mL;CA培养基[11]:NaNO33 g,K2HPO41 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,葡萄糖20 g,琼脂20 g,H2O 1 000 mL;G25N培养基:K2HPO40.75 g,Czapek浓缩液7.5 mL,酵母膏3.7 g,甘油250 g,琼脂15 g,H2O 750 mL;WA培养基:琼脂15 g,未经发酵的啤酒麦芽汁1 000 mL.
1.4.2rDNA-ITS序列分析
1.4.2.1病原菌的培养及基因组DNA提取在形态学特征鉴定的基础上,将分离获得的菌株,采用CTAB法提取DNA.分别将青霉菌菌饼在PDB(PDA不含琼脂)培养液培养48~72 h,离心后用滤纸过滤回收菌丝体.基因组DNA的提取与纯化根据修改后Paul法[12]进行,使用真菌的通用引物ITS1:5′-TCCGTAGGTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTTATTGATATGC-3′(由上海生工合成).以25 μL体系进行PCR扩增[13],扩增后的产物送上海生工公司测序,将测序结果与GenBank中核酸数据库中的ITS区相关序列进行同源性比较,明确其系统发育地位.
1.4.2.2序列分析及同源性比较将待测菌株的基因序列与GenBank核苷酸数据库中的基因序列进行同源性比较,下载同源性最高的序列,并用ClustalX (1.8)软件进行多重序列比较后,再用Mega(4.0)软件采用邻近法构建系统发育树.
2结果与分析
2.1病原菌的分离结果
从30个青霉病样品中共分离得到233株真菌,其中108株青霉菌菌株,分离频率为46.3%;87株镰刀菌菌株,分离频率为37.2%;21株灰霉菌株,分离频率为8.9%;2株木霉菌菌株,分离频率为0.8%;黄曲霉4株,分离频率为1.7%;根霉12株,分离频率为5.1%.本文除青霉属外,其他分离物只做属的鉴定.通过形态学观察[14-16],发现有4种青霉,编号为P1、P2、P3和P4,分别为皮落青霉、波兰青霉、鲜绿青霉和光孢青霉,分离频率依次为30.5%、27.8%、22.2%和19.5%,其中皮落青霉为洋葱储藏期青霉病的优势菌株.
2.2致病性测定结果
接种15 d后,在伤口接种条件下,4种青霉菌P1、P2、P3、P4均能引起发病,发病率为100%.在无伤口接种下,鳞茎的最外层表皮也会出现大量的青霉病斑,但内层的鳞片健康.
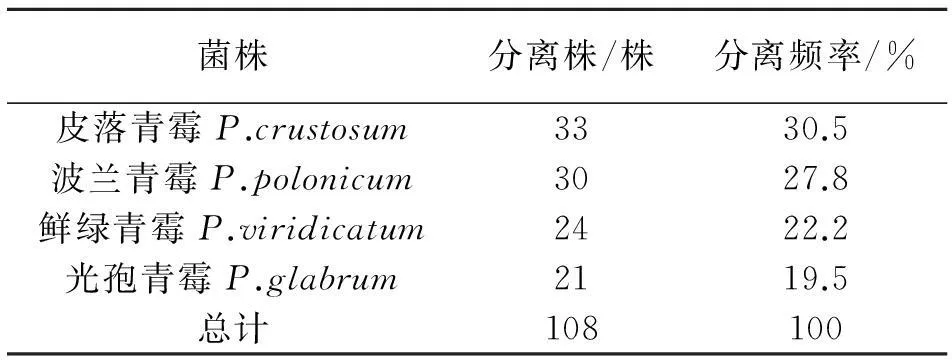
表1 洋葱鳞茎上四种青霉菌菌株分离频率
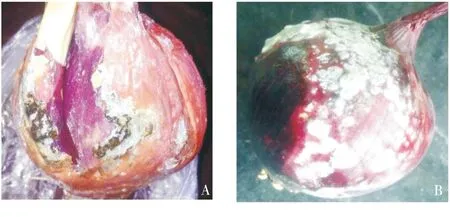
A:有伤接种;B:无伤接种.图1 致病性测定Fig.1 Pathogenicity test
2.3病原菌鉴定结果
2.3.1形态学鉴定结果皮落青霉(Penicilliumcrustosum):菌落在CYA培养基上,25 ℃培养7 d,平均菌落直径35 mm,具少量的放射状皱纹,质地绒状,正面呈绿色,菌丝体白色,反面呈黄褐色.菌落在CA上,25 ℃培养12 d,平均菌落直径44 mm,有放射状的皱纹,质地绒状,正面呈绿色,菌丝体白色,反面呈黄色.菌落在G25N上,25 ℃培养7 d,平均菌落直径17 mm,平坦质地绒状,正面呈蓝绿色,反面呈黄色.菌落在WA上,25 ℃培养7 d,平均菌落直径33 mm,正面呈黄绿色,有放射状皱纹,反面呈黄褐色.镜检观察分生孢子梗直立,顶端1至多次分枝呈扫帚状,分枝上产生3轮不对称的瓶状小梗.其顶端念珠状着生分生孢子,球形.孢子直径2~3 μm.

图2 P1病原菌在PDA培养基上的形态学特征和分生孢子梗(×400 )Fig.2 P1 morphological characteristic on PDA medium and it conidiophore(×400)
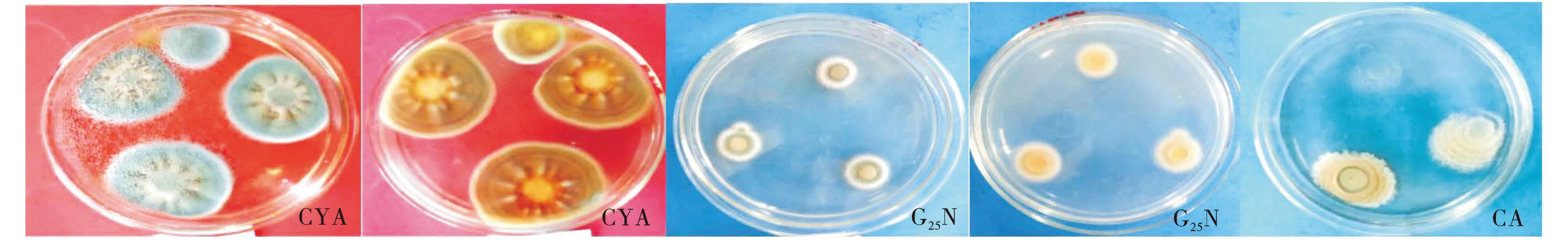
图3 P1病原菌在CYA、G25N和CA培养基上的形态学特征Fig.3 P1 morphological characteristic on CYA、G25N and CA medium
波兰青霉(P.polonicum):菌落在CYA培养基上,25 ℃培养7 d,平均菌落直径50 mm,平坦,有放射状的皱纹;质地绒状,正面呈暗绿色,菌丝体白色,反面呈淡黄色.菌落在CA培养基上,25 ℃培养12 d,平均菌落直径41 mm,菌丝体白色,放射状皱纹,正面呈蓝绿色,反面呈黄褐色.菌落在G25N培养基上,25 ℃培养7 d,平均菌落直径11 mm,中心有脐状的突起,质地绒状,正面呈翡翠绿色,反面略带绿褐色.菌落在WA上,25 ℃培养7 d,平均菌落直径48 mm,平坦,有放射状的皱纹,质地绒状,正面呈绿色,反面呈微褐色.镜检观察分生孢子梗无色.先端具1~3个分枝,扫帚状,小梗顶端渐趋尖细;分生孢子呈念珠状串生,单孢无色,近球形,大小(3.1~4.0) μm×(3.25~4.5)μm.

图4 P2病原菌在PDA和G25N培养基上的形态学特征和分生孢子梗(×400 )Fig.4 P2 morphological characteristic on G25N and PDA medium and its conidiophore(×400)
鲜绿青霉(P.viridicatum):菌落在CYA培养基上,25 ℃培养7 d,平均菌落直径34 mm,正面质地绒状,菌丝体白色,反面呈红褐色.菌落在CA培养基上,25 ℃培养12 d,平均菌落直径30 mm,中心突起,质地绒状,正面呈蓝绿色,菌丝体白色,有放射状的皱纹.菌落在WA培养基上,25 ℃培养7 d,平均菌落直径38 mm,菌落反面红黄色.菌落在G25N培养基上,25 ℃培养7 d,平均菌落直径17 mm,较厚,有放射状的皱纹,正面呈蓝绿色,绒状;反面呈浅黄色.分生孢子梗单枝,较长,无足细胞;孢子梗顶端膨大,成帚状,对称,生分生孢子串;单个分生孢子为球形或椭圆形,蓝色.
光孢青霉(P.glabrum):菌落在CYA培养基上,25 ℃培养7 d,平均菌落直径45 mm,质地绒状,分生孢子面青色,菌丝体白色,反面呈微黄色.菌落在CA培养基上,25 ℃培养12 d,平均菌落直径34 mm,平坦,质地绒状,正面呈青色,菌丝体白色,反面呈微黄色.菌落在 G25N培养基上,25 ℃培养7 d,平均菌落直径16 mm,平坦质地绒状,正面呈青绿色,反面呈黄色.菌落在WA培养基上,25 ℃培养7 d,平均菌落直径44 mm,正面呈青绿色,平坦,反面呈暗黄色.分生孢子梗单枝,孢子梗顶端膨大,成帚状,较长.分生孢子大量产生,分生孢子面灰绿色,菌丝体白色.

图5 P3病原菌在PDA培养基上的形态学特征和分生孢子梗(×400 )Fig.5 P3 morphological characteristic on G25N and PDA medium and its conidiophore(×400)
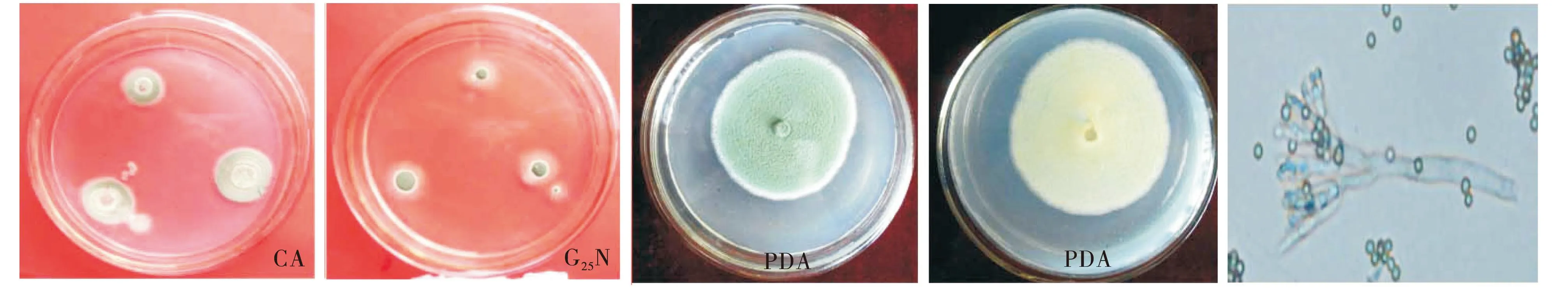
图6 P4病原菌在CA、G25N和PDA培养基上的形态学特征和分生孢子梗(×400 )Fig.6 P4 morphological characteristic on G25N、CA and PDA medium and its conidiophore(×400)
2.3.2rDNA-ITS序列分析利用引物ITS1和ITS4进行PCR扩增,在500 bp附近有一条明显的扩增条带(图7).将扩增产物送上海生工测序,所得ITS-rDNA序列分别为549、546、544、535 bp.用ClustalX (1.8)软件进行多重序列比较,再用Mega(4.0)软件采用邻接法构建系统发育树.P1与GenBank中登记的登录号为JN226946、JN226973的皮落青霉聚为一支;P2与登录号为JF731260、JF731253、JF731267的波兰青霉聚为一支;P3与登录号为FJ623267、KC009832、AY373937的鲜绿青霉聚为一支;P4与登录号为JN088239、HM776431、KF313078的光孢青霉聚为一支,即其亲缘关系最近,同源性达到99%(图8).结合形态学特征,进一步证明P1为皮落青霉菌,P2为波兰青霉菌,P3为鲜绿青霉菌,P4为光孢青霉菌.
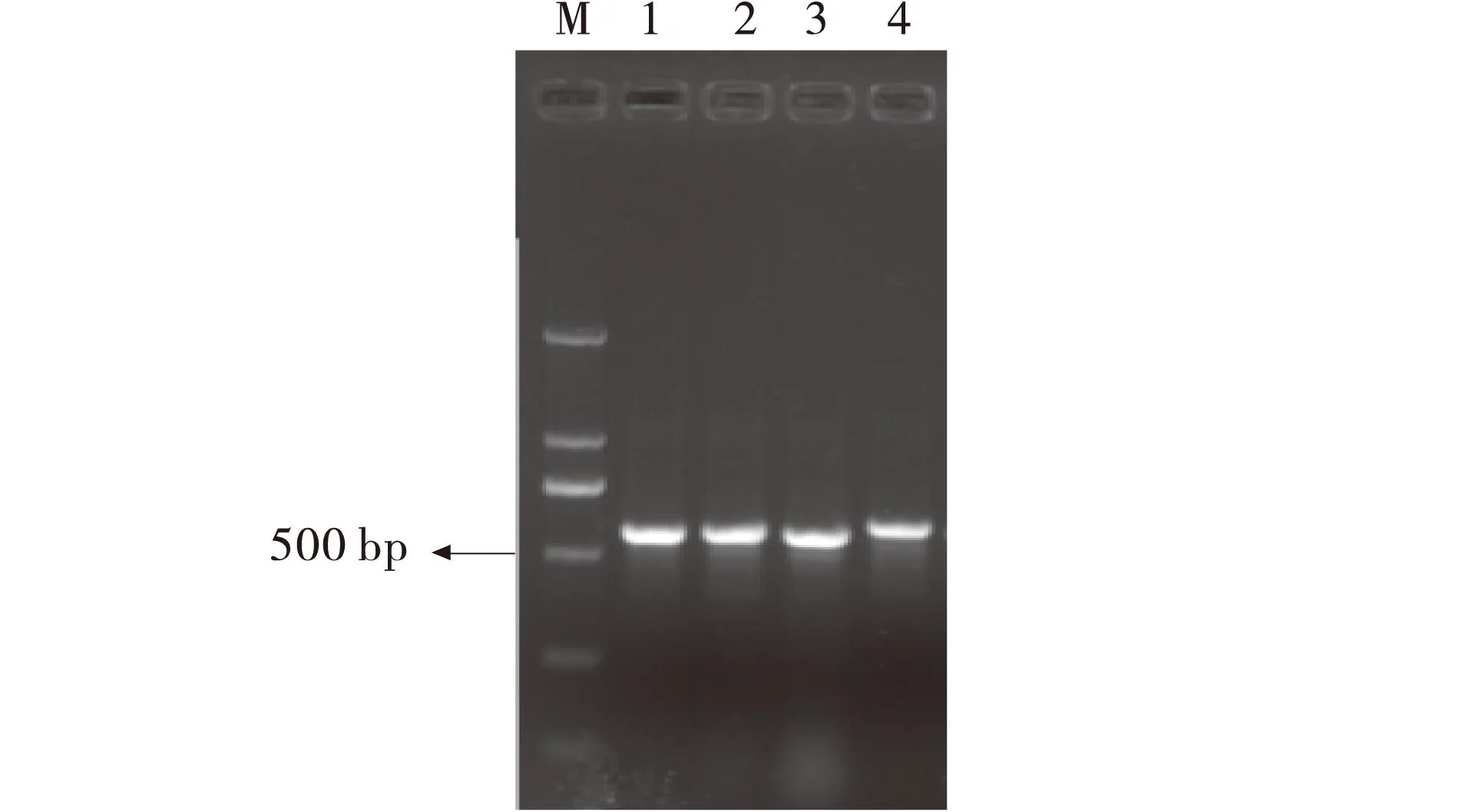
图7 TS-rDNA序列的扩增Fig.7 PCR product of ITS

图8 青霉菌属的系统发育树Fig.8 The phylogenetic tree of Penicillium sp.
3讨论
本试验采用组织分离法对甘肃省5个地区的洋
葱贮藏期青霉病病原菌进行了分离,共得到108株青霉菌菌株,分离频率为46.3%,其中皮落青霉(P.crustosum)、波兰青霉(P.polonicum)、鲜绿青霉(P.viridicatum)和光孢青霉(P.glabrum)分离频率分别为30.5%、27.8%、22.2%和19.5%.这4种青霉菌均可引起作物贮藏期的青霉病害,皮落青霉是引起柑橘和长枣采后贮藏期病害的病原菌之一[6,17],波兰青霉是引起柑橘采后青霉病的病原之一[6],鲜绿青霉为玉米、高粱和伽师瓜采后青霉病的主要病原菌[18-20],光孢青霉是引起藏茶贮藏期病害的病原菌[21].Duduk等[22]研究发现波兰青霉菌是洋葱贮藏期青霉病的主要病原菌,而本试验发现引起甘肃省洋葱贮藏期青霉病的病原菌优势种为皮落青霉,其次为波兰青霉.引起优势种差异的原因可能是由于洋葱品种以及地域、温度和湿度等自然条件所造成.
在致病性测定中,皮落青霉、波兰青霉、鲜绿青霉和光孢青霉在有伤和无伤的条件下均能引起洋葱的发病,说明青霉菌可通过伤口进行侵染发病,分生孢子也可随气流传播,落在洋葱表皮上,引起洋葱鳞茎的感染,从而发病导致洋葱品质的下降.
关于洋葱的采后病害研究较多,很多学者分别从黑曲霉、镰刀菌等角度入手[5].但有关洋葱贮藏期的青霉病害国内研究报道较少.由于青霉属的种及相似种在菌落形状和颜色上差别不大,因此给其鉴定带来一定的困难[23].传统方法上,可以通过孢子大小、形状、分生孢子梗的形态和菌落形态等进行鉴定,但是这些标准由于受到实验经验、个人因素和外界的影响,且自身易变、易重叠,不好严格界定[24,25].随着分子生物学技术的发展,rDNA基因区域被广泛运用在果蔬类采后致病真菌的分离和鉴定上[26-27].rDNA-ITS是介于18S rDNA、5.8S rDNA和28S rDNA之间的间隔序列,在不同真菌种类之间变化较多,但在同一种真菌中非常保守[28].所以,ITS基因序列可以被广泛运用在真菌分离,系统发育分析和鉴定中.因此,本研究以形态学鉴定为基础,基因序列分析为辅助鉴别手段,有效提高了病原菌鉴定结果的准确性.
参考文献
[1]徐冬,李敏权,张彦梅.嘉峪关市新城镇洋葱干腐病病原鉴定及致病性测定[J].甘肃农业大学学报,2011,45(6):110-113
[2]梁毅,王永勤,于春霞,等.中国洋葱产业的回顾与展望[J].中国农学通报,2009,25(24):308-312
[3]赵强,常国军,韩文韬,等.酒泉市洋葱优良品种推介[J].中国蔬菜,2007(3):58-59
[4]江彦军,孙明清,曹克强.河北省红富士苹果青霉病病菌种类鉴定[J].中国植保导刊,2013(1):15-17
[5]张一卉.不同洋葱品种贮藏后品质变化研究及一种贮藏病害的鉴定[D].泰安:山东农业大学,2011
[6]闵晓芳,邓伯勋,陈丽锋,等.柑橘采后致病青霉的鉴定[J].果树学报,2007,24(5):653-656
[7]Cruickshank R H,Pitt J I.Identification of species inPenicilliumsubgenusPenicilliumby enzyme electrophoresis[J].Mycologia,1987,79(4):614-620
[8]江彦军,孙明清,曹克强.河北省红富士苹果青霉病病菌种类鉴定[J].中国植保导刊,2013(1):15-17
[9]江彦军.河北省储藏期苹果青霉病的病原种类鉴定与防治[D].石家庄:河北农业大学,2005
[10]孔华忠.中国真菌志(第35卷):青霉属及其相关有性型属[M].北京:科学出版社,2007
[11]高云超,李秀珍,孙霞,等.磨盘柿天然发酵制醋的真菌区系鉴定和毒素分析[J].生态科学,2000(4):39-43
[12]Paul B.Pythiumornacarpum:a new species with ornamented oogonia isolated from soil in France[J].FEMS Microbiology Letters,1999,180(2):337-344
[13]杨秀梅,王继华,王丽花,等.百合枯萎病病原鉴定与ITS序列分析[J].西南农业学报,2010,23(6):1914-1916
[14]方中达.植病研究法[M].北京:中国农业出版社,1998
[15]陆家云.病原植物真菌学[M].北京:中国农业出版社,2001
[16]戴芳澜.真菌的形态和分类[M].北京:科学出版社,1987
[17]任玉锋,马爱瑛,刘雅琴,等.灵武长枣采后主要病原真菌的鉴定[J].食品研究与开发,2012,33(9):128-130
[18]魏建华.玉米中真菌的分离和鉴定[J].中兽医医药杂志,2001(6):16-17
[19]臧家仁,尹照俊.牙克石地区雏鸭霉高粱中毒的病因研究[J].兽医大学学报,1992,12(4):324-327
[20]张有林,张润光,孙刚,等.伽师瓜采后生理,贮期病害及贮藏保鲜技术[J].中国农业科学,2010,43(6):1220-1228
[21]钟涛,齐桂年,胥伟,等.藏茶贮存过程中真菌种群的鉴定[J].贵州农业科学,2010 (10):101-103
[22]Duduk N,Vasic M,Vico I.First report ofPenicilliumpolonicumcausing blue mold on stored onion (Alliumcepa) in Serbia[J].Plant Disease,2014,98(10):1440-1440
[23]杨秀娟,陈福如,阮宏椿.柑橘储藏期青霉病和绿霉病防治药物筛选[J].果树学报,2005(1):38-40
[24]Zhang H Y,Wang L,Zheng X D,et al.Effect of yeast antagonist in combination with heat treatment on postharvest blue mold decay and Rhizopus decay of peaches[J].International Journal of Food Microbiology,2007,115:53-58
[25]Zhang J H,Zhao L,Zhang J,et al.Optimised expression and spectral analysis of the target enzyme CYP51 from penicillium digitatum with possible new DMI fungicides[J].Pest Mangment Sci,2010,66:1344-1350
[26]Yu T,Li H Y,Zheng X D,et al.Synergistic effect of chitosan and cryptococcus laurentii on inhibition of penicillium expansum infections[J].International Journal of Food Microbiology,2007,114:261-266
[27]许玲,张晟瑜,王奕文,等.灰霉病(Botrytiscinerea)采后致病性研究[J].植物病理学报,2006,36(1):74-79
[28]Thompson J D,Clustal W.Improving the sensitivity of progressive multiple sequence alignment through sequence weighting,position-specific gap penalties and weight matrixchoice[J].Nucleic Acids Research,1994,22:4673-4680
(责任编辑胡文忠)
Isolation and identification ofPenicilliumspecies during storage of onions
SU Jian-hong1,2,GUO Cheng2,ZHANG Jun-gao1,QI Yong-hong2,CAO Su-fang3,LI Min-quan1,2
(1.College of Pratacultural Science,Gansu Agricultural University,Lanzhou 730070,China;2.Institute of Plant Protection,Gansu Academy of Agricultural Sciences,Lanzhou 730070,China;3.Institute of Fruit and Floriculture,Gansu Academy of Agricultural Sciences,Lanzhou 730070,China)
Abstract:【Objective】 In order to know Penicillium species and its pathogenicity during storage of onions in Gansu province.【Method】 Pathogens were isolated and cultivated purely by conventional tissue isolation method from 108 samples collected from 5 counties in Gansu.【Result】 The strains isolation frequency reached 46.3%,among which Penicillium P1,P2,P3 and P4 was 30.5%,27.8%,22.2% and 19.5%,respectively.P1 was the dominant pathogen of all strains.Using morphological and rDNA-ITS molecular biology method,P1,P2,P3 and P4 were identified as Penicillium crustosum,P.polonicum,P.viridicatum and P.glabrum,respectively.The pathogenicity test showed that strains P1,P2,P3 and P4 all caused Penicillium disease symptoms on the condition of wound or no wound.【Conclusion】 P.crustosum,P.polonicum,P.viridicatum and P.glabrum are the pathogens during storage of onions.
Key words:onion;Penicillium disease;Penicillium pathogen species;pathogens pathogenicity
通信作者:李敏权,男,博士,博导,研究员,主要从事农作物病害研究.E-mail:lmq@gsau.edu.cn
基金项目:甘肃省嘉峪关市科技计划项目(12-51,036-036034);甘肃省农业科学院创新专项(2014GAAS23);国家自然科学基金项目(31000845).
收稿日期:2015-02-23;修回日期:2015-03-25
中图分类号:S 432.1
文献标志码:A
文章编号:1003-4315(2016)01-0095-07
第一作者:苏建红(1987-),男,硕士研究生,主要从事植物病害研究.E-mail:304846831@qq.com
