赭曲霉毒素A诱导Caco-2细胞的细胞毒性及DNA损伤
2016-04-14张捷李发弟李爱军郑楠李松励王加启
张捷,李发弟,李爱军,郑楠,李松励,王加启
(1.甘肃农业大学动物科学技术学院,甘肃 兰州 730070;2.唐山市畜牧水产品质量监测中心,河北 唐山 063000;
3.中国农业科学院北京畜牧兽医研究所,农业部奶产品质量安全风险评估实验室(北京),北京 100193;
4.中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室,北京 100193)
赭曲霉毒素A诱导Caco-2细胞的细胞毒性及DNA损伤
张捷1,3,4,李发弟1,李爱军2,郑楠3,4,李松励3,4,王加启1,3,4
(1.甘肃农业大学动物科学技术学院,甘肃 兰州730070;2.唐山市畜牧水产品质量监测中心,河北 唐山063000;
3.中国农业科学院北京畜牧兽医研究所,农业部奶产品质量安全风险评估实验室(北京),北京100193;
4.中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室,北京100193)
摘要:【目的】 研究不同浓度和时间处理下,赭曲霉毒素A(OTA)对人结肠癌细胞(Caco-2)的细胞生长抑制、氧化损伤以及DNA损伤的影响.【方法】 采用0.32、1.6、8、40、200 μmol/L OTA处理Caco-2细胞24、48、72 h后,利用甲基偶氮唑盐(MTT)法检测细胞存活率,利用活性氧(ROS)试剂盒检测细胞内的自由基水平,利用彗星试验检测细胞的DNA损伤.【结果】 在各个处理时间段内,OTA浓度大于0.32 μmol/L时,OTA对细胞存活率都有显著的抑制作用(P<0.05);细胞内ROS以及DNA损伤都随OTA浓度的增加而显著升高(P<0.05),尤其在0~8 μmol/L低浓度范围内,OTA显示了强烈的毒性.【结论】 OTA可导致Caco-2细胞存活率降低,引起细胞氧化应激以及DNA损伤,其中ROS水平升高可能是OTA导致Caco-2细胞DNA损伤的原因.
关键词:赭曲霉毒素A;MTT;ROS;彗星试验;DNA损伤
赭曲霉毒素A (OTA)主要是由纯绿青霉,赭曲霉和炭黑曲霉产生的真菌毒素,广泛存在于自然界,能污染多种植物产品和食品,如玉米、大豆、可可、中草药等,对人类的健康造成了重大威胁,引起了人们的广泛关注.OTA的危害性被认为是仅次于黄曲霉毒素,被国际癌症研究机构(IARC)列为2B类致癌物[1].
目前研究发现OTA具有肾毒性、肝毒性、致畸性、致突变、致癌性、神经毒性、免疫毒性等生物学效应.有研究表明OTA可以抑制猪肾小管上皮细胞的生长[2],诱导肝细胞膜增厚、溶解[3],可通过怀孕小鼠的胎盘到达致命器官并能与DNA形成加和物[4],损伤海马神经元细胞[5],诱导细胞基因突变[6]和诱导肾小管细胞腺瘤的产生从而导致肾小管细胞腺癌[7],抑制体外培养的T和B淋巴细胞增殖,并可以减少IL-2和IL-2受体的产生[8].肠道作为身体接触外来物质的第一道屏障,但是关于OTA在肠道及肠道细胞的研究却鲜有报道.本试验用一定浓度的OTA处理人结肠癌细胞(Caco-2),用MTT法,活性氧检测法和彗星试验法研究OTA对Caco-2细胞的细胞毒性及DNA损伤,旨在丰富OTA对人肠道细胞DNA损伤作用的数据并为食品质量安全分析评估提供参考.
1材料与方法
1.1材料和试剂
Caco-2(human colon adenocarcinoma)细胞株:美国ATCC公司;DMEM(dulbecco′s modified eagle medium)培养基,胎牛血清(fetal bovine serum,FBS):美国Gibco公司;四甲基偶氮唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT],二甲基亚砜(DMSO),碘化丙啶(PI):美国Sigma公司;ROS测定试剂盒:南京建成生物工程研究所;PBS磷酸盐缓冲溶液,胰蛋白酶液,青霉素链霉素混合液:碧云天生物技术研究所;OTA标准品:美国Fermentek公司;非必需氨基酸(nonessential amino acid,NEAA),汉克平衡盐溶液(hank′s balanced salt solution,HBSS):迈晨科技(北京)科技有限公司;低熔点琼脂糖,琼脂糖:美国Amresco公司.其余试剂:国产分析纯.毒素母液配制:将5 mg OTA,溶解于1 mL甲醇中,配成浓度为5 mg/mL的母液,-20 ℃冷冻储存.
1.2试验方法
1.2.1细胞培养Caco-2细胞在含有10%胎牛血清、10%NEAA、100 U/L青霉素、100 μg/mL链霉素的DMEM培养液中,于37 ℃、5% CO2、饱和湿度环境下常规培养.当细胞生长至80%~90%融合时,用胰蛋白酶溶液消化细胞.
1.2.2细胞活力的测定活细胞线粒体中的琥珀酸脱氢酶能与MTT反应形成不溶于水的紫色结晶物甲瓒,用MTT法通过测定甲瓒的吸光度来来测定细胞活力[9].取96孔培养板,每孔加入100 μL细胞悬液,Caco-2细胞浓度为6×103个/孔,37 ℃培养24 h后弃去培养液,处理组加入含有不同浓度(0.32、1.6、8、40、200 μmol)OTA的无血清处理液,对照组加入100 μL只含有相应甲醇浓度的DMEM无血清培养基,培养24 h后除去培养液,加入0.5 mg/mL MTT-DMEM孵育4 h,吸除培养基后,加入100 μL DMSO摇晃5 min,以完全溶解出MTT紫色结晶产物.用酶标仪(Thermo,美国)在570 nm处(以630 nm为参考波长)测定吸光度值.试验重复3次,每组有5个重复.

1.2.3细胞内ROS含量的测定细胞内ROS水平由荧光探针(2′,7′-二氯荧光黄双乙酸盐)DCFH-DA 来测定.DCFH-DA 穿过细胞膜,酶促后水解形成非荧光的二氯荧光黄.后者在ROS存在下,被迅速的氧化形成高荧光性的二氯荧光黄(DCF)[10].DCF的荧光强度显示出ROS的含量.取96孔黑板,每孔加入100 μL细胞悬液,Caco-2 细胞浓度为1×104个/孔.24 h后,分别加入0.32、1.6、8、40、200 μmol/L的OTA以及100 mmol/L H2O2阳性对照.37 ℃培养24 h,去除培养基后,加入含100 mmol/L DCFH-DA的HBSS于37 ℃孵育40 min,每个浓度6个平行.用酶标仪,在激发波长485 nm以及发射波长530 nm时测定ROS.试验重复3次,每组有5个重复.ROS水平(%)用处理组细胞和对照组细胞吸光值的比值来确定.
1.2.4彗星试验碱性彗星试验法学参考Corcuera等[11]的方法.DNA损伤的程度由以下3个参数来定量:尾部DNA百分含量:彗星尾部DNA的总荧光强度;尾长:彗星头部的中心到尾部末端的水平距离;尾距:彗星头部中心到尾部中心的距离与尾部DNA百分含量的乘积.用不同浓度(0.32、1.6、8、40、200 μmol/L)的OTA处理细胞24 h,100 μmol/L H2O2作为阳性对照.处理结束后,细胞用冷PBS清洗后用胰酶消化,然后细胞重悬于完全培养基.70 μL细胞悬液(3×105个/mL)与0.75%低熔点琼脂糖混合后,立刻涂到含有1%常熔点琼脂糖的玻璃片上.玻璃片放到4 ℃环境5 min.将玻璃片放到4 ℃细胞裂解液(2.5 mol/L NaCl,10 mmol/L Tris,100 mmol/L EDTA,1% Triton X-100 and 10% DMSO,pH 10.0)中1.5 h来消除细胞蛋白.细胞裂解后,将玻璃片平放到4 ℃电泳液(300 mmol/L NaOH和1 mmol/L EDTA,pH>13)中,20 min后直到DNA解旋并且露出碱不稳定点,之后在25 V,300 mA电泳20 min.用中和液(0.4 mol/L Tris,pH 7.5)中和.最后用碘化丙啶(10 μg/mL)染色并且用荧光显微镜拍照.每张玻璃片上随机选择50个细胞照相,照片用casp软件(http://casp.sourceforge.net)分析.试验重复3次.
1.3 数据处理

2结果与分析
2.1OTA对Caco-2细胞毒性作用
用MTT法评估各种浓度的OTA处理Caco-2细胞24、48、72 h后,Caco-2细胞的存活率.由图1所示,与对照组相比,OTA浓度为8 μmol/L时,细胞活性下降较明显(P<0.05),24、48、72 h处理,细胞活性分别降低了36%、46%、60%.与OTA浓度为8 μmol/L时相比,OTA在200 μmol/L时,降低幅度分别为17%、14%、14%.由此可知, 较低浓度的OTA,已经发挥急性毒性作用.

图1 由OTA诱导的Caco-2细胞的细胞毒性Fig.1 Cytotoxicity effects of OTA of exposure on Caco-2 cell
2.2OTA对Caco-2细胞ROS的影响
本试验中,阳性对照H2O2导致ROS水平升高极显著(P<0.01),如图2所示.此外,OTA诱导的Caco-2细胞内ROS水平呈浓度依赖性增加.处理24 h后,当OTA浓度为8~40 μmol/L时,处理组ROS水平显著高于对照组(P<0.05);当OTA浓度为200 μmol/L时,处理组ROS水平极显著高于对照组(P<0.01).在48、72 h处理组中,当OTA浓度为1.6 μmol/L时,处理组的ROS水平极显著高于对照组(P<0.01).处理72 h后,当OTA浓度大于等于40 μmol/L时,ROS水平都高于阳性对照组,当OTA浓度为200 μmol/L时,ROS水平显著高于阳性对照组,是阳性对照组的1.28倍(P<0.05),阴性对照组的2.23倍(P<0.05).
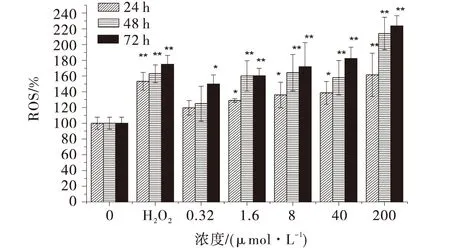
图1 OTA诱导对Caco-2细胞产生ROS的影响Fig.1 Effects of OTA on generationin in Caco-2 cell
2.3彗星试验结果
用彗星试验来评估不同浓度的OTA对Caco-2细胞的DNA损伤程度.每组代表性受损Caco-2细胞的显微照片如图3中所示.
由表1所示,各浓度OTA对Caco-2细胞DNA都存在一定的损伤.OTA和过氧化氢诱导的DNA损伤呈时间和剂量依赖性.当OTA浓度大于1.6 μmol/L时,尾部DNA百分含量在各个处理的时间点都显著高于对照组(P<0.05).DNA尾距在72 h内,OTA所有浓度处理组显著高于对照组(P<0.05).阳性对照过氧化氢(100 μmol/L)在各个时间点都能显著诱导DNA损伤(P<0.05),当OTA浓度为200 μmol/L时,对DNA损伤显著高于阳性对照组(P<0.05),在48 h和72 h时,OTA对DNA的损伤与阳性对照组相比差异不显著(P>0.05).

A:对照组;B:0.32 μmol/L OTA;C:1.6 μmol/L OTA;D:8 μmol/L OTA;E:40 μmol/L OTA;F:200 μmol/L OTA;H:100 μmol/L H2O2.图3 由OTA处理24 h后的Caco-2细胞DNA损伤的彗星图片(×200)Fig.3 Comet images of OTA induced DNA damage in Caco-2 cells

浓度/(μmol·L-1)尾部DNA含量/%24h48h72h尾长/(μmol·L-1)24h48h72h尾距24h48h72hODA处理00.10±0.02a0.14±0.03a0.20±0.04a3.16±0.50a3.59±0.62a4.29±0.85a0.24±0.04a0.31±0.03a0.42±0.03a0.320.15±0.02a0.17±0.01a0.24±0.04a3.12±0.49a3.53±0.51a4.82±0.73b0.36±0.03b0.44±0.03b0.52±0.07b1.61.4±0.29b1.59±0.16b1.90±0.38b4.65±0.79b5.06±0.75b5.24±0.83b0.40±0.05c0.50±0.06c0.62±0.08c82.33±0.28c2.53±0.24c2.96±0.30c6.18±0.81c6.76±0.44c7.06±0.83c0.74±0.09d0.91±0.06d1.10±0.08d402.56±0.50c2.69±0.31d3.40±0.45d7.00±0.87d7.59±0.63d8.12±0.60d0.81±0.07e1.05±0.16e1.22±0.06e2003.45±0.68d3.58±0.28e4.23±0.32e8.12±0.78e8.82±0.64e10.12±0.86e0.96±0.03f1.19±0.15f1.31±0.05fH2O21003.12±0.34e3.20±0.42f3.80±0.35f7.94±0.94e8.53±0.62e8.94±0.66f0.90±0.07g1.12±0.11f1.29±0.07f
同列数据肩标不同小写字母表示差异显著(P<0.05).
3讨论
OTA是由真菌产生的次级毒性代谢产物,广泛存在于各种食品和饲料中,对人畜具有很强的毒性.有研究表明OTA对肝、肾、免疫系统、神经系统等都具有潜在的毒性[8],Heussner等[2],牛钟相等[12]和Arbillaga等[13]研究发现OTA可以对鸡和猪的肠细胞,肾细胞等造成DNA损伤[2,12-13].然而,OTA对于人肠道作用的生物学数据较少,尤其是OTA对于人肠道细胞DNA的损伤作用,更是鲜有报道.本试验分别从细胞毒性和DNA损伤两个方面研究了OTA对人肠道细胞的危害.
3.1OTA对人Caco-2细胞的细胞毒性
动物机体受到外源性毒素攻击时,体内的自由基会增多,致使细胞受损或细胞死亡.本试验中,OTA能够显著降低(P<0.05)Caco-2细胞活力,并且对Caco-2细胞的活力影响呈时间和剂量依赖性,Saadatmandi等[14]研究发现OTA对猪肾细胞(LLC-PK1)活力影响呈剂量依赖性,Ali等[15]研究发现OTA对仓鼠卵巢细胞(CHO)和人类淋巴母细胞(TK-6)活力影响均呈剂量依赖性,与本试验研究结果相一致.细胞试验中,OTA在24、48、72 h的IC50值分别在>40 μmol/L,30 μmol/L和5 μmol/L左右,Arbillaga等[13]在人肾小管小皮细胞(HK-2)研究发现,OTA处理HK-2细胞6 h,IC50值大于600 μmol/L和韩薇等[16]对叙利亚仓鼠肾细胞(BHK)研究发现,OTA处理BHK细胞24 h,IC50值为5 μg/mL左右,与本试验结果稍有差别,可能是由于细胞以及处理时间的不同导致了结果的差异.
陈平等[17]研究发现OTA破坏了猪空肠上皮细胞(IPEC- J2)结构功能完整性,最终导致细胞的增殖或存活率降低,氧化应激可能是毒性效应发生的重要机制.Rahimtula等[18]的研究发现OTA能通过增加脂质过氧化,引起动物体内的毒性作用.Saadatmandi等[14]的研究发现,OTA可以降低猪肾小管细胞(LLC-PK1)超氧化物歧化酶的活性,导致谷胱甘肽-s-转移酶(GST)活动的障碍并增强细胞内ROS的水平,而后可能通过AP-1和Nrf2相关的信号转导通路影响OTA引起的肾毒性.
3.2OTA对人Caco-2细胞的DNA损伤
本试验中,ROS含量以及DNA损伤随OTA的浓度增加而显著增加(P<0.05).当OTA浓度为8 μmol/L 时,ROS水平及DNA损伤水平显著升高(P<0.05).研究发现许多外源性物质可以诱导细胞内的氧化还原反应,产生ROS,OTA也可以引起ROS的产生.ROS以核酸、蛋白、脂肪和一些生物小分子(抗坏血酸、生物胺等)为靶标,通过一系列调节机制,干扰基因表达从而引起细胞的氧化损伤.Schaaf等[19]研究表明,活性氧的产生过剩,可以直接或者间接的扰乱细胞大分子如DNA、蛋白质或脂肪的生理功能及其完整性,最终导致DNA的断裂或者细胞膜受损.研究表明,OTA可以氧化鸟嘌呤加和物,导致DNA片段化而引起DNA的损伤[14-15,20].韩薇等[16]研究发现,OTA能导致叙利亚仓鼠肾细胞细胞活力下降,彗星DNA含量和拖尾现象均与OTA呈剂量依赖关系,可能是由于OTA处理的细胞中超氧化物歧化酶活力显著降低引起.Sava等[5]发现OTA能诱导脂质过氧化并抑制DNA的氧化性修复损伤.
肠道是一种与含有毒素的食品接触非常频繁的器官.从本试验可以看出,OTA可能损害肠细胞内氧化反应以及DNA的完整性.因此,长期食用含有OTA的食物会对肠道健康产生一定的风险.
4结论
OTA能够诱导Caco-2细胞活性显著下降,以及细胞内ROS水平和DNA损伤的显著上升,并且在低浓度时,就对细胞产生了严重的损伤,其中ROS的产生对DNA损伤起了很重要的作用.
参考文献
[1]郝俊冉,许文涛,黄昆仑.赭曲霉毒素A生成转化及致毒机制的研究进展[J].食品工业科技,2012,(12):427-433
[2]Heussner A H,Dietrich D R,O Brien E.Invitroinvestigation of individual and combined cytotoxic effects of ochratoxin A and other selected mycotoxins on renal cells[J].Toxicology in Vitro,2006,20(3):332-341
[3]孙蕙兰,牛钟相,郭延奎.萤光抗体技术对鸡组织器官中赫曲霉毒素残留检测的研究[J].山东农业大学学报,1991,4(22):347-350
[4]Petkova-Bocharov T,Stoichev I I,Castegnaro M,et al.Formation of DNA adducts in tissues of mouse progeny through transplacental contamination and/or lactation after administration of a single dose of ochratoxin A to the pregnant mother[J].Environmental and Molecular Mutagenesis,1998,2(32):155-162
[5]Sava V,Reunova O,Velasquez A,et al.Acute neurotoxic effects of the fungal metabolite ochratoxin-A[J].Neuro Toxicology,2006,27(1):82-92
[6]Obrecht-Pflumio S,Chassat T,Dirheimer G,et al.Genotoxicity of ochratoxin A bySalmonellamutagenicity test after bioactivation by mouse kidney microsomes[J].Mutat Res,1999,446(1):95-102
[7]Zepnik H,Vlkel W,Dekant W.Toxicokinetics of the mycotoxin ochratoxin A in F 344 rats after oral administration[J].Toxicology and Applied Pharmacology,2003,192(1):36-44
[8]Pfohl-Leszkowicz A,Manderville R A.Ochratoxin A:An overview on toxicity and carcinogenicity in animals and humans[J].Molecular Nutrition & Food Research,2007,51(1):61-99
[9]朱银荣,张继,王军龙,等.沙蒿多糖及其衍生物的体外降血糖作用[J].甘肃农业大学学报,2011,46(1):140-143,155
[10]Bravo J,Arbillaga L,De Pea M P,et al.Antioxidant and genoprotective effects of spent coffee extracts in human cells[J].Food and Chemical Toxicology,2013,60:397-403
[11]Corcuera L A,Arbillaga L,Vettorazzi A,et al.Ochratoxin A reduces aflatoxin B1 induced DNA damage detected by the comet assay in Hep G2 cells[J].Food and Chemical Toxicology,2011,49(11):2883-2889
[12]牛钟相,孙蕙兰.赭曲霉毒素的毒理学试验[J].山东农业大学学报,1989(2):27-30
[13]Arbillaga L,Azqueta A,Ezpeleta O,et al.Oxidative DNA damage induced by ochratoxin A in the HK-2 human kidney cell line:evidence of the relationship with cytotoxicity[J].Mutagenesis,2006,22(1):35-42
[14]Boesch-Saadatmandi C,Loboda A,Jozkowicz A,et al.Effect of ochratoxin A on redox-regulated transcription factors,antioxidant enzymes and glutathione-S-transferase in cultured kidney tubulus cells[J].Food and Chemical Toxicology,2008,46(8):2665-2671
[15]Ali R,Mittelstaedt R A,Shaddock J G,et al.Comparative analysis of micronuclei and DNA damage induced by ochratoxin A in two mammalian cell lines[J].Mutation Research,Genetic Toxicology and Environmental Mutagenesis,2011,723(1):58-64
[16]韩薇,缪德年,张部昌,等.赭曲霉毒素A对BHK细胞毒害作用的研究[J].南京农业大学学报,2010(4):87-92
[17]陈平,田刚,陈代文,等.赭曲霉毒素A对IPEC-J2细胞生长和氧化还原平衡的影响[J].中国畜牧杂志,2011(3):22-26
[18]Rahimtula A D,Bereziat J,Bussacchini-Griot V,et al.Lipid peroxidation as a possible cause of ochratoxin A toxicity[J].Biochemical Pharmacology,1988,23(37):4469-4477
[19]Schaaf G J,Nijmeijer S M,Maas R F,et al.The role of oxidative stress in the ochratoxin Amediated toxicity in proximal tubular cells[J].Biochim Biophys Acta,2002,1588(2):149-158
[20]Arbillaga L,Azqueta A,Ezpeleta O,et al.Oxidative DNA damage induced by ochratoxin A in the HK-2 human kidney cell line:evidence of the relationship with cytotoxicity[J].Mutagenesis,2006,22(1):35-42
(责任编辑李辛)
The cytotoxic effects and DNA damage induced by ochratoxin A on Caco-2 cells
ZHANG Jie1,3,4,LI Fa-di1,LI Ai-jun2,ZHENG Nan3,4,LI Song-li3,4,WANG Jia-qi1,3,4
(1.College of Animal Science and Technology,Gansu Agricultural University,Lanzhou 730070,China;2.Tangshan Livestock and Aquatic Products Quality Monitoring Centor,Tangshan 063000,China;3.Ministry of Agriculture Laboratory of Quality & Safety Risk Assessment for Dairy Products (Beijing),Institute of Animal Science,Chinese Academy of Agricultural Sciences,Beijing 100193,China;4.State Key Laboratory of Animal Nutrition,Institute of Animal Science,CAAS,Beijing 100193,China)
Abstract:【Objective】 The research was to investigate the cytotoxic effect,oxidative damage and DNA damage induced by different concentration of OTA on Caco-2 cells.【Method】 Caco-2 cells were treated with OTA at concentrations of 0.32,1.6,8,40,200 μmol/L for 24 h ,48 h and 72 h to detect cell survival rate using MTT assay,to assess the free radical levels of by reactive oxygen species(ROS) kit and to evaluate DNA damage using comet assay.【Result】 OTA with the concentration over 0.32 μmol/L had obvious inhibitory effect on survival rate of Caco-2 cells (P<0.05) at each treated period.ROS levels and DNA damage were increased significantly with the increase of OTA concentration compared to the control group (P<0.05).Notably,OTA showed very high cytotoxicity at the relatively low concentrations of 0~8 μmol/L.【Conclusion】 OTA possessed cytotoxicity and could induce oxidative stress and DNA damage in Caco-2 cells.Increase of ROS levels might contribute to the DNA damage induced by OTA in Caco-2 cells.
Key words:ochratoxin A;MTT;ROS;Comet assay;DNA damage
通信作者:王加启,男,研究员,主要从事奶牛营养研究.E-mail:jiaqiwang@vip.163.com
基金项目:公益性行业(农业)科研专项项目“生鲜乳质量安全评价技术与生产规程”(201403071);生鲜乳质量安全风险评估专项(2014-z3);中国农业科学院科技创新工程(ASTIP-IAS12)
收稿日期:2015-03-23;修回日期:2015-04-11
中图分类号:Q 279
文献标志码:A
文章编号:1003-4315(2016)01-0018-06
第一作者:张捷(1987-),男,硕士研究生,研究方向为生鲜乳质量安全.E-mail:kankanhard@126.com
