蛋白激酶R的原核表达、纯化及多克隆抗体制备
2016-04-14张涛罗维玉姜水涛朱鹏阳李呈军
张涛,罗维玉,姜水涛,朱鹏阳,李呈军,
陈化兰2,孙晓林1 ,姜丽2
( 1.甘肃农业大学动物医学院,甘肃 兰州 730070;2.中国农业科学院哈尔滨兽医研究所兽医
生物技术国家重点实验室,农业部动物流感重点开放实验室,黑龙江 哈尔滨 150001)
蛋白激酶R的原核表达、纯化及多克隆抗体制备
张涛1,2,罗维玉1,2,姜水涛2,朱鹏阳2,李呈军2,
陈化兰2,孙晓林1,姜丽2
( 1.甘肃农业大学动物医学院,甘肃 兰州730070;2.中国农业科学院哈尔滨兽医研究所兽医
生物技术国家重点实验室,农业部动物流感重点开放实验室,黑龙江 哈尔滨150001)
摘要:【目的】 构建蛋白激酶R的原核表达系统并制备其多克隆抗体.【方法】利用RT-PCR方法从人的A549细胞中扩增蛋白激酶R(PKR)基因,将其克隆到表达载体pGEX-6P-1中,经纯化后制备特展异性多克隆抗体.【结果】 PKR基因经测序鉴定后转化宿主菌BL21(DE3)感受态细胞,经终浓度0.5mmol/L IPTG诱导表达GST-PKR融合蛋白,SDS-PAGE分析表明融合蛋白获得稳定表达.表达产物经Glutathione-sepharose 4B 亲和层析初步纯化后,用凝血酶切除GST标签,而后经离子交换层析及分子筛在AKTA Explorer上进一步纯化,得到高纯度无标签的PKR蛋白.以纯化后的PKR蛋白为抗原免疫新西兰白兔制备多克隆抗体,斑点杂交试验检测其效价达到1∶50 000以上,Western-blot和间接免疫荧光试验(IFA)表明制备的多抗与PKR蛋白的反应具有高度特异性.【结论】 PKR蛋白在大肠杆菌中成功表达,且制备的多克隆抗体可用于PKR蛋白的检测,从而为研究PKR在病毒感染过程中的作用提供了重要的工具.
关键词:PKR;原核表达;蛋白纯化;多克隆抗体
蛋白激酶R(protein kinase R,PKR)是对病毒感染等细胞内压力信号产生应答的前哨丝氨酸/苏氨酸蛋白激酶,由N-端的双链RNA结合结构域(dsRBD)和C-端的激酶结构域组成.PKR广泛存在于各类哺乳动物的组织和细胞中,其存在形式主要有无活性单体、无活性二聚体和活性二聚体.通常情况下,PKR是以无活性的单体形式存在,当受到外因刺激后PKR从自我抑制的状态中激活,形成有活性的二聚体[1-3].PKR在病毒感染后的免疫应答中发挥重要作用,其dsRBD能够与病毒转录过程中产生的及人工合成的dsRNA相互结合,从而使dsRBD从激酶区解离出来,导致激酶区活化和PKR被激活并行使抗病毒作用.PKR主要是通过磷酸化底物eIF-2,抑制病毒蛋白和宿主蛋白的翻译从而发挥抗病毒效应[4].另一方面,病毒在与宿主的斗争过程中,可以利用自身编码的蛋白抑制宿主的抗病毒作用.例如,流感病毒可以通过3种机制抑制PKR信号通路的激活:首先,PKR的表达可以被干扰素诱导产生,但流感病毒的NS1蛋白可以阻断细胞内的干扰素合成,从而降低细胞内的PKR水平;其次,NS1蛋白可以扣押PKR激活的激活剂,即dsRNA,从而抑制PKR的激活;最后,NS1蛋白可以直接与PKR形成复合物,抑制PKR在dsRNA或激活因子PACT诱导下的激活反应[5-6].研究发现,缺失NS1的流感病毒可以在PKR敲除的小鼠体内复制,且其致病性有所增强[7].PKR除具有抗病毒功能外,在蛋白翻译、转录调控、细胞凋亡、信号转导及肿瘤发生中也具有重要的作[8-10].
由上可知,作为一个重要的机体调控蛋白,PKR的结构与功能研究显得极为重要.目前已经有PKR蛋白dsRBD、激酶结构域以及激酶结构域与eIF-2复合体的结构解析报道[11].但是,鉴于PKR蛋白在宿主免疫系统中的重要作用,仍需深入研究PKR蛋白与其它宿主蛋白或病毒蛋白之间相互作用的分子机制和生物学功能.因此,本研究拟利用大肠杆菌表达系统表达了PKR蛋白1-169位之间的区段,在进行高效纯化后免疫新西兰白兔,制备其特异性的多克隆抗体[12-13],以期为后续的PKR蛋白与其它宿主蛋白或病毒蛋白之间相互作用的结构和功能研究提供条件.
1材料与方法
1.1细胞、载体与试验动物
人肺腺癌细胞(A549)、人胚胎肾细胞(293T)、pGEX-6P-1质粒、凝血酶由中国农业科学院哈尔滨兽医研究所农业部动物流感重点开放实验室保存.4月龄雌性新西兰白兔购自中国农业科学院哈尔滨兽医研究所实验动物中心.
1.2菌株及主要试剂
DH5a、BL21(DE3)购自北京天根生化科技有限公司;Pfx高保真DNA聚合酶购自Invitrogen公司;BamHⅠ、NotⅠ、T4DNA连接酶购自NEB公司;DNA Marker 购自TaKaRa公司;Protein Marker购自Thermo Scientific公司;M-MLV反转录酶购自Promega公司;DNA片段纯化试剂盒、质粒小量提取试剂盒购自AXYGEN公司;Glutathione-sepharose 4B亲和层析柱填料购自GE Healthcare公司;弗氏佐剂、红外标记的羊抗兔IgG 和FITC标记的羊抗兔IgG等购自Sigma公司;其它试剂均为国产分析纯产品.
1.3pGEX-6P-1-PKR重组表达质粒的构建与鉴定
收集生长状态良好的A549细胞,用TR-Iizol试剂提取细胞总RNA,反转录反应根据M-MLV反转录酶说明书方法操作.根据GenBank上发表的人PKR的序列设计1对引物:P1:5′-GCATATGGATCCATGGCTGGTGATCTTTCAG-3′和 P2:5′-GCAAATGCGGCCGCCTATTCTTCTGATAATATCTGAAGATATGCAAG-3′,并引入BamHⅠ和NotⅠ酶切位点(下划线部分),用于扩增PKR 蛋白1-169之间的区段.以cDNA为模板,P1、P2为上下游引物,用Pfx DNA聚合酶PCR扩增目的片段.PKR扩增程序为:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 45 s,68 ℃ 1 min,共35个循环;最后68 ℃延伸10 min.扩增结束后,取5 μL PCR产物进行琼脂糖凝胶电泳,将鉴定正确的PCR产物用DNA片段胶回收试剂盒回收纯化.将回收的PKR片段和pGEX-6P-1载体分别用BamHⅠ和NotⅠ于37 ℃双酶切处理,经DNA片段纯化试剂盒纯化后用T4DNA连接酶于16 ℃连接过夜,将连接产物转化大肠杆菌DH5a感受态细胞,涂布于含有氨苄青霉素的LB平板,培养过夜后,挑取单菌落接种于LB液体培养基(Amp+)中,于37 ℃振荡培养10 h后,进行菌液PCR鉴定,鉴定阳性的菌液用质粒小量提取试剂盒提取重组质粒,利用本研究室的ABI3500xL序列测定仪测序鉴定为阳性的重组质粒命名为pGEX-6P-1-PKR.
1.4GST-PKR融合蛋白的诱导表达
将pGEX-6P-1-PKR重组质粒转化BL21(DE3),挑取单菌落接种于25 mL LB液体培养基中(Amp+),于37 ℃振荡过夜培养,次日按1∶100比例接种于LB液体培养基(Amp+),于37 ℃扩大培养,待D600值达到0.6~0.8时降温至23 ℃,加入终浓度为0.5 mmol/L IPTG诱导剂,23 ℃诱导16~18 h后,4 000 r/min、4 ℃离心10 min收集菌体细胞,用预冷的Lysis Buffer缓冲液(25 mmol/L Tris 8.0,150 mmol/L NaCl,3 mmol/L DTT,0.5%Triton X-100)重悬菌体细胞,并加入终浓度1 mmol/L PMSF,高压破碎后,16 000 r/min、4 ℃离心30 min分别收集上清与沉淀,SDS-PAGE分析GST-PKR融合蛋白的表达及可溶性情况,考马斯亮蓝染色.
1.5GST-PKR融合蛋白的纯化
用预冷的Lysis Buffer缓冲液平衡Glutathione-sepharose 4B 亲和层析柱,取高压破碎离心后的上清液挂柱,再用Lysis Buffer 缓冲液冲洗杂蛋白,此步骤重复3次,最后用Glutathione-sepharose 4B 蛋白洗脱液(50 mmol/L Tris 8.0,3 mmol/L DTT,5 mmol/L Glutathione,reduced)洗脱,收集目的蛋白,加入凝血酶后于4 ℃作用过夜以切除GST-PKR融合蛋白的GST标签,经SDS-PAGE分析切割情况,确认切割完全后用AKTA explorer 纯化系统进行离子交换层析及分子筛分离纯化,得到去除GST标签并具有高纯度的PKR蛋白.
1.6PKR多克隆抗体的制备及抗体效价的测定
将纯化的PKR蛋白与弗氏佐剂等量乳化后免疫4月龄雌性新西兰白兔.初次免疫采用弗氏完全佐剂,免疫剂量为每只兔子200 μg蛋白,采取背部皮下多点注射的方法免疫.初次免疫后间隔14、28、42 d加强免疫,加强免疫时采用弗氏不完全佐剂,免疫剂量和方法同初次.第4次加强免疫3 d后耳缘静脉采血,37 ℃静置2 h,3 500 r/min离心10 min收集上清即为抗血清,用斑点杂交试验检测抗体效价.
1.7Western-blot 鉴定
采用RT-PCR方法扩增得到PKR全长基因(1 656 bp),将目的片段克隆到真核表达载体pCAGGS中,测序鉴定得到pCAGGS-PKR重组质粒.将pCAGGS-PKR重组质粒瞬时转染到293T细胞中以过量表达PKR蛋白,转染48 h后用RIPA裂解液(50 mmol/L Tris 7.5,150 mmol/L NaCl,0.5% NP40,1 mmol/L PMSF)裂解细胞,测定蛋白浓度,同时设置非转染对照组以检测细胞中的本底性PKR蛋白.取原核表达纯化的GST-PKR融合蛋白(3 μg)、PKR蛋白(3 μg)、GST蛋白(3 μg)、过量表达PKR的293T细胞裂解液上清(含总蛋白80 μg)以及非转染对照293T细胞裂解液上清(含总蛋白80 μg)样品,进行SDS-PAGE凝胶电泳后转印至硝酸纤维素膜上,以5%脱脂乳4 ℃封闭过夜,用PBST冲洗后以制备的PKR多克隆抗体为一抗(1∶1 000),或以抗GST兔血清为对照(1∶1 000),37 ℃室温孵育1 h,洗涤后加入红外标记的羊抗兔IgG作为二抗(1∶10 000),37 ℃室温孵育1 h,最后用红外荧光扫描成像系统扫描硝酸纤维素膜,检测所制备的PKR多克隆抗体与目的蛋白反应的特异性.
1.8间接免疫荧光(IFA)鉴定
将生长状态良好的A549细胞用4%多聚甲醛固定30 min,PBS浸洗3次,以0.05%Ttiton X-100室温通透30 min,PBS浸洗3次,用5%BSA室温封闭1 h后加入制备的多克隆抗体做为一抗(1∶1 000),同时设免疫前兔血清作为阴性对照,4 ℃孵育过夜,PBS浸洗3次,加入FIFC标记的羊抗兔IgG作为二抗(1∶1 000),室温孵育1 h,PBS浸洗3次,利用荧光显微镜进行检测,以鉴定所制备多克隆抗体的特异性.
2结果与分析
2.1pGEX-6P-1-PKR重组表达质粒的构建
通过RT-PCR方法扩增获得的PKR蛋白1-169位之间片段的琼脂糖凝胶电泳结果如图1-A所示,扩增片段约为500 bp左右,与预期条带大小一致.将酶切后的PKR片段克隆至原核表达载体pGEX-6P-1后,连接产物转化DH5a感受态细胞,挑取单菌落培养并做菌液PCR鉴定,获得500 bp左右的扩增片段(图1-B),与预期结果一致.提取重组质粒pGEX-6P-1-PKR后,进行测序分析,结果显示目的基因插入正确,序列和读码框正确无误.

M: DNA Maker DL 2000;1:A549细胞中PKR基因的RT-PCT扩增产物;2:阴性对照;3:重组质粒pGEX-6P-1-PKR的菌液PCR产物;A:PKR基因的RT-PCR扩增;B:重组质粒pGEX-6P-1-PKR的PCR鉴定.图1 重组质粒pGEX-6P-1-PKR构建Fig.1 The construction of recombinant plasmid pGEX-6P-1-PKR
2.2GST-PKR融合蛋白的表达及纯化
将pGEX-6P-1-PKR重组质粒转化至BL21(DE3),挑菌培养经0.5 mmol/L IPTG诱导16~18 h后收集菌体并高压破碎后,进行SDS-PAGE分析.如图2所示,融合蛋白获得高效表达,且具有可溶性,其分子质量约为45kU,与预期大小一致.融合蛋白经凝血酶切除GST标签后,利用AKTA explorer系统进行离子交换层析及分子筛纯化,收集目的蛋白峰,用氮气浓缩装置在低温条件下浓缩,并测定蛋白浓度后置于液氮内冻存备用.

M:预染蛋白Maker;1:含PGEX-6p-1-PKR质粒的重组工程菌IPTG诱导后菌体裂解液;2:含PGEX-6p-1-PKR质粒的重组工程菌高压破碎离心后沉淀;3:含PGEX-6p-1-PKR质粒的重组工程菌高压破碎离心后上清挂柱后弃液;4:含PGEX-6p-1-PKR质粒的重组工程菌高压破碎离心后上清;5:纯化的GST-PKR融合蛋白.图2 GST-PKR融合蛋白的表达与纯化Fig.2 Expression and purification of GST-PKR fusion protein
2.3PKR蛋白多克隆抗体效价检测
以纯化后的无标签PKR蛋白免疫4月龄新西兰雌兔4次,每次间隔14 d,第4次免疫3 d后耳缘静脉采血,采用斑点杂交试验检测抗体效价,其效价达到1∶50 000以上.
2.4PKR蛋白多克隆抗体的特异性检测
将原核表达纯化的GST-PKR融合蛋白、PKR蛋白、GST蛋白、过量表达PKR的293T细胞裂解液上清以及非转染对照293T细胞裂解液上清样品,进行SDS-PAGE凝胶电泳后转印至硝酸纤维素膜上,分别以制备的PKR多克隆抗体或抗GST兔血清作为一抗进行Western blot检测,以确定所制备的PKR多克隆抗体与目的蛋白反应的特异性.结果如图3所示,当以制备的PKR多克隆抗体为一抗时,纯化的GST-PKR融合蛋白和纯化的PKR蛋白样品的转印膜上均具有特异性的条带,对照GST蛋白则无条带,而且转染PKR表达质粒的293T细胞裂解液中的PKR蛋白含量也较非转染293T细胞对照组显著增多;当以抗GST兔血清作为一抗时,纯化的GST-PKR融合蛋白和纯化的GST蛋白对应的转印膜上具有特异性的条带,而纯化的PKR蛋白对应的位置则无条带.以上结果表明,PKR蛋白免疫制备的多克隆抗体与PKR蛋白的反应具有特异性.
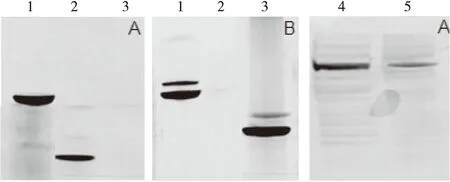
1:纯化的GST-PKR融合蛋白;2:纯化的PKR蛋白;3:纯化的GST蛋白;4:转染PKR表达质粒的293T细胞裂解液; 5:非转染293T细胞裂解液对照;A:以制备的PKR多克隆抗体为一抗;B: 以抗GST兔血清为一抗.图3 Western blot检测兔抗PKR多克隆抗体的特异性Fig.3 Detection of the rabbit anti-PKR polyclonal antibody specificity by Western blot
2.5间接免疫荧光(IFA)鉴定
将生长良好的A549细胞固定封闭后,分别以制备的PKR多克隆抗体或免疫前兔血清作为阴性对照进行IFA检测.如图4所示,本研究中制备的PKR多克隆抗体可以与细胞内源性的PKR蛋白结合,产生特异性红色荧光,而免疫前兔血清对照组则无红色荧光信号(图4).
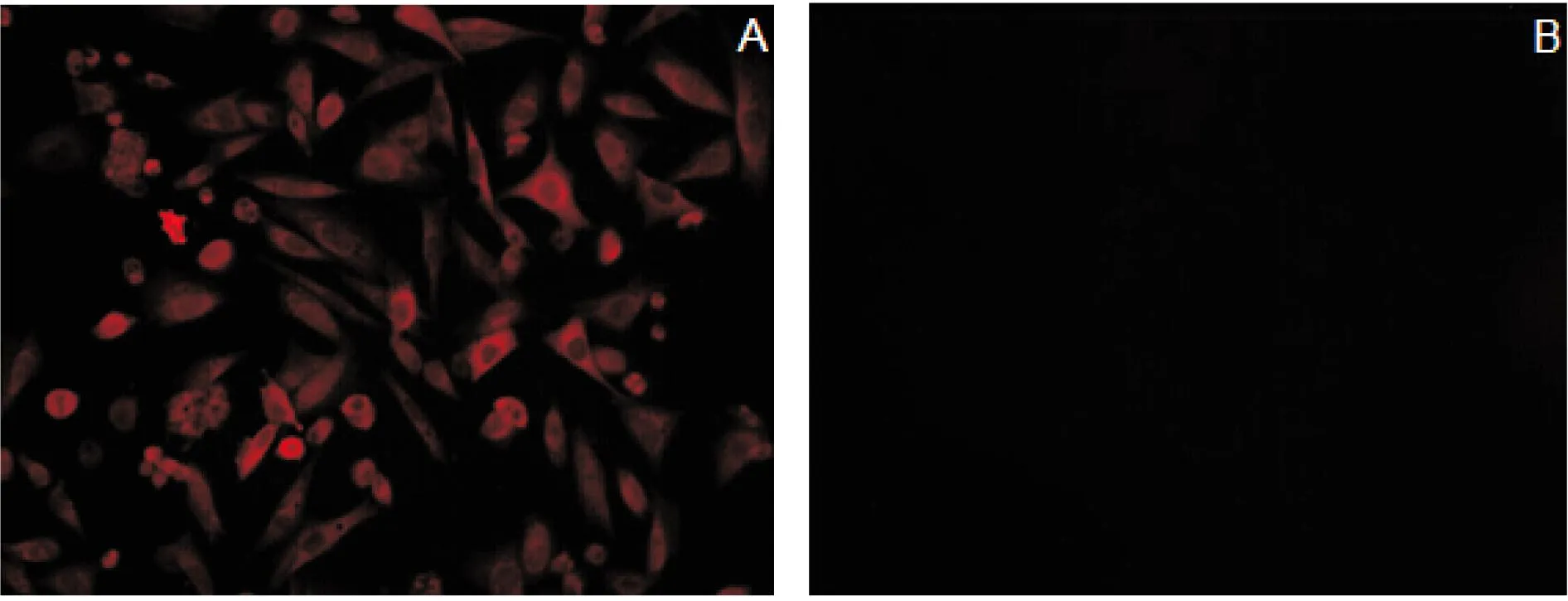
A:以制备的PKR多克隆抗体为一抗;B: 以免疫前正常兔血清为一抗.图4 IFA检测A549细胞的PKR蛋白Fig.4 Detection of PKR in A549 cells by IFA
3讨论
本实验室关注PKR蛋白所具有的广谱抗病毒效应,它可以抑制流感病毒、牛痘病毒、丙型肝炎病毒、巴尔病毒和单纯疱疹病毒等.然而,这些病毒也逐渐进化出复杂的机制去拮抗PKR的应答反应,并且该拮抗作用可以表现在PKR信号通路的每一个阶段,包括抑制dsRNA激活因子的识别、阻断PKR的激活、导致PKR降解以及阻止PKR底物磷酸化[14-15].但是,PKR蛋白和病毒之间的拮抗与反拮抗作用对病毒整个复制周期调控以及生物学特性的影响,仍有待于进一步深入研究.对于PKR与其互作宿主因子或病毒蛋白的深入研究与探索,均需要对PKR蛋白的准确鉴定与定位,这些都离不开识别PKR蛋白的高效特异性抗体的获得.本研究中,作者选择了能够大量表达、稳定性高且酶切纯化效果好的,连接到带有GST标签的pGEX-6P-1载体上PKR蛋白1-169位区段,GST-PKR融合蛋白在23 ℃低温诱导16 h左右表达产量最高,菌体收集以及蛋白纯化等步骤均在冰上或4 ℃条件下进行,充分保证了蛋白的稳定性及免疫原性.以分离纯化的PKR蛋白为免疫原,制备了高效价、特异性强的多克隆抗体,为进一步探究PKR蛋白及其相互作用蛋白的结构和生物学功能奠定了基础.
参考文献
[1]Nallagatla S R,Toroney R,Bevilacqua P C.Regulation of innate immunity through RNA structure and the protein kinase PKR[J].Current Opinion in Structural Biology,2011,21(1):119-127
[2]Dabo S,Meurs E F.dsRNA-dependent protein kinase PKR and its role in stress,signaling and HCV infection[J].Viruses,2012,4(11):2598-2635
[3]夏君,谢炯,张萍.抗病毒蛋白PKR 的结构和功能[J].中国免疫学杂志,2013,20(2):205-209
[4]Taylor S S,Haste N M,Ghosh G.PKR and eIF2alpha:integration of kinase dimerization,activation,and substrate docking[J].Cell,2005,122(6):823-825
[5]Hatada E,Saito S,Fukuda R.Mutant influenza viruses with a defective NS1 protein cannot block the activation of PKR in infected cells[J].Journal of Virology,1999,73(3):2425-2433
[6]Zürcher T M R,Ortín J.Protein synthesis shut-off induced by influenza virus infection is independent of PKR activity[J].Journal of Virology,2000,74(18):8781-8784
[7]Bergmann M,Garcia-Sastre A,Carnero E,et al.Influenza virus NS1 protein counteracts PKR-mediated inhibition of replication[J].J Virol,2000,74(13):6203-6206
[8]Mounir Z,Koromilas A E.Uncovering the PKR pathway's potential for treatment of tumors[J].Future Oncology,2010,6(5):643-645
[9]Sadler A J,Williams B R.Structure and function of the protein kinase R[J].Current Topics in Microbiology and Immunology,2007,316:253-292
[10]Jagus R,Joshi B,Barber G N.PKR,apoptosis and cancer[J].The International Journal of Biochemistry & Cell Biology,1999,31(1):123-138
[11]Dar A C,Dever T E,Sicheri F.Higher-order substrate recognition of eIF2alpha by the RNA-dependent protein kinase PKR[J].Cell,2005,122(6):887-900
[12]胡文,孟春春,李传峰,等.甲型鸭肝炎病毒2A蛋白的原核表达、纯化及多克隆抗体的制备[J].甘肃农业大学学报,2014,49(6):5-9
[13]陈佳宁,李旭勇,陈化兰,等.禽流感病毒NS2蛋白的原核表达及多克隆抗体的制备[J].中国预防兽医学报,2012,34(6):489-491
[14]贾因棠,魏来,蒋栋,等.双链RNA激活的蛋白激酶(PKR))的克隆表达对丙型肝炎病毒蛋白合成的抑制作用[J].中国生物化学与分子生物学报,2006,22(1):24-30
[15]Langland J O,Cameron J M,Heck M C,et al.Inhibition of PKR by RNA and DNA viruses[J].Virus Research,2006,119(1):100-110
(责任编辑李辛)
Prokaryotic expression,purification and polyclonal antibody preparation of protein kinase R
ZHANG Tao1,2,LUO Wei-yu1,2,JIANG Shui-tao2,ZHU Peng-yang2,LI Cheng-jun2,CHEN Hua-lan2,SUN Xiao-lin1,JIANG Li2
(1.College of Veterinary Medicine,Gansu Agricultural University,Lanzhou 730070,China;2.State Key Laboratory of Veterinary Biotechnology,Harbin Veterinary Research Institute,Chinese Academy of Agricultural Science,Harbin 150001,China)
Abstract:【Objective】 Establishing prokaryotic expression system and preparing polyclonal antibody preparation of protein kinase R (PKR).【Method】 Using the total RNA of human A549 cells as template,the protein kinase R (PKR) gene was amplified by RT-PCR and cloned into the expression vector pGEX-6p-1 and prepared as polyclonal antibody.【Result】 After sequencing validation of PKR,the recombinant plasmid was transformed into E.coli BL21 (DE3) and were induced with 0.5 mmol/L IPTG into GST-PKR fusion protein.SDS-PAGE analysis showed that the GST-PKR fusion protein was stably expressed.The expression product was purified by glutathione-sepharose 4B affinity chromatography,treated by thrombin to remove the GST tag,further purified by ion-exchange chromatography and molecular sieve using the AKTA Explorer system.The purified PKR protein with high purity and no tag was then used to vaccinate New Zealand rabbits four times to prepare polyclonal antibody.Dot blot hybridization assay showed that the polyclonal antibody titer was more than 1∶50 000 in the rabbit antiserum.The specificity of the polyclonal antibody against PKR was then validated by western-blot and indirect immunofluorescence assay (IFA).【Conclusion】 PKR protein was successfully expressed in E.coli,and the polyclonal antibody could be used to detect PKR protein,thus providing a necessary tool for researching the role of PKR in the virus infection process.
Key words:protein kinase R;prokaryotic expression;protein purification;polyclonal antibody
通信作者:孙晓林,男,教授,硕士生导师,研究方向为兽医卫生检验.E-mail:sunxl@gsau.edu.cn
基金项目:中央级公益性科研院所基本科研业务费专项(03022014001);国家自然基金青年基金(31402206).
收稿日期:2015-01-17;修回日期:2015-03-30
中图分类号:Q 78
文献标志码:A
文章编号:1003-4315(2016)01-0007-06
第一作者:张涛(1989-),男,硕士研究生,主要从事兽医公共卫生检验及动物流感分子生物学研究.E-mail:243484808@qq.com
姜丽,女,副研究员,硕士生导师,研究方向为动物病原微生物与分子生物学.E-mail:jiangli@caas.cn
