腺病毒介导的PDCD4基因过表达促进肾癌BTG1蛋白的表达和786-O细胞的凋亡
2016-04-14胡俊彪戴国平吴慧玲杜小文
徐 挺 胡俊彪 戴国平 吴慧玲 杜小文
(金华市人民医院泌尿外科,浙江 金华 321000)
腺病毒介导的PDCD4基因过表达促进肾癌BTG1蛋白的表达和786-O细胞的凋亡
徐挺胡俊彪戴国平吴慧玲杜小文
(金华市人民医院泌尿外科,浙江金华321000)
〔摘要〕目的探讨过表达抑癌基因PDCD4的腺病毒对肾透明细胞腺癌细胞株(786-O)的影响及肾脏注射后对肾癌的治疗效果。方法体外构建过表达抑癌基因PDCD4的腺病毒;培养786-O细胞株,转染腺病毒体外干预,观察细胞的死亡情况;将SD大鼠随机分为对照组和移植组,两组均在前肢腋部皮下注射786-O细胞株构建肾癌模型,造模14 d后,对照组瘤中注射0.1 ml D-Hanks,移植组则注射含1×1011vp/mL的表达抑癌基因PDCD4的腺病毒的D-Hanks 0.1 ml。结果体外观察转染病毒后,786-O细胞的生长活力下降,死亡率升高;体内注射病毒后,可以观察到肾脏中抑癌基因PDCD4的上调和BTG1 蛋白表达水平的升高。结论过表达抑癌基因PDCD4的腺病毒注射治疗肾癌具有可行性。
〔关键词〕肾癌;PDCD4;腺病毒;786-O
加深对肾癌的深层认知,从基因水平寻找突破口将是治疗肾癌有效的途径〔1,2〕。程序化凋亡因子(PDCD)4是一种抑癌基因,能够通过启动eIF4A、eIF4G达到抑制细胞生长的效果。癌组织中的PDCD4表达下降甚至缺失,提示我们上调PDCD4表达可能是启动癌细胞凋亡的分子开关〔3〕。腺病毒是一种具有双链DNA结构的病毒,但是却无法整合进入人细胞的基因组,这为临床应用分子手段提供了一种相对安全的载体〔4〕。
1材料与方法
1.1实验动物、主要试剂及仪器雌性SD大鼠200 g左右。实验过程符合动物伦理要求。RPMI1640培养液(Hyclone)、胎牛血清(Gibco)、显微镜(Zeiss)、电泳仪(Biorad)和酶标仪(TECAN sunrise)等。
1.2方法
1.2.1786-O细胞的培养传代将购买的786-O细胞株(中国科学院细胞库,上海)种植于培养瓶中,RPMI1640培养液培养含20%胎牛血清,于37℃恒温箱培养。每当细胞铺满瓶底时,使用0.25%胰酶消化传代。
1.2.2过表达抑癌基因PDCD4的腺病毒构建腺病毒的设计、构建和合成由汉恒生物公司完成。
1.2.3过表达抑癌基因PDCD4的腺病毒体外转染786-O当786-O长满96孔板底部时,实验组加入100 mol 2 μl病毒转染细胞,对照组加入2 μl D-Hanks。用MTT方法检测786-O的生长活力情况。转染病毒1、3、5、7 d后,各时间点做细胞的生长活力检测。每孔加入MTT (5 mg/ml,即0.5% MTT) 50 μl和L-DMEM培养液450 μl,37℃继续孵育4 h。弃丢上清液,每孔加入DMSO 350 μl,脱色摇床上剧烈摇晃20 min。将每孔的DMSO溶液分别转移到另一96孔板中,做3个复孔,每孔100 μl。在酶联免疫监测仪上选择波长490 nm,测定各孔的光密度值。以各分组为横坐标,光密度值(OD值)为纵坐标,绘制786-O生长活力线条图,并比较不同组细胞不同时间点的生长活力。MTT方法检测生长活力数据。实验重复3次。
1.2.4SD鼠肾癌模型构建和过表达抑癌基因PDCD4的腺病毒输注及其观察建原位肾癌模型。将786-O通过胰酶消化,细胞计数,配制成1×106的细胞悬液,并打入大鼠前肢腋部皮下,制备细胞荷瘤。瘤体的取出和鉴定:14 d后,在无菌条件下处死裸鼠,剥离瘤体,生理盐水中清洗,多聚甲醛固定,并将肿瘤组织切成0.5 mm×0.5 mm×0.5 mm大小,4%石蜡包埋组织块,苏木素-伊红(HE)染色观察成瘤情况。注射病毒:实验组将过表达抑癌基因PDCD4的腺病毒30 μl使用微量注射器打入瘤体中。每注射5 μl,留针10 min,再取另一个注射点注射,重复以上操作直至注射完毕。
1.2.5PDCD4基因的表达RT-PCR引物:PDCD4,上游引物:5'-TCAGCGACAGTGGGAGT-3';下游引物:5'-AGCACGGTAGCCTTAT-3';β-actin上游引物:5'-AGAGGGAAATCGTGCGTGAC-3',下游引物:5'-AGAGGTCTTTACGGATGTCAACG-3′。Trizol试剂进行细胞裂解,提取细胞总RNA后,进行纯度鉴定,用反转录试剂盒将RNA 反转录为cDNA,然后经PCR扩增相应的cDNA(公司Takara,货号9109,RR047A和RR820A)。PCR产物进行半定量分析。
1.2.6Western印迹检测B细胞易位基因1(BTG1)蛋白的表达情况。用10%的胶来分离蛋白,然后湿转法将蛋白转至PVDF膜上,室温下封闭,使用Mouse anti- BTG1(Abcam,ab50991)一抗孵育过夜,第2天用羊抗小鼠HRP孵育1 h后,加入显色剂,曝光。
1.3统计学方法使用SPSS13.0软件进行t检验。
2结果
2.1786-O细胞生长状况体外培养的786-O细胞不断增多,细胞形态变为长梭形、成纤维细胞样或多角形,呈放射状,形成小集落。当细胞培养至接近融合时传代。光镜下细胞透亮,均匀生长在培养面上,胞体突起,胞界清楚,胞核饱满。随着细胞的传代,细胞也逐渐趋于纯化。见图1。
2.2病毒转染情况和786-O生长状况体外转染病毒后的实验组细胞和对照组细胞分别做RT-PCR,可以观察到实验组细胞的PDCD4基因表达(4.20±0.55),明显高于对照组(0.40±0.10,P<0.05),说明病毒转染成功。转染病毒后MTT法观察到,随着转染时间的增长,实验组细胞转染病毒后,生长活力明显下降,说明在腺病毒介导的PDCD4基因过表达状态下,肾癌细胞的生长受到抑制。1 d时,两组没有差异,在3、5、7 d,实验组的生长活力明显低于对照组(P<0.05),见图2。
2.3大鼠肾癌模型造模情况HE染色显示肿瘤细胞囊腔内纤维化,瘤细胞胞质透明并且较温和,间质中可见少量平滑肌细胞,说明造模成功,能够通过786-O细胞的皮下注射形成肾癌瘤体。
2.4大鼠瘤体中PDCD4和BTG1表达情况注射病毒后,实验组中PDCD4基因(6.41±0.94)和BTG1蛋白(1.35±0.30)表达水平均高于对照组(1.23±0.67,0.19±0.02),说明我们构建的腺病毒载体也能在体内提高PDCD4基因,进而提高BTG1 蛋白表达水平,见图4。

图1 体外培养的786-O细胞(×200,标尺=20 μm)
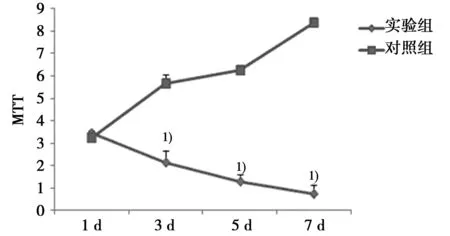
与对照组比较:1)P<0.05图2 两组在不同时间点的细胞生长活力
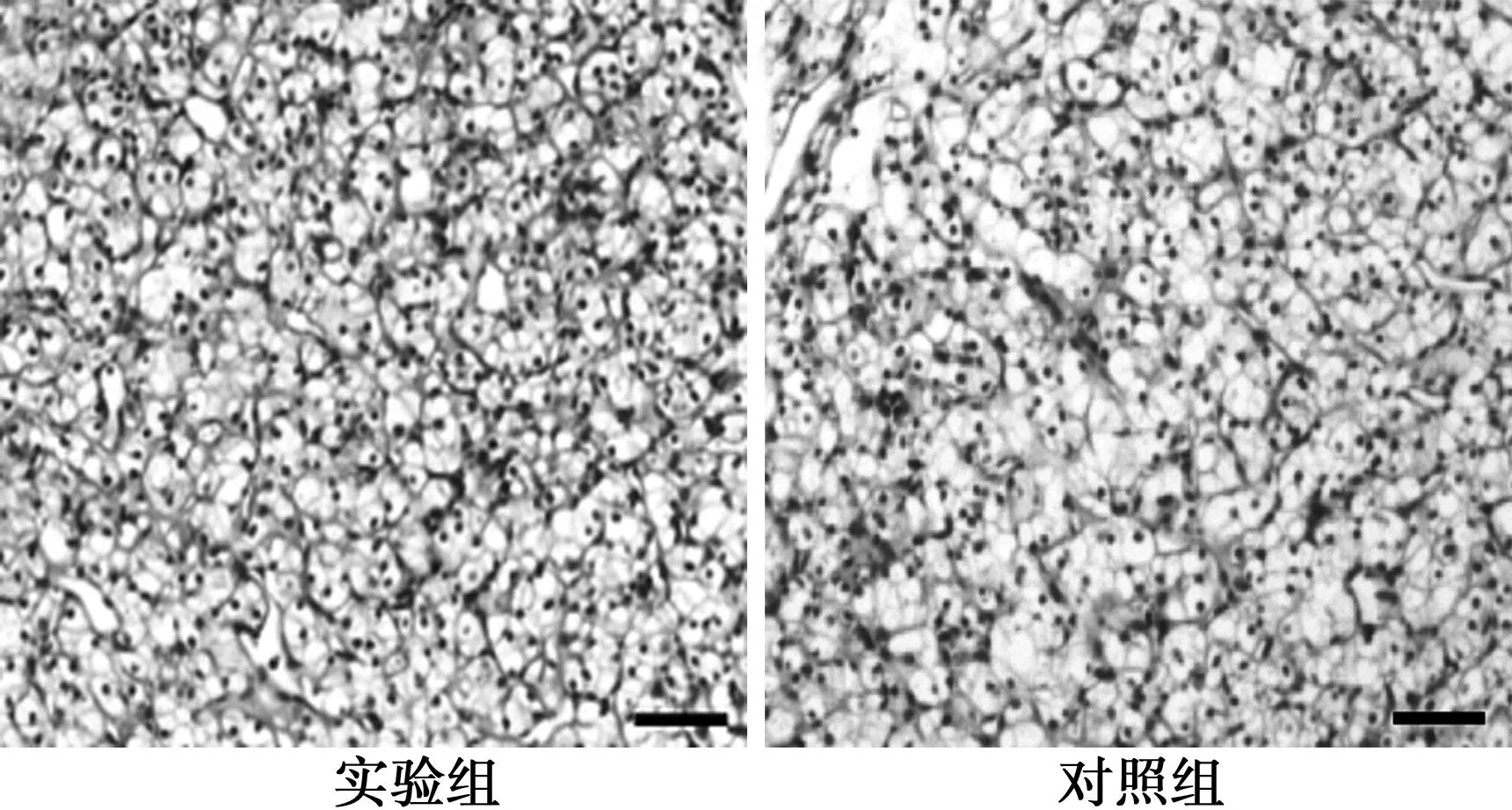
图3 两组动物成瘤组织切片情况(HE,×100)
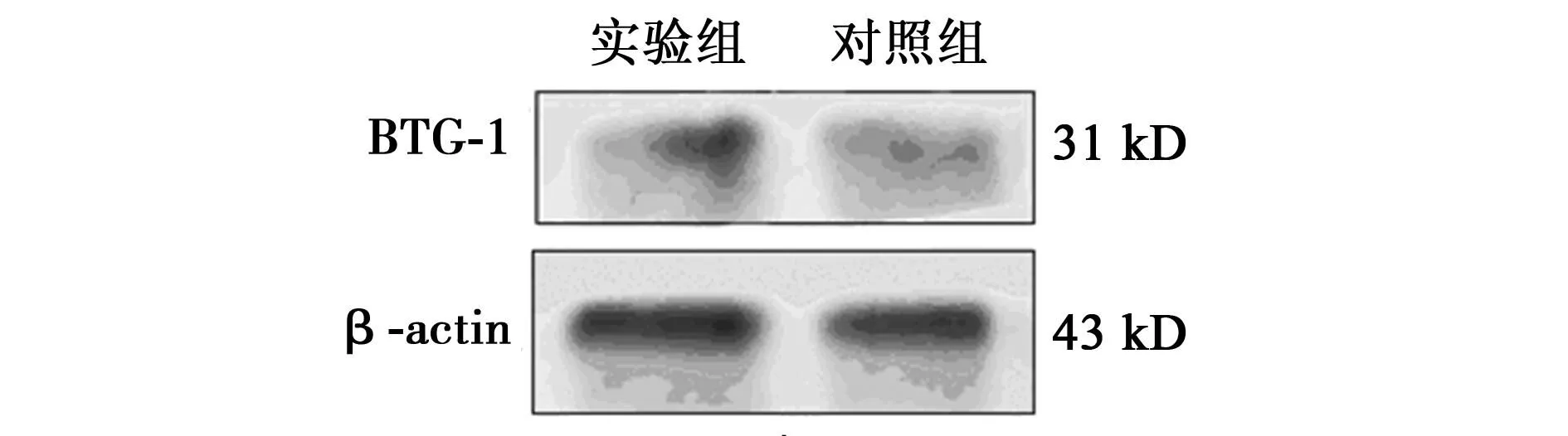
图4 不同组瘤体中BTG1 蛋白量
3讨论
肾癌是一种高发病率和高死亡率的癌症,其对放化疗不敏感,患者术后多采取中医药等手段以防复发和转移。但绝大多数患者确诊时,已经处于癌症晚期,仅能接收放化疗,疗效较差。因此,运用最新的科学研究手段来辅助治疗至关重要〔5〕。随着精准化医学的倡导,基因治疗作为一种新兴的精准的治疗手段,逐渐被人们所关注。以病毒作为基因治疗的手段,在世界范围内早已受到广泛的研究,但是由于病毒的实际应用存在着较大的安全隐患,导致了不少研究成果止步于实验室,而难以进行下一步的临床应用〔6,7〕。腺病毒是一种广为研究的病毒,由双链DNA组成,由于其不整合进细胞基因组,且不长期表达,对人不具有致癌性,而成为临床应用的首选〔8〕。早在2006年,CFDA批准了基因改造的腺病毒H101用于治疗头颈癌。这种腺病毒的相对安全性,也为基因改造的临床应用提供可行性〔9〕。PDCD4是一种抑癌基因,它与细胞凋亡和肿瘤抑制息息相关。许多研究表明,PDCD4基因在前列腺癌、卵巢癌、胰腺癌等肿瘤中表达量下降或者消失,这为PDCD4基因在肿瘤中作为治疗靶点提供量依据,具有良好的应用前景〔10~12〕。在肾透明细胞癌中,PDCD4基因处于低表达水平,并且表达量远低于正常组织〔13〕。我们将PDCD4基因作为一种评估透明细胞癌发展和预后的生物学指标,通过分子生物学手段,利用过表达PDCD4基因的腺病毒转染肾癌细胞,有效地提高肾癌细胞PDCD4基因表达水平,降低细胞的癌症而化程度,启动癌细胞死亡的机制,从而达到抑制癌症恶化的作用。BTG1属于BTG/TOB家族,具有抗增殖活性,促进癌细胞的凋亡,因此,可以将BTG1蛋白作为一种癌细胞状态的指证〔14〕。研究表明,BTG1能够通过P53介导来调控细胞凋亡〔15〕。我们通过腺病毒来上调癌细胞的PDCD4基因表达,能够进一步提高BTG1蛋白的表达量,说明癌细胞正处在自我凋亡的状态。但PDCD4和BTG1之间的相互作用机制还不明确,需要我们进一步研究。
4参考文献
1Haas NB.Surveillance for Renal Cell Cancer Recurrence:which patients should undergo imaging,how often,and when〔J〕?J Clin Oncol,2015;33(35):4131-3.
2Shen XD,Zhang L,Che H,etal.Circulating levels of adipocytokine omentin-1 in patients with renal cell cancer〔J〕.Cytokine,2015;77(1):50-5.
3Cmarik JL,Colburn NH.Differentially expressed protein PDCD4 inhibits tumor promoter-induced neoplastic transformation〔J〕.Proceed Nat Acad Sci,1999;96(24):14037-42.
4Lin F,Qian C,Wang L,etal.Antitumor activities of an oncolytic adenovirus equipped with a double siRNA targeting Ki67 and hTERT in renal cancer cells〔J〕.Virus Res,2014;181(3):61-71.
5Yang JC,Haworth L,Sherry RM,etal.A randomized trial of bevacizumab,an antivascular endothelial growth factor antibody,for metastatic renal cancer〔J〕.N Engl J Med,2003;349(5):427-34.
6Hui SC,Jaworski J.Virus-based assay for antigen detection using infective growth as signal transduction mechanism〔J〕.Biosens Bioelectron,2015;77:131-6.
7Yin WY,Lee Mc,Lai NS,etal.BK virus as a potential oncovirus for bladder cancer in a renal transplant patient〔J〕.J Formos Med Assoc,2015;114(4):373-4.
8Mehta V,Chou PC,Picken MM.Adenovirus disease in six small bowel,kidney and heart transplant recipients;pathology and clinical outcome〔J〕.Virchows Arch,2015;467(5):603-8.
9Marshall E.Gene therapy death prompts review of adenovirus vector〔J〕.Science,1999;286(5448):2244-5.
10Dong B,Shi Z,Wang J,etal.IL-6 inhibits the targeted modulation of PDCD4 by miR-21 in prostate cancer〔J〕.PLoS One,2015;10(8):e0134366.
11Chen Z,Yuan YC,Wang Y,etal.Down-regulation of programmed cell death 4(PDCD4)is associated with aromatase inhibitor resistance and a poor prognosis in estrogen receptor-positive breast cancer〔J〕.Breast Cancer Res Treat,2015;152(1):29-39.
12Lu YY,Zheng JY,Liu J,etal.miR-183 induces cell proliferation,migration,and invasion by regulating PDCD4 expression in the SW1990 pancreatic cancer cell line〔J〕.Biomed Pharmacother,2015;70(1):151-7.
13Bera A,Das F,Ghosh-Choudhury N,etal.microRNA-21-induced dissociation of PDCD4 from rictor contributes to Akt-IKKβ-mTORC1 axis to regulate renal cancer cell invasion〔J〕.Exper Cell Res,2014;328(1):99-117.
14Zheng HC,Li J,Shen DF,etal.BTG1 expression correlates with pathogenesis,aggressive behaviors and prognosis of gastric cancer:a potential target for gene therapy〔J〕.Oncotarget,2015;6(23):19685-705.
15Rouault J,Prevot D,Berthet C,etal.Interaction of BTG1 and p53-regulated BTG2 gene products with mCaf1,the murine homolog of a component of the yeast CCR4 transcriptional regulatory complex〔J〕.J Biol Chem,1998;273(35):22563-9.
〔2015-10-26修回〕
(编辑李相军)
〔中图分类号〕R73
〔文献标识码〕A
〔文章编号〕1005-9202(2016)05-1048-03;
doi:10.3969/j.issn.1005-9202.2016.05.011
基金项目:金华市科学技术局资助课题(No.2013-3-057)
第一作者:徐挺(1980-),男,硕士,主治医师,主要从事泌尿系肿瘤研究。
