舒张性心力衰竭患者血清T3与LVEDP相关性及对预后的影响
2016-04-13刘畅鞠晨晖高传玉王宪沛麻兴华
刘畅 鞠晨晖 高传玉 王宪沛 麻兴华
450052郑州大学人民医院心内科
舒张性心力衰竭患者血清T3与LVEDP相关性及对预后的影响
刘畅鞠晨晖高传玉王宪沛麻兴华
450052郑州大学人民医院心内科
【摘要】目的探讨舒张性心力衰竭患者血清三碘甲状腺原氨酸(T3)水平与左室舒张末期压力(LVEDP)相关性及对2年预后的影响。方法连续入选2012年5月至2013年5月期间舒张性心力衰竭患者76例,行左室导管检查测LVEDP评估左心室舒张功能,根据T3水平的中位数分为高T3组(fT3≥4.32 pmol/L,39例)和低T3组(fT3<4.32 pmol/L,37例),比较两组间一般临床特征,分析T3与LVEDP的相关性,并随访记录2年的患者主要终点事件:各种原因导致的死亡及心力衰竭再住院率。结果舒张性心力衰竭患者T3低于正常值者为15%(11/76)。与高T3组相比,低T3组患者年龄较大,血脂较高,LVEDP水平偏高,且T3与LVEDP呈线性负相关,随访2年,与高T3组相比,低T3组患者2年死亡率显著升高[21.6%(8/37)比5.1%(2/39),P=0.043]。结论低T3舒张性心力衰竭患者心脏舒张功能差,且预后差。
【关键词】心力衰竭;甲状腺疾病;左室舒张末期压力
Fund program:National Science Foundation for Distinguished Young Scholars of China (U1204801)
舒张性心力衰竭(diastolic heart failure, DHF)是以左心室主动松弛能力和心肌顺应性降低,心肌细胞僵硬度增加而发生的心力衰竭,有较高的患病率,占所有心力衰竭患者的50%以上,现仍缺乏有效的治疗手段[1]。左室舒张末期压力(left ventricular end diastolic pressure,LVEDP)是反应心室舒张功能的重要指标,在舒张性心力衰竭的诊断中起到重要作用[2]。甲状腺激素,尤其是三碘甲腺原氨酸(T3),通过促进心肌松弛和降低外周血管阻力等作用在心血管系统中起到重要保护作用[3]。收缩性心力衰竭患者T3降低,且与预后密切相关[4],然而T3水平与舒张性心力衰竭严重程度及预后的关系国内外报道较少。本研究旨在探讨舒张性心力衰竭患者T3与LVEDP水平及患者预后的关系,为舒张性心力衰竭患者早期治疗提供依据。
1对象和方法
1.1研究对象选择2012年5月至2013年5月期间本院心内科住院的DHF患者76例,其中男32例,女44例,年龄38~88岁,平均(66±13)岁。纳入标准:符合2007年ESC关于DHF的诊断标准,即①有呼吸困难、肺水肿、肝大、踝关节水肿等充血性心力衰竭的临床症状和体征;②正常或轻度异常的左心室收缩功能,心脏超声显示左心室射血分数大于50%且左心室舒张末期容积指数小于97 ml/m2;③有心室舒张功能障碍的证据[2],左室舒张末期压力>16 mmHg。遵循程序符合伦理委员会批准,且患者经告知同意接受病史采集,签署知情同意书。排除标准:血流动力学障碍的严重瓣膜疾病;曾有过严重的心脏收缩功能不全,LVEF<40%;曾有下丘脑或垂体等其他内分泌性疾病,亚临床型甲减,亚临床甲亢及甲亢,正在服用影响甲状腺功能的药物,或存在其他严重全身性疾病[5]。
1.2方法
1.2.1分组入院第二天早晨空腹抽取静脉血3 ml,快速离心使用西门子ADVIA centaur XP全自动免疫分析系统。为了提高检验功效,根据T3水平的中位数分为高T3组39例(fT3≥4.32 pmol/L)和低T3组37例(fT3<4.32 pmol/L)。检测指标正常值范围:游离三碘甲腺原氨酸(fT3)3.5~6.5 pmol/L。
1.2.2心导管检查入院第3至第5天心力衰竭症状控制后,左心室导管检测应用6F猪尾型导管,从桡动脉进入,头端位于左心室中部水平,运用BL-420S生物机能实验系统(泰盟科技有限公司)记录左室压力曲线,并根据左室压力曲线自动分析计算出LVEDP值。
1.2.3超声心动图入院第1天或第2天,由两名经验丰富的超声心动图医生完成心脏舒张功能相关超声指标的检查。患者左侧卧位,使用美国GE公司Vivid7型彩色超声心动图仪,探头频率为1.7~3.4 MHz探头频率检查,测定E峰峰值流速(VpE)、A峰峰值流速(VpA)、E/A、E峰减速时间(EDT)、等容舒张时间(IVRT)、左心室舒张末期容积指数(LVEDI)等。
1.3随访
随访从确诊为舒张性心力衰竭开始,通过住院病历,门诊或电话随访,所有患者出院后随访2年,记录患者主要终点事件:各种原因导致的死亡,心力衰竭再住院率,随访资料齐全。
1.4统计学方法
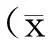
2结果
2.1三组基线临床特征比较
入选患者T3低于正常值者有15%(11例),平均年龄(66±13)岁,包括女性(58%)与舒张性心力衰竭患者流行病学研究结果一致[6]。低T3组较高T3组年龄、 E峰值、LVEDP值较高,差异有统计学意义(均为P<0.05)。与高T3组相比,低T3组糖尿病患者较多,NYHA分级Ⅲ~Ⅳ较多,差异有统计学意义(均为P<0.05)。其余指标差异无统计学意义(均为P>0.05)(表1)。
2.2血浆T3水平与LVEDP的关系
在舒张心力衰竭患者中,fT3与LVEDP呈线性负相关(图1),运用多重线性回归分析矫正年龄、NYHA分级、糖尿病等混杂因素后,LVEDP与T3仍相关,LVEDP每升高10 mmHg,患者血清fT3水平下降0.59 pmol/L(95%CI:0.45~0.73,R2=0.168,P=0.012)。
2.3两组2年预后比较
低T3组2年生存率为78.4%,较高T3组94.9%低,Kaplan-Meier生存曲线所示(图2),舒张性心力衰竭患者高T3组2年生存率较低T3组高(P=0.043)。低T3组2年再住院率为81.1%,高T3组56.4%(P=0.021)。
2.4两组生存率及危险因素分析
随访期间,舒张性心力衰竭患者2年生存率为13.2%,运用COX逐步回归分析2年的生存率的危险因素,结果显示fT3、年龄、LVEF及糖尿病均是舒张性心力衰竭患者终点事件的相关影响因素,且比较发现FT3的影响最大(表2)。

表1 临床一般资料比较
注:正态分布的连续性数值变量数据用平均值±标准差表示,分类变量数据用频数(百分比)表示;BMI:体脂指数;NYHA分级:纽约心功能分级;LVEF:左心室射血分数;LVEDP:左心室舒张末期压;E峰减速时间(EDT)、等容舒张时间(IVRT)、左心室舒张末期容积指数(LVEDI)

表2 多自变量分析舒张性心力衰竭患者

图1 舒张性心力衰竭患者血浆T3与LVEDP关系的散点图

图2 高T3组和低T3组患者的2年生存率曲线
3讨论
本研究连续收集76例舒张性心力衰竭患者中,T3低于正常值底限患者的比例是15%,与舒张性心力衰竭患者流行病学调查一致[6]。我们的研究发现,LVEDP以及一些临床和超声指标在舒张性心力衰竭中与T3相关。年龄、NYHA功能分级、糖尿病、超声指标E峰与低T3水平的关系在本研究中得到证实[4,7]。本研究首次发现舒张性心力衰竭患者中LVEDP水平与血清T3水平呈负相关。LVEDP升高患者心脏舒张功能较差,心室壁张力及压力较大,能量消耗增加,相对应的T3水平较低,这与已知的T3降低全身血管阻力,增加动脉顺应性,低T3患者血管阻力增高加重心脏舒张负荷相一致。心力衰竭中T3降低的机制包括上调可转换T3至无活性结构的Ⅲ型脱碘酶和增加促炎症因子,甚至当T3水平在正常范围内偏低时,T3可被一些受体蛋白的上调影响,如增加的FOG-2下调肌浆网中可降低心室肌舒张能力的甲状腺激素依赖的钙泵SERCA2[8-9]。 而低T3加剧心力衰竭恶化的可能机制包括心室的结构重塑,例如低T3减少SERCA2的表达,导致分子水平上的表型和结构改变从而损害心脏舒张能力。这些病理生理学过程可能解释舒张性心力衰竭严重程度与低T3的相关性。
在长期随访中发现,低T3组舒张性心力衰竭患者2年死亡率和再住院率较高T3组高,低FT3水平是舒张性心力衰竭患者死亡的独立危险因素。Pingitore等[4]研究了281例收缩性心力衰竭患者,发现低T3水平是患者死亡率的独立预测因子,增加了传统的临床预后信息及心脏功能参数。Iervasi等[10]对573例心脏病患者进行研究,发现低T3水平是心脏病死亡率的预测因子,本研究首次在舒张性心力衰竭患者中证实低T3对预后有良好的预测价值。
目前运用甲状腺素治疗伴低T3的心力衰竭患者仍在实验阶段。在心肌梗死诱发心力衰竭的小鼠模型中,T3替代治疗有改善心室舒张功能的趋势。Rouf等[8]证明收缩性心力衰竭的住院患者T3治疗可使心输出量增加且减少全身血管阻力。Pingitore等[11]证明扩张性心肌病患者短时间的T3替代治疗可提高左室搏出量,甚至减轻心力衰竭症状。然而这些研究样本量少,缺乏随机性且治疗时间较短,有很大局限性。而我们的研究也支持了低T3会损害心力衰竭患者的心脏功能,特别是舒张性心力衰竭患者。
参考文献
[1] Fonarow GC, Stough WG, Abraham WT,et al. Characteristics, treatments, and outcomes of patients with preserved systolic function hospitalized for heart failure: a report from the OPTIMIZE-HF Registry[J]. J Am Coll Cardiol,2007,50(8):768-777. DOI:10.1016/j.jacc.2007.04.064.
[2] Paulus WJ, Tschope C, Sanderson JE, et al. How to diagnose diastolic heart failure: a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology[J]. Europ Heart J,2007,28(20):2539-2550. DOI:10.1093/eurheartj/ehm037.
[3] Silva-Tinoco R, Castillo-Martinez L, Orea-Tejeda A, et al. Developing thyroid disorders is associated with poor prognosis factors in patient with stable chronic heart failure[J]. Intern J Cardiol, 2011,147(2):e24-25. DOI:10.1016/j.ijcard.2009.01.012.
[4] Pingitore A, Landi P, Taddei MC,et al. Triiodothyronine levels for risk stratification of patients with chronic heart failure[J]. Am J Med, 2005,118(2):132-136. DOI:10.1016/j.amjmed.2004.07.052.
[5] Bhatia RS, Tu JV, Lee DS, et al.Outcome of heart failure with preserved ejection fraction in a population-based study[J]. N Engl J Med, 2006,355(3):260-269. DOI:10.1056/NEJMoa051530.
[6] Owan TE, Hodge DO, Herges RM, et al. Trends in prevalence and outcome of heart failure with preserved ejection fraction[J]. N Engl J Med, 2006,355(3):251-259. DOI: 10.1056/NEJMoa052256.
[7] Ascheim DD, Hryniewicz K. Thyroid hormone metabolism in patients with congestive heart failure: the low triiodothyronine state[J]. Thyroid, 2002,12(6):511-515. DOI: 10.1089/105072502760143908.
[8] Rouf R, Greytak S, Wooten EC,et al. Increased FOG-2 in failing myocardium disrupts thyroid hormone-dependent SERCA2 gene transcription[J]. Circ Res, 2008,103(5):493-501. DOI: 10.1161/CIRCRESAHA.108.181487.
[9] 杨泉, 王瑞芳, 何昆仑, 等. 舒张性心力衰竭大鼠循环及组织交感活性与肾胺酶的相关性研究[J]. 中国心血管杂志, 2014, 19(5): 372-375.DOI:10.3969/j.issn.1007-5410.2014.05.020.
Yang Q, Wang RF, He KL, et al. Correlation between sympathetic activities and renalase in diastolic heart failure rats[J]. Chin J Cardiovasc Med, 2014, 19(5): 372-375. DOI:10.3969/j.issn.1007-5410.2014.05.020.
[10] Iervasi G, Pingitore A, Landi P, et al. Low-T3 syndrome: a strong prognostic predictor of death in patients with heart disease[J]. Circulation,2003,107(5):708-713. DOI: 10.1161/01.cir.0000048124.64204.3f.
[11] Pingitore A, Galli E, Barison A, et al. Acute effects of triiodothyronine (T3) replacement therapy in patients with chronic heart failure and low-T3 syndrome: a randomized, placebo-controlled study[J]. J Clin Endocrinol Metab, 2008,93(4):1351-1358. DOI: 10.1210/jc.2007-2210.
(本文编辑:周白瑜)
Association of serum triiodothyronine with left ventricular end diastolic pressure in diastolic heart failure patients and its prognosisLiuChang,JuChenhui,GaoChuanyu,WangXianpei,MaXinghua
DepartmentofCardiology,ZhengzhouUniversityPeople′sHospital,Zhengzhou450052,China
【Abstract】ObjectiveTo analyze the relationship of serum free triiodothyronine (FT3) level with left ventricular end diastolic pressure (LVEDP) and its prognosis in patients with diastolic heart failure.MethodsFrom May 2012 to May 2013, 76 patients with diastolic heart failure who underwent left ventricular catherization were selected. The patients were divided into 2 groups based on the median levels of T3, high T3 group (T3≥4.32 pmol/L,39 patients) and low T3 group (T3<4.32 pmol/L,37 patients). We compare the clinical general characteristics, laboratory tests and ultrasonic auxiliary examination between the two groups, and analyze the correlation of T3 and LVEDP and its prognosis. The patients were followed up 2 years for endpoint events: death from all causes and heart failure readmission rates.ResultsT3 level lower than normal in diastolic heart failure patients was 15% (11/76). High T3 group were older and had higher cholesterol, LVEDP level, and T3 compared with that in low T3 group. T3 level was negatively correlated with LVEDP. Followed for 2 years, the mortality of low T3 group [21.6%(8/37)] was significantly increased compared with high T3 group [5.1%(2/39)], P=0.043.ConclusionsLow T3 level patients with diastolic heart failure have poor cardiac function and worse prognosis.
【Key words】Heart failure;Thyroid diseases;Left ventricular end diastolic pressure
(收稿日期:2015-06-15)
Corresponding author:Gao Chuanyu, Email:gaocy13@163.com
基金项目:国家自然科学青年基金(U1204801)
DOI:10.3969/j.issn.1007-5410.2016.01.009
通讯作者:高传玉,Email:gaocy13@163.com
·临床研究临床研究
