米诺环素对神经病理性疼痛大鼠脊髓神经胶质细胞GTs表达的影响①
2016-04-12曲诗言乔建民
曲诗言,乔建民
(佳木斯大学附属第一医院骨外科,黑龙江 佳木斯154003)
米诺环素对神经病理性疼痛大鼠脊髓神经胶质细胞GTs表达的影响①
曲诗言,乔建民
(佳木斯大学附属第一医院骨外科,黑龙江 佳木斯154003)
摘要:目的:观察米诺环素对神经病理性大鼠脊髓神经胶质细胞的水平谷氨酸转运蛋白(GTs)表达的影响, 探讨神经病理性疼痛中的作用机制和治疗方法。方法:将40只成年雄性SD大鼠,采用坐骨神经结扎术建立神经病理性疼痛模型。根据手术类型及注射药物,随机分成4组:A组,假手术组 (n=10);B组,手术组(n=10);C组,生理盐水+手术组(n=10);D组,米诺环素+手术组(n=10)。在术后,第 1、3、7、11天观察热缩足反射潜伏期(TWL)、测定大鼠机械缩足阈值(MWT)的变化,应用Western Blot方法检测检测大鼠脊髓神经胶质细胞GTs表达。结果:手术组(BCD组)大鼠较假手术组(A组),热缩足反射潜伏期明显缩短,且大鼠50%机械缩足阈值明显降低。鞘内注射米诺环素组(D组)大鼠与对照组(BC组)比较,其热缩足反射潜伏期明显延长,且大鼠50%机械缩足阈值明显升高,并且脊髓神经胶质细胞GTs的表达明显高于BC组。结论:米诺环素能够通过维持大鼠脊髓神经胶质细胞谷氨酸转运蛋白(GTs)表达的影响,从而缓解神经病理性疼痛。
关键词:米诺环素; 谷氨酸转运蛋白;神经病理性疼痛;大鼠
随着社会发展和人们生活水平提高 ,神经病理性疼痛的诊治需求逐渐增加。但是现在很多的治疗药物和方法欠佳, 探究其发病机制和诊疗方案具有很重要的意义。神经病理性疼痛( neuropathicpain,NPP) 是由于外周或中枢神经系统受到损伤或产生病变而导致的疼痛[1]。 NPP的主要特征包括痛过敏( hyperalgesia) 痛过度( hyperpathia) 及异常痛( allodynia),由于其病因多样,发病机制至今尚未彻底阐明,已经成为临床医疗最具挑战的难题之一。谷氨酸转运蛋白(glutamate transporters,GTS)在决定神经元的激活和影响神经元兴奋性方面发挥着重要作用[2]。位于神经胶质细胞和神经元质膜的GTs迅速从细胞外间隙摄取突触释放的谷氨酸,维持细胞外谷氨酸浓度的平衡。米诺环素的镇痛作用与其抑制脊髓背角神经胶质细胞的活化和促炎性细胞因子的表达相关。本研究旨在探究米诺环素对于脊髓神经胶质细胞GTs的表达的影响,进一步揭示病理性疼痛产生的机制。
1材料与方法
1.1动物分组
成年雄性SD大鼠40只, 体重200~250g, 由佳木斯大学医学院动物实验中心提供。根据手术类型及注射药物,随机分成4组:A组,假手术组 (n=10);B组,手术组(n=10);C组,生理盐水+手术组(n=10);D组,米诺环素+手术组(n=10)。
1.2模型制备
将SD大鼠称重后,常规行鞘内注射麻醉,药物剂量10%水合氯醛(300mg/kg 体重),将大鼠放置为侧卧位。消毒铺巾,严格无菌操作。切开左下肢股部皮肤,将肌肉组织钝性分离,轻柔暴露坐骨神经,在其主干部位处用羊肠线松扎四道,但不影响神经外膜的血运。逐层缝合切口,对侧下肢肌注庆大霉素(0.2mL,10mg/mL)预防感染[3]。A 组假手术组,分离暴露坐骨神经干,不结扎。所有手术操作均由同一人完成。D组大鼠于建模前1d开始鞘内注射米诺环素(Sigma)50μg(溶于20μL生理盐水中),之后每天1次,连续注射7d,C组大鼠在相同时点鞘内注射生理盐水。A组和B组大鼠鞘内不予任何药物。
1.3测试动物行为学
1.3.1热痛潜伏期(Thermal withdrawal latency,TWL)测定[4]。将大鼠在放置操作台5min,后进行光照射,每个大鼠下肢照射3次,记录照射至出现缩足反应时间,取其平均值。
1.3.2机械缩足阈值(mechanical withdrawal threshold,MWT)测定。将大鼠用不同压力的von Frey纤维丝(Stoeling公司,美国)垂直刺激其足底2、3跖趾间皮肤敏感处4~5s。每次间隔5秒,连续10次,诱发4~6次缩足反应作为50%反应率。
1.4大鼠脊髓背角GTs蛋白含量检测
采用Western blot检测大鼠脊髓背角GTs蛋白含量。将动物断头处死,取出腰4和腰5脊髓节段,切取脊髓后角用于Western blot。将组织蛋白提取后,按常规方法进行SDS-PAGE电泳,恒流350mA,90min转膜。脱脂奶粉封闭后,加入抗大鼠的GTs(GLAST 和GLT-1)单克隆抗体,4℃过夜。辣根过氧化物酶(HPR)标记二抗(山羊抗鼠IgG),37℃孵育1h。采用ECL化学发光法检测蛋白表达量[5]。
1.5统计学方法
采用SPSS15.0进行统计分析, 计量资料组内比较用配对t检验, 组间比较采用单因素方差分析, 以P<0.05作为检验水准。
2结果
2.1神经病理性疼痛模型建立成功
坐骨神经结扎术后,手术组(BCD组)大鼠较假手术组(A组),热缩足反射潜伏期明显缩短,且大鼠50%缩足阈值明显降低。见图1。
2.2米诺环素对神经病理性疼痛的作用
D组大鼠鞘内注射米诺环素,术后与BC组比较,其热缩足反射潜伏期明显延长,且大鼠50%缩足阈值明显升高。鞘内注射米诺环素可以缓解神经病理性疼痛。见图1。
2.3米诺环素对病理性疼痛大鼠脊髓神经胶质细胞GTs表达的影响
经过Western Blot检测,D组大鼠脊髓神经胶质细胞GTs的表达明显高于BC组,略低于A组。见图2。
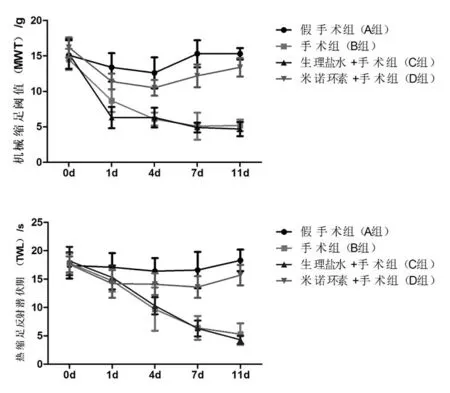
图1大鼠热敏、机械缩足反射阈值的变化

图2 大鼠脊髓神经胶质细胞GTs的表达水平
*P<0.05vsA组#P<0.05vsC组
3讨论
随着社会发展和人们生活水平提高,诊治神经病理性疼痛的患者及要求增多。然而,目前大部分的治疗药物和方法效果欠佳,或副作用明显。因此探究神经病理性疼痛的发病机制和诊疗方案具有很重要的意义。神经病理性疼痛( neuropathicpain,NPP)包括痛过敏( hyperalgesia) 痛过度( hyperpathia) 及异常痛( allodynia)[1],其发生主要的发生原因是外周或中枢神经系统受到损伤或产生病变而导致的疼痛。神经病理性疼痛病因复杂多样,发病机制未阐述清楚,亟待临床工作者关注与解决。谷氨酸转运蛋白(glutamate transporters,GTS)在决定神经元的激活和影响神经元兴奋性方面发挥着重要作用[2]。位于神经胶质细胞和神经元质膜的GTs迅速从细胞外间隙摄取突触释放的谷氨酸,维持细胞外谷氨酸浓度的平衡。米诺环素的镇痛作用与其抑制脊髓背角神经胶质细胞的活化和促进细胞的炎性因子的表达相关。神经病理性疼痛的模型构建主要通过坐骨神经结扎术。有研究表明,坐骨神经部分结扎(pSNL)的小鼠的脊髓神经胶质细胞GTs摄取谷氨酸不足,导致突触外的谷氨酸溢出和突触外NMDA受体激活,这是引起pSNL所致神经病理性疼痛大鼠NMDA受体激活增强的关键[3]。已经克隆出 5 种高亲和力GTs,包括 EAAT1(GLAST)、EAAT2(glial glutamate transpor-1,GLT-1)、EAAT3(EAAC1)、EAAT4、EAAT5[6,7]。其中 GLAST和 GLT-1 主要表达于神经胶质细胞。米诺环素是半合成的四环素抗生素,能够穿透血脑屏障进入中枢系统[8],此外,有研究表明,米诺环素能够有效的抑制小胶质细胞细胞活性[9]。有研究表明,米诺环素能够缓解神经病理性疼痛[10]。国内外众多实验研究证实, 米诺环素通过直接阻断小胶质细胞的增殖和激活作用从而减少其神经毒性作用[11]。本研究旨在探讨,米诺环素是否能够对谷氨酸转运蛋白(GTs)的表达产生作用,从而缓解神经病理性疼痛。本研究中,采用坐骨神经结扎术,成功建立神经病理性疼痛模型。手术组(BCD组)术后第一天,即出现50%缩足阈值较术前基础值有明显下降,同时热缩足反射潜伏期也明显缩短。可以证明,坐骨神经结扎术成功构建大鼠的神经病理性疼痛模型。且疼痛表现能够稳定持续至实验结束。此外,鞘内注射米诺环素组的大鼠(D组),术后与鞘内注射生理盐水和空白的对照组(BC组)比较,其热缩足反射潜伏期明显延长,且大鼠50%缩足阈值明显升高。由此可见,鞘内注射米诺环素可以缓解神经病理性疼痛。这与国内外众多学者的实验结论是一致的。本研究通过Western Blot方法检测各组大鼠脊髓神经胶质细胞中GTs的含量。结果发现,各手术组(BCD组)GLAST,GLT-1的表达量均明显低于假手术组(A组)。而鞘内注射米诺环素组(D组)的大鼠的GTs的表达,又明显高于生理盐水(BC组)对照组。据此,我们推测,米诺环素通过通过维持脊髓神经胶质细胞GTs的表达与防止GTs摄取突触间隙谷氨酸不足而产生缓解神经病理性疼痛的作用。米诺环素能够通过维持大鼠脊髓神经胶质细胞GTs表达的影响,从而缓解神经病理性疼痛。
参考文献:
[1]Schestatsky P,Vidor L,Winckler PB,et al.Promising treatments for neuropathic pain[J]. Arquivos de neuro-psiquiatria,2014, 72(11):881-888
[2]Yan X,Yadav R,Gao M,et al.Interleukin-1 beta enhances endocytosis of glial glutamate transporters in the spinal dorsal horn through activating protein kinase C[J]. Glia,2014, 62(7):1093-1109
[3]Nie H, Weng HR.Impaired glial glutamate uptake induces extrasynaptic glutamate spillover in the spinal sensory synapses of neuropathic rats[J]. Journal of neurophysiology,2010, 103(5):2570-2580
[4]李旭,申乐,许力.突触后致密物蛋白质95基因沉默及对神经病理性疼痛大鼠疼痛行为的干预[J]. 协和医学杂志,2011(04):343-349
[5]白兰,王迪迪,朱贵明.ER及E-Cad在子宫内膜癌组织中的表达及意义研究[J]. 黑龙江医药科学,2012,35(5):1-3
[6]张云龙,瞿少刚.高亲和力谷氨酸转运体结构和功能的研究进展[J].生物化学与生物物理进展,2014,(12):1214-1221
[7]Soni N,Reddy BV,Kumar P.GLT-1 transporter: an effective pharmacological target for various neurological disorders[J]. Pharmacology, biochemistry, and behavior, 2014, 127:70-81
[8]常刘, 解婷茹, 王日光.米诺环素对大鼠脊髓损伤早期TNF-α表达的影响[J]. 黑龙江医药科学,2014,37(1):20-22
[9]Vanelderen P, Van Zundert J, Kozicz T,et al.Effect of minocycline on lumbar radicular neuropathic pain: a randomized, placebo-controlled, double-blind clinical trial with amitriptyline as a comparator[J]. Anesthesiology,2015, 122(2):399-406
[10]吴利平, 王璐, 张永权.米诺环素治疗外周神经损伤所致神经病理性痛的时间窗[J]. 西安交通大学学报(医学版),2013,(04):465-469,482
[11]Zhang X, Wang J, Yu T,et al.Minocycline can delay the development of morphine tolerance, but cannot reverse existing tolerance in the maintenance period of neuropathic pain in rats[J]. Clinical and experimental pharmacology & physiology,2015, 42(1):94-101
The effect of minocycline on GTs expression in spinal cord of rats with neuropathic pain
QUShi-yan,QIAOJian-min
(The First Affiliated Hospital of Jiamusi University,Jiamusi 154003,China)
Abstract:Objective: To analyze the effects of minocycline on glutamate transporters (GTs) expression in spinal cord of rats during neuropathic pain; and to study the mechanism of neuropathic pain.Methods: Forty adult male Sprague-Dawley (SD) rats were randomly divided into 4 groups (n =10 each): Group A , Sham operation group;Group B, operation group; Group C physiological saline and operation group; group D, minocycline and operation group. Thermal withdrawal latency (TWL) and mechanical withdrawal threshold(MWT)were measured on 1st,3rd,7th and 11th days. GTs expression in the dorsal horn was detected by Western blotting.Results: Mechanical tenderness was occurred in Group B, C and D on he 7th day after operation, and then persisted to the end of the experiment. TWL and MWT were decreased significantly in Group B,C,D than those in group A. Compared with Group B and C,Group A was increasing significantly in TWL and MWT.The expression of GTs was higher in Group D than that in group B and C.Conclusion: Minocycline can prevent the development of neuropathic pain, and up-regulate GTs during the development of neuropathic pain.
Key words:minocycline; glutamate transporters; neuropathic pain rat
(收稿日期:2015-03-19)
中图分类号:R441.1
文献标识码:A
文章编号:1008-0104(2016)01-0089-02
作者简介:曲诗言(1986~)男,黑龙江佳木斯人,在读硕士研究生。通讯作者:乔建民(1960~)男,黑龙江佳木斯人,学士,主任医师,教授,硕士研究生导师。E-mail:qushiyan1986@163.com。
