重组人转化生长因子β1在CHO/dhfr-细胞中的稳定表达和纯化
2016-04-12刘春凤王世媛陈清西
刘春凤,张 宁,周 婷,王世媛,陈清西*
( 1.厦门大学生命科学学院,福建厦门361005; 2.厦门特宝生物工程股份有限公司,福建厦门361022)
重组人转化生长因子β1在CHO/dhfr-细胞中的稳定表达和纯化
刘春凤1,张宁2,周婷2,王世媛2,陈清西1*
( 1.厦门大学生命科学学院,福建厦门361005; 2.厦门特宝生物工程股份有限公司,福建厦门361022)
摘要:构建了含重组人转化生长因子β1( rhTGF-β1)基因的真核表达载体,并利用阳离子脂质体介导的方法,将构建的表达载体转染到二氢叶酸还原酶( DHFR)缺陷型哺乳动物细胞CHO/dhfr(-)中,通过氨甲喋呤( MTX)加压筛选获得稳定表达重组人转化生长因子β1的细胞株.于14 L细胞发酵罐进行扩大培养,通过酶联免疫吸附实验( ELISA)检测得表达量在3 mg/L左右.采用亲和层析、反相层析及分子筛凝胶层析的方法分离纯化,获得的rhTGF-β1试制品的纯度大于97%,得率在25%以上.通过基质辅助激光解析电离化飞行时间质谱( MALDI-TOF MS)测定rhTGF-β1的分子量为25.470 ku,与理论分子量一致.N端蛋白序列分析仪分析其N端氨基酸序列,与理论的氨基酸序列一致.rhTGF-β1具有抑制水貂肺上皮细胞Mv-1-Lu增殖的活性,测定其比活为3.2×107IU/mg,与商品化的rhTGF-β1标准品相当.本研究为进一步规模化制备rhTGF-β1奠定了基础.
关键词:重组人转化生长因子β1;表达;纯化
转化生长因子β( transforming growth factor-β,TGF-β)是一类具有多种生物学活性的细胞因子,参与调节细胞的增殖、分化、发育和凋亡等多种生命活动[1].TGF-β亚家族目前报道有6种,分别为TGF-β1、TGF-β2、TGF-β3、TGF-β4、TGF-β5和TGF-β6,它们氨基酸序列之间有70%~80%的同源性[2].哺乳动物仅有3种,分别为TGF-β1、TGF-β2和TGF-β3,其中TGF-β1在体细胞系中所占比例最高(>90%),活性最强.在人体的多项实验表明,TGF-β1能够有效抑制多类细胞的增殖,参与了肿瘤发生发展、免疫反应、创伤修复以及细胞间质的形成等各种生理过程[3].
在大多数细胞中,未成熟的TGF-β1由390个氨基酸组成,在胞内蛋白内切酶的作用下,N端278个氨基酸形成前导肽或潜伏结合多肽( latency-associated peptide,LAP),C端112个氨基酸为成熟肽.前导肽通过2个半胱氨酸残基( Cys)链间二硫键形成二聚体;成熟肽具有9个高度保守的Cys,其中8个Cys相互靠近,形成链内二硫键,第9个Cys形成链间二硫键,构成具有生物学活性的二聚体;前导肽与成熟肽被切开后仍以非共价的形式结合,形成一种与受体不能结合的潜在复合物,需通过改变离子强度和pH进行分离,分离后的成熟肽才具有活性[4].
目前已有的TGF-β1表达系统不够完善,后续纯化也比较复杂,故我们在构建TGF-β1表达载体时,在目的蛋白N端引入鼠血清白蛋白分泌信号肽和His6标签,以利于TGF-β1的蛋白分泌及后续纯化.同时,将TGF-β1前导肽中的Cys33突变为丝氨酸残基( Ser)以避免影响目的蛋白活性亚基解离,终产品序列与天然蛋白完全一致.pOptiVec-Topo载体(购于Invitrogen公司)通过内部核糖体进入点( internal ribosome entry site,IRES)序列将目的基因和二氢叶酸还原酶( DHFR)基因连接形成双顺反子表达载体,IRES能够不依赖5'帽子结构而独立起始翻译,在转录时目的基因和DHFR基因形成同一条mRNA,以共同的效率和比例表达,排除只整合了DHFR基因的假阳性克隆;应用pOptiVec载体稳定转染时有利于阳性克隆筛选,有氨甲喋呤( MTX)抗性的细胞均为阳性细胞株[5].
本研究利用基因工程技术,将来源Invitrogen公司的pOptiVec-Topo真核表达载体通过T4连接酶形成闭环的自连载体,然后将TGF-β1基因插入到改造后的pOptiVec真核表达载体中,转染DHFR缺陷型哺乳动物细胞CHO/dhfr-,通过MTX梯度加压筛选,获得稳定表达TGF-β1的细胞株,在TGF-β1表达产物的分离纯化等技术环节进行工艺研究,并对终产品的质量进行了相关鉴定,意在为今后规模化生产TGF-β1奠定基础.
1材料和方法
1. 1材料
CHO/dhfr-细胞为ATCC公司产品;大肠杆菌DH5α由本实验室保存; T4 DNA连接酶、限制性内切酶BamHⅠ、NotⅠ和琼脂糖为Promega公司产品;质粒提取试剂盒、胶回收试剂盒为Omega公司产品; KODPlus Neo PCR酶为TOYOBO公司产品; lipofectamineTM2000、Opti-MEMⅠ培养基购于Invitrogen公司;次黄嘌呤、胸腺嘧啶核苷( hypoxanthine、thymidine,HT)和MTX为Sigma公司产品;杜尔伯科改良依格尔培养基( DMEM)、胰酶和磷酸盐缓冲液( PBS)为Hyclone公司产品;人TGF-β1铂酶联免疫吸附实验( ELISA)试剂盒购买于eBioscience公司;丙烯酰胺为Promega公司产品;螯合琼脂糖凝胶FF、SOURCE 15S和葡聚糖凝胶G-25粗填料为General Electric( GE)公司产品;重组人TGF-β1( rhTGF-β1)标准品为R&D公司产品,其余均为国产或进口分析纯试剂.
主要仪器: NBS型14 L细胞发酵罐,B.Braun Biotech公司; 311型CO2培养箱,Thermo公司;全温振荡器,型号HZQ-F,哈尔滨东明医疗器械厂;离心机,型号Avanti J-E,Beckman公司; P2B005A01超滤膜,Millipore公司;蛋白纯化仪,型号Basic 100,GE公司;基质辅助激光解析电离化飞行时间质谱( MALDI-TOF MS),型号REFLEXTMⅢ,Bruker公司; N端蛋白序列分析仪,岛津公司; SpectraMan M2e酶标仪,Molecular Devices( MD)公司.
1. 2 rhTGF-β1真核表达载体的构建
根据人TGF-β1的氨基酸序列( NM_000660),采用真核细胞喜好密码子,按照三联体密码原则编排出TGF-β1 cDNA序列.交由捷瑞基因公司合成TGF-β1全基因,插入pGH质粒中.根据标准DNA重组技术构建真核表达质粒,于37℃分别对TGF-β1基因扩增产物和改造后真核表达载体pOptiVec进行BamHⅠ、NotⅠ双酶切,纯化回收酶切产物,并在T4连接酶作用下4℃过夜使表达载体与目的片段连接,连接产物取10 μL转化DH5α感受态细胞,涂布于LB/Amp抗性平板,37℃培养过夜.挑取单菌落接种于5 mL LB/Amp抗性液体培养基,37℃,220 r/min培养过夜.使用质粒小提试剂盒提取质粒,BamHⅠ、NotⅠ双酶切鉴定,经双酶切初步筛选的阳性克隆进行核酸测序,测序验证无误的质粒用于稳定转染.
1. 3重组质粒DNA的大量制备及稳定转染CHO/dhfr-细胞株
将包含验证无误的质粒pOptiVec/TGF-β1的DH5α菌株接种到一定量的LB/Amp抗性液体培养基中,37℃220 r/min培养过夜.次日,采用无内毒素的质粒提取试剂盒制备得到质粒pOptiVec/TGF-β1,紫外分光光度仪测定所得质粒的浓度和纯度.获得的重组质粒用于稳定转染CHO/dhfr-细胞株.转染前24 h,将CHO/dhfr-细胞以2×106接种6孔板,转染当天确认细胞汇合度介于90%~95%.转染试剂采用阳离子脂质体lipofectamineTM2000,按照质粒:转染试剂=1∶3的比例取质粒和转染试剂先分别与Opti-MEMⅠ培养基混合,体积各100 μL.然后将两者混合,室温放置15 min,添加800 μL Opti-MEMⅠ培养基轻轻混匀,加入到细胞中,培养4 h后即可更换完全培养基( DMEM+ 10%(质量分数)胎牛血清白蛋白( FBS) +HT+10-6MTX培养基).
1. 4稳定表达rhTGF-β1细胞株的筛选
转染24 h后分板,按照每孔100个细胞铺96孔板20块,MTX初始加压浓度为100 nmol/L,后每轮浓度提高一定倍数.每步加压前均先亚克隆化,ELISA选择高表达亚克隆株进行下一步加压.加压过程中细胞采用6孔板或T25方瓶培养,加压时细胞按汇合度为20%~30%铺板,细胞长满后传代2~5次,待细胞适应该筛选压力、无细胞凋亡且增殖速度正常视为一轮加压完成,一般需2周左右.通过计算pg/cell/day( PCD)评价加压前后rhTGF-β1表达是否提高.加压前和加压后细胞均按1×105mL-1,2 mL接种于6孔板,培养2 d后取上清,采用ELISA检测rhTGF-β1表达量,计算rhTGF-β1的PCD值.PCD有提高的细胞株保种并继续下一轮MTX加压,共进行3轮.
1. 5 rhTGF-β1的纯化
转染有rhTGF-β1表达质粒的CHO/dhfr-细胞株使用14 L细胞固定床发酵罐发酵表达rhTGF-β1,采用无血清培养基培养,收集培养液上清,离心收集发酵上清.
1. 5. 1膜包超滤
取离心发酵上清,6 ku膜包超滤浓缩,400 mL超纯水置换4次,再用含50 mmol/L NaCl、50 mmol/L精氨酸、50 mmol/L Tris-HCl( pH 8.0)的缓冲液置换4次,收集超滤样品.
1. 5. 2 Ni柱捕获
选择螯合琼脂糖凝胶FF填料,将超滤后样品3∶1加入含100 mmol/L咪唑、50 mmol/L NaCl、50 mmol/L精氨酸、50 mmol/L Tris-HCl ( pH 8.0)的洗脱缓冲液混匀上样,再用300 mmol/L咪唑、50 mmol/L NaCl、50 mmol/L精氨酸、50 mmol/L Tris-HCl( pH 8.0)洗脱,收集目的样品.
1. 5. 3 G25柱脱盐
选择葡聚糖凝胶G-25粗填料,将Ni柱洗脱样品上样,用含1 mol/L NaCl,100 mmol/L甘氨酸( pH 4.0)的缓冲液置换,收集目的样品,以稀盐酸调节pH 至3.0,4℃保存过夜.
1. 5. 4反向柱纯化
选择SOURCE 15S填料,将G-25柱洗脱样品上样,以30%洗脱缓冲液平衡后,50%洗脱缓冲液洗脱,收集目的样品.上样缓冲液为100 mmol/L NaCl、2%乙腈,洗脱缓冲液为0.3%乙酸、70%乙腈.
1. 5. 5 G-25柱脱盐
选择葡聚糖凝胶G-25粗填料,将反相柱洗脱样品上样,用含150 mmol/L NaCl、100 mmol/L甘氨酸( pH 4.0)的缓冲液置换,收集目的样品,冻存于-70℃.
1. 6 rhTGF-β1的鉴定
1. 6. 1质谱法测定分子质量
采用MALDI-TOF MS测定rhTGF-β1分子质量,基质为α-氰基-4-羟基肉桂酸(α-cyano-4-hydroxy-cinnamic acid,HCCA,C10H7NO3,相对分子质量为189.17).
1. 6. 2氨基酸序列分析
采用Edman降解法测定rhTGF-β1的N端15个氨基酸序列,N端蛋白序列分析仪自动显示测序峰.
1. 6. 3生物学活性检测
将收集的培养液上清通过1.5小节所述的纯化手段获得高纯度的rhTGF-β1样品,水貂肺上皮细胞以2 ×105/mL铺板,体积100 μL,细胞稀释培养基与样品稀释培养基均为DMEM+1%FBS,rhTGF-β1标准品和样品均以50 ng/mL上板,2.5倍梯度稀释,共10个梯度.样品与细胞共培养48 h,加入3-( 4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐( MTT)溶液20 μL,37℃放置4 h,加入150 μL细胞裂解液吹打混合均匀,于酶标仪读取570 nm和630 nm吸光值.根据样品生物学活性=E×( C1/C)×( D1/D) (其中,E为标准品效价( IU/ mL),D1为样品预稀释倍数,D为标准品稀释倍数,C1为样品半效稀释度,C为标准品半效稀释度),计算rhTGF-β1的生物学活性.
2结果
2. 1重组质粒pOptiVec/TGF-β1的构建和鉴定
将pGH-TGF-β1质粒(本实验室构建)和改造型pOptiVec载体分别用BamHⅠ、NotⅠ进行双酶切,回收连接,获得重组质粒pOptiVec/TGF-β1,转化DH5α感受态细胞,挑取3个单克隆,扩大培养后通过BamHⅠ、NotⅠ双酶切鉴定,经鉴定均为阳性克隆(图2),证明TGF-β1片段已经成功插入到pOptiVec载体中.取2号质粒测序,结果与预期相符.
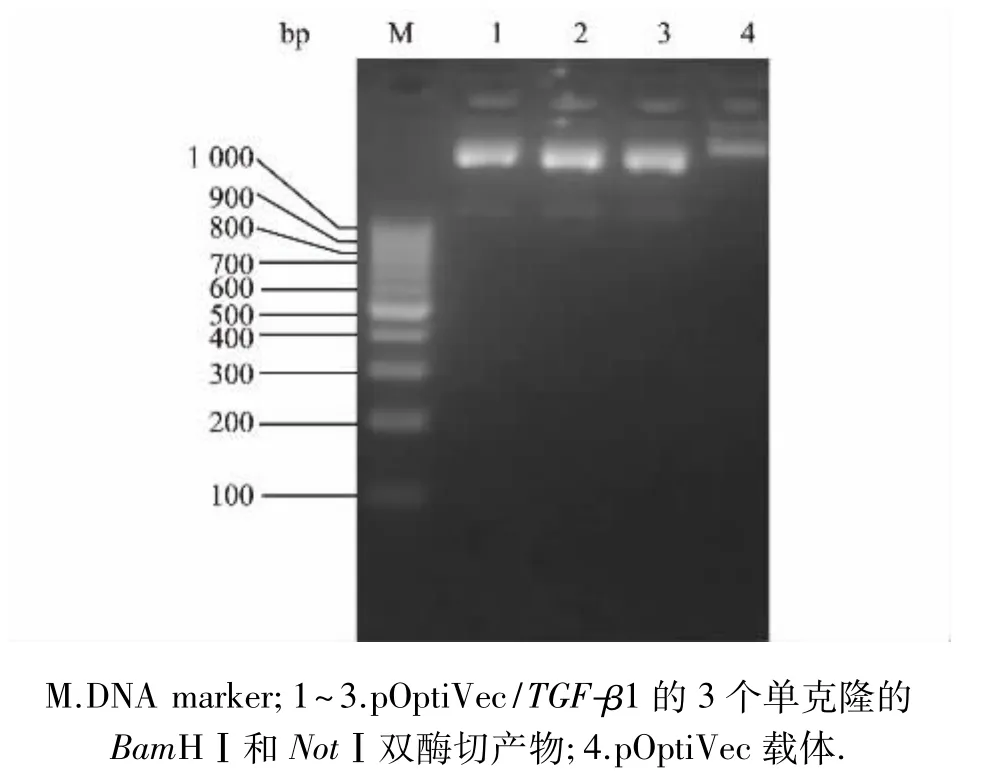
图2阳性克隆酶切鉴定电泳图谱Fig.2 Positive colony verification by restriction enzyme digestion
2. 2 rhTGF-β1稳定表达细胞株的获得
初期筛选均采用不含HT的DMEM+10%FBS培养基,37℃,5% CO2培养箱中静置培养2周左右开始,在显微镜下观察可以陆续看到明显的细胞克隆形成;同时,未转染rhTGF-β1表达质粒的CHO/dhfr-细胞由于缺乏次黄嘌呤( hypoxanthine)、胸腺嘧啶( thymidine)的外部供给已经全部死亡.共进行了3次MTX加压筛选,梯度依次为100,1 000和2 000 nmol/L.最后获得2株稳定表达TGF-β1的细胞株.
2. 3 rhTGF-β1的纯化及终产品的纯度
依据目的蛋白得率、纯度、工艺稳健性等指标确定rhTGF-β1纯化工艺路线.rhTGF-β1发酵上清经各步层析,目的峰均能与杂质峰有效分离,通过4步纯化,得率>25%.
经多步纯化获得的rhTGF-β1采用SDS-PAGE法测定样品电泳纯度.由于rhTGF-β1是同源二聚体,纯化样品分别用和不用二硫苏糖醇( DTT)还原处理,上样量5 μg( 100%),控制样品分别上样150 ng( 3%)、50 ng( 1%),电压100~200 V,银染,扫描分析电泳结果(图3).电泳分析显示,纯化后样品经DTT还原处理分子质量在14 ku左右(理论值为12.7 ku),应为单体的rhTGF-β1;纯化后样品未经DTT还原处理分子质量在30 ku偏下(理论值为25 ku),应为二聚体的rhTGF-β1.图中150 ng( 3%)的蛋白条带亮于目的样品的杂质带,说明rhTGF-β1的杂质含量<3%,即rhTGF-β1的电泳纯度>97%.

图3 rhTGF-β1纯化样品SDS-PAGE检测Fig.3 SDS-PAGE analysis of rhTGF-β1 purified sample
2. 4 rhTGF-β1的分子质量及N端氨基酸序列
采用测定MALDI-TOF MS测定rhTGF-β1分子质量为25.470 ku,与理论分子量一致,结果见图4.
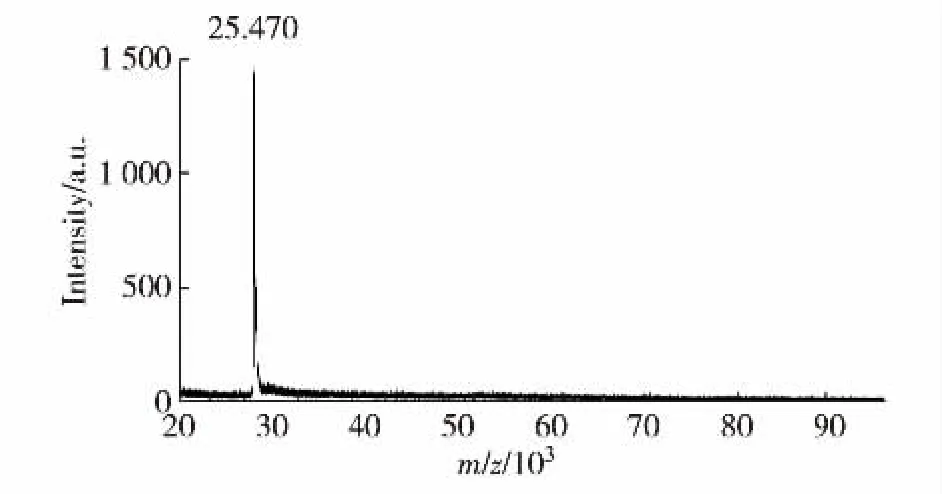
图4 rhTGF-β1纯化样品质谱检测Fig.4 Mass spectrum of rhTGF-β1 purified sample by MALDI-TOF MS
经N端氨基酸序列测定,rhTGF-β1样品N端15个氨基酸残基序列为ALDTNYXFSSTEKNX(因Cys不能直接观察到,用X表示),测序结果与理论的TGF-β1蛋白N端氨基酸序列一致.
2. 5 rhTGF-β1活性的检测
以R&D rhTGF-β1为标准品,采用MV-1-Lu细胞抑制法测定纯化获得的rhTGF-β1样品,四参数回归计算法处理检测数据,半数有效剂量( ED50)约为0.5 ng/mL,比活为3.2×107IU/mg,与R&D标准品活性相当(图5),说明通过CHO/dhfr-细胞表达的rhTGF-β1是有活性的.
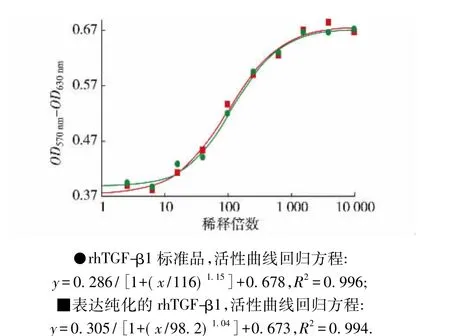
图5 rhTGF-β1活性测定曲线Fig.5 Curve of rhTGF-β1 activity test
3讨论
本研究中我们构建了pOptiVec/TGF-β1重组质粒.pOptiVec (改造)载体是采用T4连接酶将pOptiVec-Topo载体( Invitrogen公司)自连形成的.与常规使用的真核载体pSV2-dhfr载体比较,pSV2-dhfr载体目的基因和DHFR基因分别由不同的启动子起始转录,稳定转染筛选的克隆有可能只整合了DHFR基因造成假阳性;应用pOptiVec载体稳定转染时有利于阳性克隆筛选,有MTX抗性的细胞均为阳性细胞株.
另外,我们采用CHO/dhfr-细胞进行rhTGF-β1的表达,CHO/dhfr-细胞自身缺失DHFR[6],无法自身合成四氢叶酸,所以必须在添加了次黄嘌呤( hypoxanthine)、胸腺嘧啶( thymidine)和甘氨酸的培养液中才能得以存活.通过目的基因与DHFR基因共转染,不仅得到在不含上述添加剂的培养基上也能生长的细胞克隆,更为重要的是由于DHFR可被叶酸类似物MTX所抑制,在MTX浓度选择压力下,DHFR基因必须扩增到很多的拷贝数才能生存,从而得到抗MTX细胞系,又由于与DHFR基因共转染的目的基因倾向于同它一起整合到细胞染色体上的同一区域,所以编码外源重组蛋白的序列片段也随着DHFR基因的扩增而扩增,我们就得到了能大量表达外源蛋白的细胞克隆,将rhTGF-β1的表达量由常规的μg/L级别提高到mg/L.此外,本研究采用的纯化工艺[7]获得的纯化样品了纯度>97%,得率>25%,且经质谱、蛋白N端测序鉴定和活性检测,结果均符合TGF-β1质量标准.
参考文献:
[1]LAWRENCE D A.Latent-TGF-beta: an overview[J].Mol Cell Biochem,2001,219( 1/2) : 163-170.
[2]GOVINDEN R,BHOOLA K D.Genealogy expression,and cellular function of transforming growth factor-beta[J].Pharmacol Ther,2003,98( 2) : 257-265.
[3]ABOU-SHADY M,FRIESS H,ZIMMERHAMM A,et al.Connective tissue growthfactor in human liver cirrhosis[J].Liver,2007,20( 2) : 296-304.
[4]KHALIL N.TGF-beta: from latent to active[J].Microbes Infect,1999,1( 15) : 1255-1263.
[5]ZOU Z C,PETER D S.Overexpression of human transforming growth factor-β1 using a recombinant CHO cell expression system[J].Protein Expression and Purification,2004,37 ( 2) : 265-272.
[6]MADISEN L,LIOUBIN M N,MARQUARDT H,et al.Highlevel expression of TGF-beta 2 and the TGF-beta 2( 414) precursor in Chinese hamster ovary cells[J].Growth Factors,1990,3( 2) : 129-138.
[7]GRAYCAR J L,MILLER D A,ARRICK B A,et al.Human transforming growth factor-beta 3: recombinant expression,purification,and biological activities in comparison with transforming growth factors-beta 1 and-beta 2[J].Mol Endocrinol,1989,3( 12) : 1977-1986.
Expression,Purification and Bioactivity Assay of Recombinant Human Transforming Growth Factor-β1 in CHO/dhfr-Cell
LIU Chunfeng1,ZHANG Ning2,ZHOU Ting2,WANG Shiyuan2,CHEN Qingxi1
( 1.School of Life Science,Xiamen University,Xiamen 361005,China; 2.Xiamen Amoytop Biotechnique Company,Xiamen 361022,China)
Abstract:By CHO/dhfr(-)efficient expression,recombinant human transforming growth factor-β1 was conducted in a 14 L cell fermentation tank,and the expression quantity reached 3 mg/L.The purity of rhTGF-β1 was more than 97% with column chromatography method,and the yield was above 25%.Additionally,MALDI-TOF MS and N-terminal protein sequence analyzer were used to analyze its molecular weight and N-terminal sequence,and the activity was determined using MV-1-Lu( NBL-7) cell growth inhibition assay.The results showed that rhTGF-β1 activity was more than 3.2×107IU/mg.This study realized the efficient expression of rhTGF-β1 in CHO/dhfr(-),and the purified rhTGF-β1 sample by our methods were conformed to the standard of "China pharmacopoeia",which provided the basis for industrialized production of rhTGF-β1.
Key words:transforming growth factor-β1; expression; purification
*通信作者:chenqx@ xmu.edu.cn
基金项目:国家高技术研究发展计划( 863计划) ( 2007AA021604)
收稿日期:2015-01-09录用日期: 2015-02-14
doi:10.6043/j.issn.0438-0479.2016.01.012
中图分类号:Q 356.1
文献标志码:A
文章编号:0438-0479( 2016) 01-0067-05
引文格式:刘春凤,张宁,周婷,等.重组人转化生长因子β1在CHO/dhfr-细胞中的稳定表达和纯化[J].厦门大学学报(自然科学版),2016,55( 1) : 67-71.
Citation: LIU C F,ZHANG N,ZHOU T,et al.Expression,purification and bioactivity assay of recombinant human transforming growth factors-β1 in CHO/dhfr-cell[J].Journal of Xiamen University( Natural Science),2015,55( 1) : 67-71.( in Chinese)
