mTOR通路下游核心分子的mRNA表达水平与初发AML患者临床特征的关系
2016-04-12陈柯君程辉王健民杨建民吕书晴
陈柯君 程辉 王健民 杨建民 吕书晴
(第二军医大学附属长海医院血液科,上海 200433)
·论著·
mTOR通路下游核心分子的mRNA表达水平与初发AML患者临床特征的关系
陈柯君程辉王健民杨建民吕书晴
(第二军医大学附属长海医院血液科,上海200433)
摘要目的:探讨初发急性髓系白血病(acute myeloid leukemia, AML)患者骨髓单个核细胞中哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)、真核细胞翻译启始因子4E(eukaryotic translation initiation factor 4E, eIF-4E)及真核细胞翻译启始因子4E结合蛋白1(eIF4E binding protein 1, 4E-BP1)mRNA表达水平与临床特征的关系。方法: 采用荧光定量RT-PCR检测59例初发AML(AML组)和15名健康人(对照组)的骨髓单个核细胞中的4E-BP1、eIF-4E及mTOR mRNA表达水平,以正常人平均表达水平作为分组标准,结合AML患者的临床特征进行相关分析。结果: AML组中4E-BP1、eIF-4E和mTOR mRNA高表达者分别占50.9%、59.4%和45.8%。4E-BP1高表达组PLT数显著低于4E-BP1低表达组(P=0.044);eIF-4E高表达组骨髓原始细胞比例高于eIF-4E低表达组,但差异无统计学意义(P=0.068);mTOR高表达组骨髓原始细胞比例及髓外侵犯显著高于mTOR低表达组(P=0.040,P=0.029),mTOR高表达组贫血比例高于mTOR低表达组,但差异无统计学意义(P=0.082)。结论: mTOR通路下游核心分子的mRNA表达水平与初发AML患者骨髓原始细胞增殖、PLT数、贫血及髓外侵犯关系密切,相关检测有望为制定有效安全的化疗方案以及防治贫血、出血等化疗不良反应提供参考。
关键词急性白血病;哺乳动物雷帕霉素靶蛋白;临床特征
mRNA Expression of Core Molecules in the Downstream of mTOR Pathway and Its Relationship to Clinical Features in Primary Acute Myeloid Leukemia
CHENKejunChengHuiWANGJianminYANGJianminLÜShuqing
DepartmentofHematology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
AbstractObjective: To explore the relationship between the mRNA expression of mammalian target of rapamycin (mTOR), eukaryotic translation initiation factor 4E (eIF-4E) and eukaryotic translation initiation factor 4E binding protein 1 (4E-BP1) in bone marrow mononuclear cells of primary acute myeloid leukemia (AML) patients and clinical features of AML. Methods: The mRNA expression levels of 4E-BP1, eIF-4E and mTOR in bone marrow mononuclear cells were detected in 59 patients with primary AML and 15 normal human as a control group by reverse transcription-polymerase chain reaction (RT-PCR). Results: The percentages of mTOR, eIF-4E and 4E-BP1 mRNA high expression in 59 cases of AML were 50.9%, 59.4% and 45.8%, respectively.The platelet count in high 4E-BP1 mRNA expression group was significantly lower than that in low group (P=0.044). The percentage of bone marrow blast cells in high eIF-4E mRNA expression group was higher than that in low group, but there was no significant difference between the two groups (P=0.068). The percentage,and extramedullary invasion of bone marrow blast cells in high mTOR expression group was significantly higher than that in low group(P=0.040,P=0.029).The percentage of anemia in high mTOR expression group was higher than that in low group, but there was no significant difference between the two groups (P=0.082). Conclusions: Core protein mRNA in mTOR pathway downstream were closely relative to the proliferation of bone marrow blast cells, PLT count, anemia and extramedullary invasion in AML. They can help to choose effective and safe chemotherapy regimen, as well as to prevent side effects of chemotherapy such as anemia and bleeding.
Key WordsAcute leukemia;Mammalian target of rapamycin;Clinical features
急性髓系白血病(acute myeloid leukemia, AML)是造血干/祖细胞分化过程异常所致的造血系统恶性肿瘤[1]。探索与AML临床特征及预后相关的分子生物学指标一直是研究热点。常见的与AML预后良好相关的分子生物学异常类型有t(8;21) /AML1-ETO、inv(16) /CBFβ-MYH11、t(15;17) /PML-RARA等,而与AML预后不良相关的分子生物学改变有MLL重排等。但是,上述融合基因的阳性率较低,并不适用于每位患者的临床特征及预后的评估。研究发现,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)通路与细胞的生长、增殖和迁移等密切相关,且在前列腺癌、肺癌、血液系统肿瘤等恶性肿瘤中均有mTOR通路的异常活化[2-4]。
目前国内已有学者[5]检测了mTOR通路上游核心基因在AML患者骨髓单个核细胞中的mRNA表达水平,但尚无该通路下游基因表达水平的检测报道。本研究采用RT-PCR检测了59例初发AML患者mTOR通路下游核心基因的mRNA的表达水平,并分析了其与患者临床特征的相关性,旨在寻找新的分子生物学指标。
1资料与方法
1.1一般资料收集第二军医大学附属长海医院血液科2009年11月以来共59例初发AML患者(AML组)骨髓穿刺术后的骨髓标本及相应临床资料。59例中男性33例,女性26例;年龄<60岁50例,≥60岁9例;有发热表现者29例,无30例;有贫血者39例,无20例;有出血者41例,无18例;有髓外侵犯者15例,无44例;骨髓原始细胞比例<70% 26例,≥70% 33例;WBC数<50×109/L 45例,≥50×109/L 14例;PLT数<30×109/L 24例,≥30×109/L 35例;诱导方案为IDA方案24例,含DA的方案31例,含HA的方案3例,TA方案1例;45例完全缓解(CR),14例未缓解(NR);生存期(0.5个月~69.5个月)。收集15例健康志愿者骨髓穿刺术后的骨髓标本,其中男性9例,女性6例,年龄最小者28岁,最大者46岁。
1.2疗效评价参照《血液病诊断及评价标准》[6]进行评价。
1.3方法
1.3.1标本的收集与处理收集每位受检者的骨髓穿刺液2~3 mL,置于乙二胺四乙酸(EDTA)抗凝管,加入等量磷酸盐缓冲液(PBS)稀释。将3~4 mL人淋巴细胞分离液(Ficoll,上海易佰聚经贸有限公司)加入离心管,再将稀释后的骨髓液沿离心管内壁缓慢加到Ficoll液面上,1800 r/min离心15 min。待离心结束后,轻轻吸取白膜层即单个核细胞层,将其收集到另一离心管中,用PBS液稀释后离心(1500 r/min,6 min)洗涤2次,去上清液。依次加入细胞培养基1640、小牛血清及二甲基亚砜(6∶3∶1),须缓缓加入,边混匀边加。进行细胞计数后将其分装入冻存管,置入-80℃冰箱待测。
1.3.2RNA提取及cDNA合成复苏冻存标本,1500 r/min离心6 min,加入TRIzol试剂(美国Invitrogen 公司),提取总RNA。然后,加入300 μL三氯甲烷(国药集团化学试剂有限公司),充分振荡,室温静置5 min,13 000 r/min离心12 min;轻轻吸取上清液到无酶EP管中,加入等量预冷异丙醇(上海凌峰化学试剂有限公司),颠倒3~5次,室温静置5~10 min,13 000 r/min离心12 min;去上清液,加入75%无水乙醇(上海凌峰化学试剂有限公司),使RNA悬浮于液体中,13 000 r/min离心5 min;去上清液,待晾干后加DEPC水,溶解RNA;用紫外分光光度计[赛默飞世尔科技(中国)有限公司]测RNA的浓度及纯度,取光密度值OD260/OD280为1.8~2.1的标本进行后续实验。取500 ng总RNA,用cDNA试剂盒[宝生物工程(大连)有限公司]以10 μL反应体系进行反转录。反应体系如下:Buffer 2 μL,Random primer 0.5 μL,Oligo primer 0.5 μL,M-MLV 反转录酶0.5 μL,dNTP混合物1 μL,补超纯水至10 μL。反应条件为37℃ 15 min, 85℃ 5 s,产物置于-20℃备用。
1.3.3RT-PCR检测mRNA表达采用PrimeScriptTMRT试剂盒(大连宝生物工程有限公司)SYBR green法检测真核翻译起始因子4E(eukaryotic translation initiation factor 4E,eIF-4E)、eIF4E结合蛋白1(eIF4E binding protein 1,4E-BP1)及mTOR的mRNA表达水平,以甘油醛-3-磷酸脱氢酶(GADPH)作为内参基因。采用Primer 5.0软件设计引物。mTOR上游引物:CCAACAGTTCACCCTCAGGT ;下游引物:GCTGCCACTCTCCAAGTTT。4E-BP1上游引物:ATTTAAAGCACCAGCCATCG;下游引物:TGGAGGCACAAGGAGGTAT。eIF4E上游引物:TCTTTAGGAAGGCACGCAGT;下游引物:TTTAGGCCGGGTCAACTATG。GAPDH上游引物: ACCAGCCTCTGGCTTCTACA:下游引物:CCCTAGCTGTGTGCCTTCTC。反应体系如下:mix 7.5 μL,Forward primer 0.5 μL,Reverse primer 0.5 μL, cDNA 0.8 μL, H2O 5.7 μL。反应条件:95℃30 s; 95℃ 5 s, 60℃ 34 s, 40个循环;95℃ 30 s, 60℃ 30 s, 95℃ 15 s。建立PCR产物的熔解曲线。以GAPDH作为内参基因,按2-ΔΔCt法计算目的基因的相对表达量。
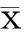
2结果
2.1AML组和对照组骨髓单个核细胞中mTOR通路下游基因的mRNA表达水平两组的单个核细胞中目的基因的mRNA表达水平见表1。根据对照组中各基因的平均表达水平,将AML组中患者相应地分为低表达和高表达组,见表2。
表1 两组的单个核细胞中目的基因的
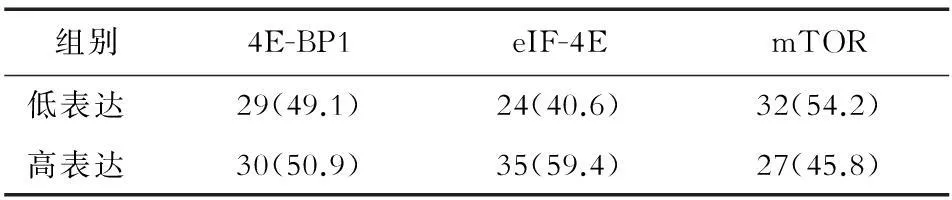
表2 AML患者目的基因mRNA的表达情况(n,%)
2.2mTOR通路下游基因mRNA表达水平与AML患者临床特征间的关系见表3。根据正常人目的基因mRNA表达水平,将AML患者分为低表达组和高表达组。如表3所示,3个目的基因高低表达组在基线指标如性别、年龄等方面无明显差异,而4E-BP1高表达组PLT数≥30×109/L的比例显著低于4E-BP1低表达组(46.6% vs 72.4%,P=0.044);eIF-4E高表达组骨髓原始细胞比例≥70%的比例高于eIF-4E低表达组(65.7% vs 41.6%,P=0.068);mTOR高表达组骨髓原始细胞比例≥70%的比例高于低表达组(70.3% vs 43.7%,P=0.040),mTOR高表达组髓外侵犯比例显著高于低表达组(40.7% vs 12.5%,P=0.029),mTOR高表达组贫血比例高于mTOR低表达组(77.7% vs 56.2%,P=0.082)。
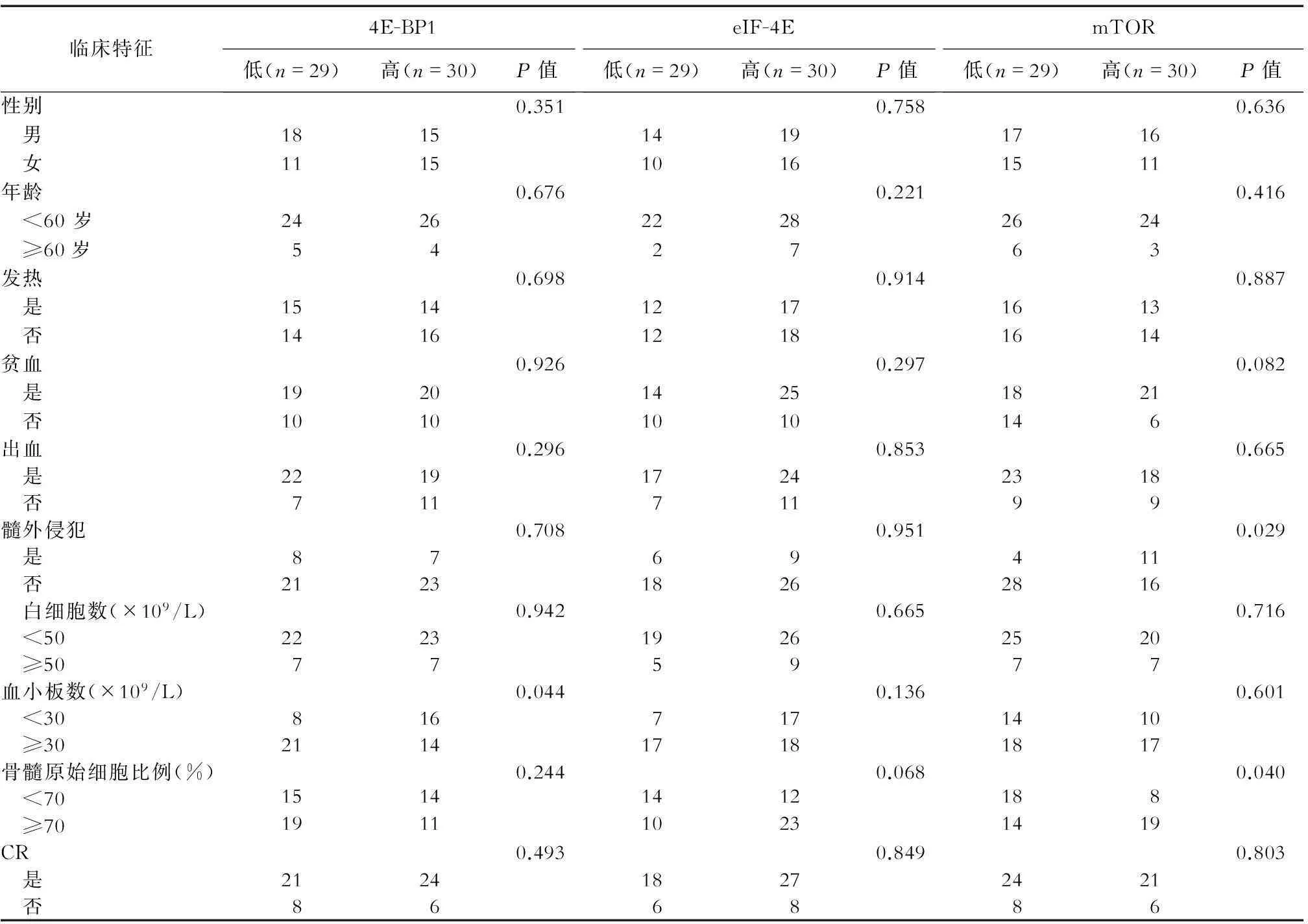
表3 4E-BP1、eIF-4E及mTOR的mRNA表达水平与AML患者临床特征的关系
2.3mTOR通路下游基因的mRNA表达水平与AML患者生存情况的关系AML患者骨髓单个核细胞中4E-BP1、eIF-4E、mTOR的mRNA表达水平与患者的生存无明显相关性。4E-BP1低表达、高表达患者的中位生存期分别为12.5个月、12.0个月,Log Rank=0.891,见图1A。eIF-4E低表达、高表达患者的中位生存期分别为13.5个月、12.0个月,Log Rank=0.520,见图1B。mTOR低表达、高表达患者的中位生存期分别为12.5个月、10.0个月,Log Rank=0.654,见图1C。
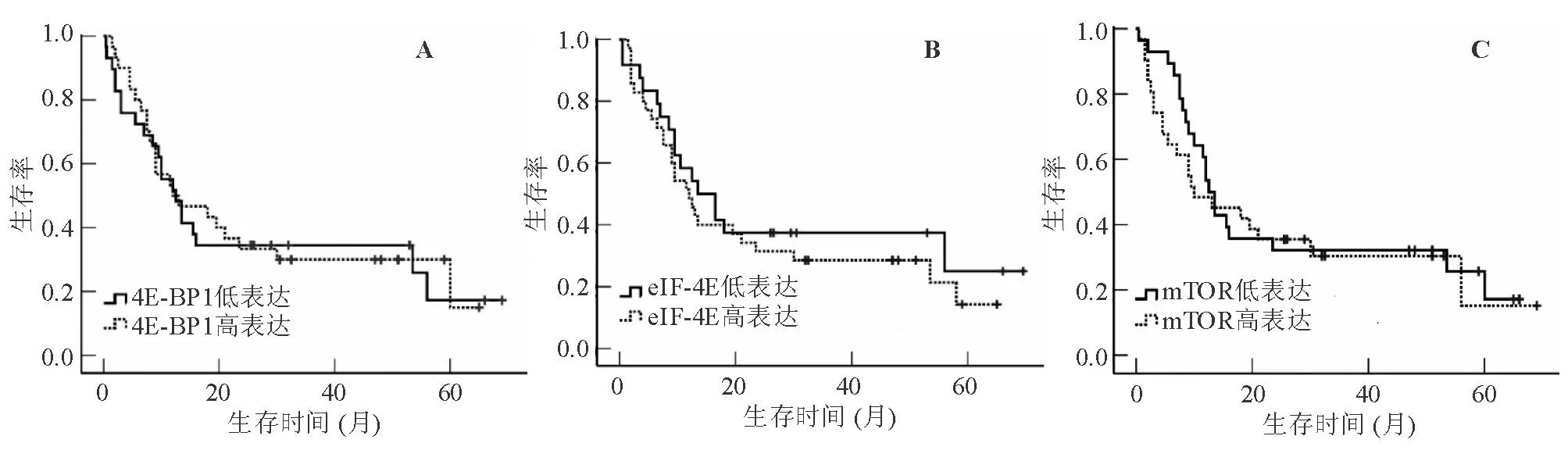
图1 4E-BP1、eIF-4E和mTOR高、低表达组的生存曲线图
3讨论
mTOR是一种丝/苏氨酸蛋白激酶。mTOR通路上游主要由磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)和蛋白激酶B(protein kinase B, PKB)组成,下游主要由4E-BP1和核糖体蛋白S6激酶(ribosomal protein S6 kinase, P70S6K)组成。通过整合胞外信号,4E-BP1发生磷酸化,使eIF4E-4E-BP1复合体解离,最终eIF-4E结合于mRNA的5′-cap端而促进蛋白翻译,从而在肿瘤细胞的生长、增殖、侵袭转移等方面发挥重要作用[7-8]。本研究的59例AML患者中,4E-BP1、eIF-4E及mTOR mRNA水平高表达者分别占50.9%、59.4%、45.8%。
本研究发现,在AML患者中,4E-BP1 mRNA的高表达与PLT数负相关。这可能是因为,4E-BP1高表达结合的eIF-4E增加,从而使蛋白翻译受抑,以此起到直接抑制巨核系增殖的作用。因此,AML患者化疗前,可根据血小板数,结合骨髓单个核细胞中4E-BP1 mRNA表达水平,综合评估患者出血风险,以降低病死率。此外,eIF-4EmRNA的高表达可能与骨髓原始细胞增殖正相关,但本研究中eIF-4E高表达组与低表达组的原始细胞比例无统计学意义(P=0.068),有待增加病例数进行进一步研究。eIF-4E低表达组和高表达组患者的中位生存期无显著差异。需要说明的是,eIF-4E低表达组中仅1例患者行异基因骨髓移植;而eIF-4E高表达组中有5例行异基因骨髓移植且目前仍存活,很可能移植改善了高表达组的预后。研究[9-10]报道,eIF-4E与肺癌、食管癌等肿瘤的预后不良相关,而阻抑其表达可以抑制细胞增殖及提高化疗敏感性。因此,对于eIF-4E在AML患者中高表达是否与预后不良相关,仍不能下定论,尚待进一步研究。本研究还发现,mTOR mRNA的高表达与骨髓原始细胞增殖和髓外侵犯呈正相关。可能原因为,mTOR高表达引起4E-BP1的磷酸化,使得eIF-4E游离并与mRNA的5 -′ cap端结合,促进蛋白翻译,导致白血病原始细胞不断增殖、骨髓微环境破坏,致使髓外侵犯增加。目前mTOR已应用于肿瘤的研究及治疗中,其抑制剂可以使细胞周期阻滞于G1期,导致细胞增殖受抑、促进细胞凋亡[11]。这提示mTOR可以促进细胞增殖,与我们的研究所得出的结论相似。此外,本研究表明,mTOR mRNA的高表达可能与贫血正相关,可能原因为mTOR促进骨髓原始细胞增殖的同时间接抑制了正常红系的增殖。因此,如mTOR表达增高,结合骨髓原始细胞比例,可实施较强的化疗方案,同时应结合血红蛋白计数给予积极的输血支持。
综上所述,mTOR通路下游核心基因的表达可影响骨髓造血,且与AML原始细胞增殖、髓外侵犯及PLT数密切相关,并可间接影响红系造血。化疗前检测mTOR通路下游核心基因的表达有助于制定合理强度的化疗方案以及进行积极的输血支持。
参考文献
[ 1 ]Assouline S, Cocolakis E, Borden KL. The Development of Novel Therapies for the Treatment of Acute Myeloid Leukemia (AML) [J]. Cancers (Basel), 2012 ,4(4):1161-1179.
[ 2 ]Fransecky L, Mochmann LH, Baldus CD. Outlook on PI3K/AKT/mTOR inhibition in acute leukemia[J]. Mol Cell Ther, 2015, 3:2.
[ 3 ]Laplante M, Sabatini DM. mTOR signaling in growth control and disease[J]. Cell, 2012 ,149(2): 274-293.
[ 4 ]Morgan TM, Koreckij TD, Corey E. Targeted therapy for advanced prostate cancer: inhibition of the PI3K/Akt/mTOR pathway[J]. Curr Cancer Drug Targets, 2009, 9(2):237-249.
[ 5 ]秦小琪. PI3K、Akt、mTOR在白血病中的表达及临床意义[D]. 石家庄:河北医科大学,2006:10-30.
[ 6 ]张之南.血液病诊断及疗效标准[ M] .天津:天津科学技术出版社, 1998:168-373.
[ 7 ]Hay N,Sonenberg N.Upstream and downstream of mTOR[J]. Genes Dev, 2004, 18(16): 1926-1945.
[ 8 ]Richardson CJ, Schalm SS, Blenis J. PI3-kinase and TOR: PIKTORing cell growth[J]. Semin Cell Dev Biol, 2004, 15(2): 147-159.
[ 9 ]Thumma SC, Jacobson BA, Patel MR, et al. Antisense oligonucleotide targeting eukaryotic translation initiation factor 4e reduces growth and enhances chemosensitivity of non-small-cell lung cancer cells. Cancer Gene Ther[J]. 2015, 22(8):396-401.
[10]Lu J, Pan Y, Lei Y, et al. Clinical significance of the expression of eukaryotic initiation factor 4 E and mammalian target of rapamycin in esophageal squamous carcinoma tissues[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2015, 18(9):905-908.
[11]Yu K, Toral-Barza L, Shi C, et al. Biochemical, cellular, and in vivo activity of novel ATP-competitive and selective inhibitors of the mammalian target of rapamycin[J]. Cancer Res, 2009 , 69(15):6232-6240.
中图分类号R 733.71
文献标志码A
通讯作者吕书晴,E-mail: lsq7219@sohu.com
基金项目:国家自然科学基金资助项目(编号:30873042;81100361)
