大鼠髓核细胞体外衰老模型的建立
2016-04-12王厚磊卢伟李德芳丁磊吴靖平
王厚磊 卢伟 李德芳 丁磊 吴靖平
(复旦大学附属金山医院骨科,上海 201508)
·论著·
大鼠髓核细胞体外衰老模型的建立
王厚磊卢伟李德芳丁磊吴靖平
(复旦大学附属金山医院骨科,上海201508)
摘要目的: 建立大鼠椎间盘髓核细胞体外衰老模型。方法: 提取大鼠椎间盘髓核细胞,在完全培养基中培养,作为对照组;在对照组基础上加入终浓度为100 μmol/L三丁基过氧化氢(t-BHP)培养2 h,构建髓核细胞体外衰老模型(衰老模型组)。采用Western印迹法检测两组髓核细胞的衰老相关指标微囊蛋白-1(caveolin-1)、β-半乳糖苷酶(SA-β-gal)的表达量,同时采用CCK-8细胞增殖实验检测两组的细胞活性。结果: 与对照组比较,t-BHP作用2 h后,衰老模型组caveolin-1、SA-β-gal表达量明显升高,且髓核细胞增殖速率减慢,细胞活性明显降低。结论: 采用t-BHP诱导的方法能成功构建髓核细胞体外衰老模型,caveolin-1在此过程中诱发了髓核细胞的衰老。
关键词髓核细胞;衰老;三丁基过氧化氢
Establishment of the Senescence Model of Rat Nucleus Pulposus Cell in VitroWANGHouleiLUWeiLIDefangDINGLeiWUJingpingDepartmentofOrthopedics,JinshanHospital,FudanUniversity,Shanghai201508,China
AbstractObjective: To establish a senescence model of rat intervertebral disc nucleus pulposus cells.Methods: The nucleus pulposus cells, which were extracted from rat intervertebral discs and cultured in complete medium, were set as control group. The senescence model of nucleus pulposus cells in vitro(senescence model group) was established by additional culture for two hours on the basis of control group, to which tert-butyl hydroperoxide(t-BHP) was added with a final concentration of 100 μmol/L. The expression levels of senescence associated indexes, such as caveolin-1 and beta-galactosidase (SA-β-gal), in two groups were assessed by Western blotting, while the cell viability in two groups was detected by Cell Counting Kit-8(CCK-8) proliferation assay.Results: After two hours of t-BHP function, the expression levels of caveolin-1and SA-β-gal in senescence model group were significantly higher than those in control group, while the nucleus pulposus cells proliferation was slower and the cell viability was much lower.Conclusions: The senescence model of nucleus pulposus cells in vitro can be established successfully with the induction of t-BHP, and caveolin-1 induces the senescence of nucleus pulposus cells during the process.
Key WordsNucleus pulposus cells;Senescence;Tert-butyl hydroperoxide
椎间盘退行性疾病是中老年人的常见病和多发病,椎间盘退变(intervertebral disc degeneration, IVDD)是其发生的前提条件和病理基础。引起IVDD的因素包括家族遗传史、高龄、衰老等。其中,髓核细胞的提前衰老与IVDD密切相关;衰老可导致髓核细胞功能下降、细胞外基质合成不足,进而发生IVDD[1]。目前,IVDD的确切发病机制及病理变化过程仍不明确[2]。构建理想的体外椎间盘细胞衰老模型对研究IVDD的发生机制、减缓或逆转其发病过程具有重要意义。
1资料与方法
1.1材料
1.1.1试剂与仪器DMEM高糖型培养基、胎牛血清、胰蛋白酶购自美国Gibco公司;三丁基过氧化氢(tert-butyl hydroperoxide,t-BHP)、二甲基亚砜(DMSO)购自美国Sigma公司;微囊蛋白-1(caveolin-1)、β-半乳糖苷酶(SA-β-gal)的一抗、二抗购自美国CST公司;蛋白上样缓冲液、BCA试剂盒、SDS-PAGE凝胶配制试剂盒购自上海碧云天生物技术有限公司;培养瓶、培养板购自美国Corning公司;发光液购自美国Millipore公司;二氧化碳细胞培养箱超净工作台购自上海力申科学仪器有限公司。
1.1.2实验动物清洁级SD大鼠10只,10周龄,雌雄各半,体质量150~200 g,由上海市公共卫生临床中心提供[生产许可证号:SCXK(沪)2010—0024]。无菌手术在上海市公共卫生临床中心实验动物科学部屏障动物实验设施[许可证号:SYXK(沪)2010—0098]中进行,并按实验动物3R原则给予大鼠人道关怀。
1.2方法
1.2.1SD大鼠椎间盘髓核细胞的分离与培养经腹腔注射水合氯醛麻醉大鼠后采用颈椎脱臼法处死,常规消毒,在无菌条件下取整个腰椎;在解剖显微镜下剥离椎间盘周围筋膜和肌肉并显露椎间盘,将脊柱标本用预先准备的无菌磷酸盐缓冲液(PBS)清洗2次;用尖刀片轻轻刮除椎间盘上层软骨终板,显露软骨终板之间的胶冻样组织后用细针轻轻将其挑出并放入盛有培养基的培养皿中,剪为0.5 mm3左右的组织块;1000 r/min离心5 min,用PBS冲洗3次,采用序贯消化法获取髓核细胞;以约2×104的密度接种于培养瓶中,将培养瓶置于CO2体积分数为5%、37℃的细胞培养箱中培养,进行换液、传代、铺板,随机进行实验分组。
1.2.2建立椎间盘髓核细胞衰老模型对照组细胞在37℃、CO2体积分数为5%的条件下用髓核细胞完全培养基培养2 h;衰老模型组细胞在对照组基础上加入终浓度为100 μmol/L的 t-BHP后培养2 h。两组均再用完全培养基培养72 h,然后检测相关指标。
1.2.3Western印迹检测caveolin-1、SA-β-gal表达量将衰老模型组和对照组培养72 h后,去除各孔培养基,用预冷PBS清洗1次;去除PBS后每孔加入RIPA裂解液80 μL并于冰上裂解30 min;混匀,收集裂解液,并于4℃以14 000 r/min离心20 min;取上清液,测定蛋白浓度。取50 μg蛋白,与上样缓冲液混合后煮沸8 min,按常规方法进行Western印迹,caveolin-1一抗为1∶1000稀释,SA-β-gal一抗为1∶2000稀释,以β-actin作为内参。
1.2.4细胞增殖检测收集处于对数增长期的髓核细胞,以4×103/孔的密度接种于96孔板,每组3个复孔,培养于37℃、CO2体积分数为5%的培养箱内,分别在第0 h、24 h、48 h、72 h检测细胞活性。按照CCK-8试剂盒说明书操作步骤,每孔中加入10 μL CCK-8试剂,混匀后于孵箱中孵育2 h,然后应用酶标仪测定490 nm波长处的吸光度值。实验重复3次。
2结果
2.1衰老相关蛋白检测以β-actin作为内参,对衰老模型组和对照组进行衰老相关蛋白检测。Western印迹结果显示,与对照组相比,衰老模型组caveolin-1、SA-β-gal表达均较高(P=0.001),衰老模型组细胞衰化明显。见图1。

A:对照组;B:衰老模型组。以β-actin作为内参
2.2细胞增殖检测CCK-8检测结果显示:与对照组细胞相比,随着培养时间的增加,衰老模型组细胞活性逐渐降低,说明髓核细胞经t-BHP作用2 h后, 细胞活性受到抑制,在72 h时最为显著,抑制率达52.3%(P=0.002)。见图2。
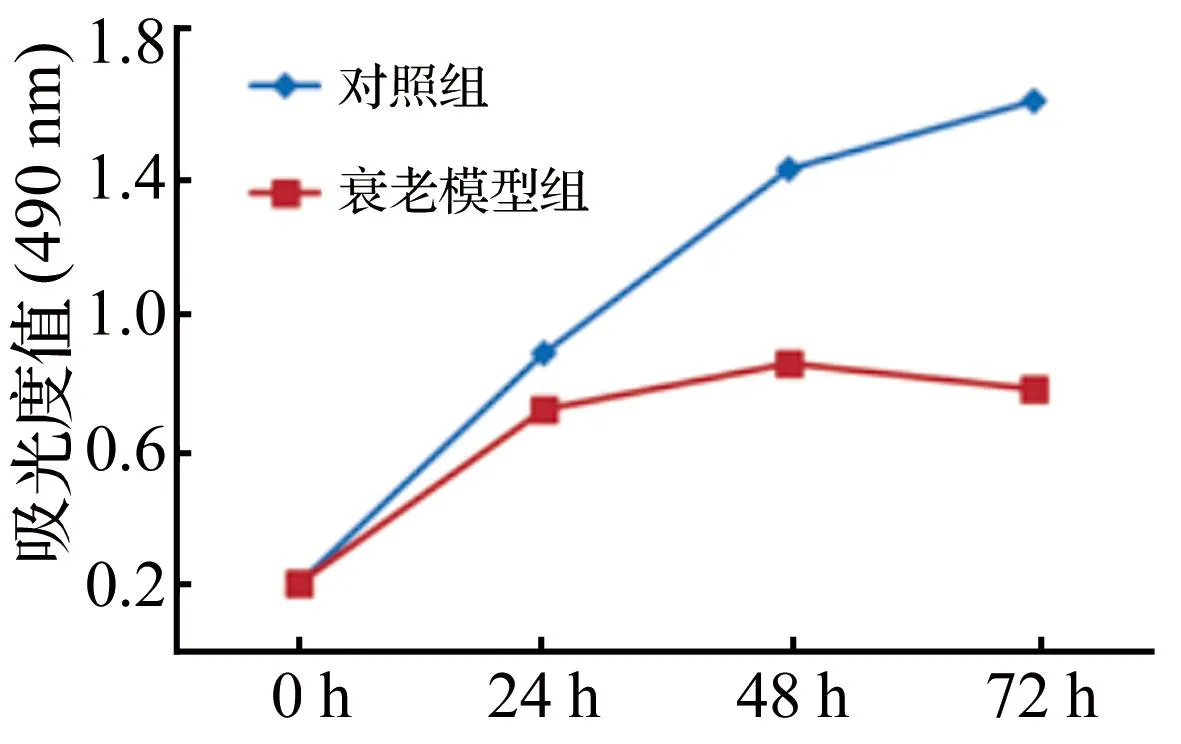
图2 髓核细胞增殖检测
3讨论
目前尚无有效的治疗途径可以缓解IVDD。近年来,从细胞分子水平研究IVDD的机制成为研究的焦点之一。本研究旨在建立髓核细胞衰老模型,以模拟椎间盘退变时的细胞分子学改变,明确其发病机制。
有研究[3-5]已证实,椎间盘髓核细胞的衰老程度与椎间盘退变等级正相关;通过计算髓核组织内的衰老细胞率发现,退变程度为ThompsonⅣ级的椎间盘的衰老细胞率比ThompsonⅡ级的椎间盘高25%左右,而椎间盘细胞的衰老程度与椎间盘细胞活性负相关。有学者[6]指出,多种复杂因素的共同作用使髓核细胞逐步衰老,衰老的髓核细胞活性降低,蛋白多聚糖、Ⅱ型胶原等细胞外基质合成不足,继而发生IVDD。
目前,构建细胞衰老模型的方法有很多,比较常见的有化学诱导法和物理诱导法。物理诱导主要为紫外线照射法[7]。化学诱导法主要是向细胞培养体系内加入特定的化学物质,如过氧化氢(H2O2)[8-9]、D-半乳糖[10]等。国外研究[11]指出,氧化应激障碍是促进机体衰老的重要因素之一;机体内抗氧化应激系统发生功能紊乱会导致体内过多的活性氧或自由基产生,使细胞功能下降,引起细胞损伤及衰老。应用t-BHP诱导细胞衰老是一种经典的体外诱导细胞衰老的方法,能较好模拟体内氧化应激障碍[12]。但此方法在诱导椎间盘髓核细胞建立衰老模型方面未见进一步的研究。
细胞衰老是各种应激因素刺激正常细胞所造成的。目前将细胞衰老分为复制性衰老(replicative senescence,RS)和应激诱导过早衰老(stress-induced premature senescence,SIPS)。随着细胞分裂次数的增加,绝大多数细胞都会发生RS。伴随着细胞有丝分裂,端粒会逐渐缩短,并最终引起细胞的衰老。与RS不同,SIPS是各种应激因素导致细胞终止分裂。目前发现,诱发细胞衰老的刺激信号主要通过p53-p21通路和p16-Rb通路发挥作用[13]。p53-p21-Rb 通路被认为是诱发细胞衰老的重要途径。当外界刺激因素损伤细胞遗传物质时,p53可以激活部分负性调控基因,以此阻止细胞增殖。它可以终止G1、G2期细胞有丝分裂,也可以诱导细胞提前衰老。caveolin-1可通过p53-p21 通路使细胞分裂增殖的进程阻滞,发挥负性调控作用,进而诱导细胞衰老。国外研究[14-16]表明,caveolin-1对胞膜中的信号分子有负性调控作用,以此抑制细胞增殖,促使细胞衰老;当细胞内caveolin-1过表达时,易发生早熟性衰老。有学者[17]发现,caveolin-1可通过p53-p21信号通路使小鼠成纤维细胞功能减退,细胞增殖减缓,呈现衰老细胞的形态。Bartholomew等[18]也发现,过氧化应激障碍时,人成纤维细胞中caveolin-1能够通过稳定p53上调p21的表达,促使细胞提前进入衰老状态。因此,caveolin-1上调是促使细胞衰老的重要因素。Heathfield 等[19]在研究caveolin-1与氧化应激障碍导致衰老的关系时发现,从IVDD患者中分离提取的髓核组织中caveolin-1表达量明显上升,说明氧化应激障碍会上调caveolin-1的表达,进而使得髓核细胞提前衰老,进一步加剧IVDD。Heathfield等[19]研究干细胞时也发现,衰老的干细胞中caveolin-1的表达量明显上升,并伴随着部分衰老基因如p16INK4a、p21过度表达,证实了在衰老干细胞中caveolin-1可启动部分衰老基因过表达而使干细胞分化潜能不断降低。
本研究成功构建了IVDD髓核细胞的体外衰老模型,从而可以很好地模拟体内IVDD时髓核细胞所发生的分子学变化。Western印迹检测发现,衰老模型组髓核细胞中caveolin-1、SA-β-gal表达明显升高,细胞增殖活性显著降低。caveolin-1与细胞老化关系密切。在整个衰老过程中,细胞膜上所接受的外界刺激类似一个开关,决定了细胞衰老的演变过程,而caveolin-1 甚至被认为是“衰老开关”的启动器;当caveolin-1过多表达时,细胞内肌动蛋白张力丝增加,拉动细胞膜,细胞形态变为扁平状的巨大细胞,进而细胞功能减退并呈现出衰老特征[20]。SA-β-gal活性能较好地显示细胞溶酶体的生理状态,被公认为是反映细胞衰老程度的重要检测指标[21]。本研究表明,髓核细胞衰老时,SA-β-gal表达水平明显升高。
目前,对于椎间盘退变的研究主要集中于软骨终板及纤维环,而体外髓核细胞老化模型的建立鲜有报道。本研究采用t-BHP诱导建立髓核细胞衰老模型,便捷高效。本模型不但证实了衰老髓核细胞的存在,而且有助于解释衰老髓核细胞内不同衰老途径是如何相互联系的,并初步探讨了髓核细胞的衰老机制,为进一步研究髓核细胞的衰老机制及干预措施奠定了基础。
参考文献
[ 1 ]Tang X, Jing L, Chen J. Changes in the molecular phenotype of nucleus pulposus cells with intervertebral disc aging[J]. PLoS One, 2012,7(12):e52020.
[ 2 ]Sakai D. Future perspectives of cell-based therapy for intervertebral disc disease[J]. Eur Spine J, 2008,17 (Suppl 4):452-458.
[ 3 ]Gruber HE, Ingram JA, Norton HJ, et al. Senescence in cells of the aging and degenerating intervertebral disc: immunolocalization of senescence-associated beta-galactosidase in human and sandrat discs[J]. Spine (Phila Pa 1976), 2007,32(3):321-327.
[ 4 ]Heathfield SK, Le Maitre CL, Hoyland JA. Caveolin-1 expression and stress-induced premature senescence in human intervertebral disc degeneration[J]. Arthritis Res Ther, 2008,10(4):R87.
[ 5 ]Gruber HE, Ingram JA, Davis DE, et al. Increased cell senescence is associated with decreased cell proliferation in vivo in the degenerating human annulus[J]. Spine J, 2009,9(3):210-215.
[ 6 ]Tang X, Jing L, Chen J. Changes in the molecular phenotype of nucleus pulposus cells with intervertebral disc aging[J]. PLoS One, 2012,7(12):e52020.
[ 7 ]Masaki H. Role of antioxidants in the skin: anti-aging effects[J]. J Dermatol Sci, 2010,58(2):85-90.
[ 8 ]Cheng H, Qiu L, Ma J, et al. Replicative senescence of human bone marrow and umbilical cord derived mesenchymal stem cells and their differentiation to adipocytes and osteoblasts[J]. Mol Biol Rep, 2011,38(8):5161-5168.
[ 9 ]Efimenko A, Dzhoyashvili N, Kalinina N, et al. Adipose-derived mesenchymal stromal cells from aged patients with coronary artery disease keep mesenchymal stromal cell properties but exhibit characteristics of aging and have impaired angiogenic potential[J]. Stem Cells Transl Med, 2014,3(1):32-41.
[10]蔡大勇, 赵雁, 黄启福. D-半乳糖致原代培养神经元损伤模型的研究[J]. 中国病理生理杂志, 2002,18(7):794-797.
[11]Szarka A, Bánhegyi G, Sümegi B. Mitochondria, oxidative stress and aging[J]. Orv Hetil, 2014,155(12):447-452.
[12]Zhou Y, Yang B, Yao X, et al. Establishment of an aging model of Sca-1+ hematopoietic stem cell and studies on its relative biological mechanisms[J]. In Vitro Cell Dev Biol Anim, 2011,47(2):149-156.
[13]Dimri GP. What has senescence got to do with cancer?[J]. Cancer Cell, 2005,7(6):505-512.
[14]Park WY, Park JS, Cho KA, et al. Up-regulation of caveolin attenuates epidermal growth factor signaling in senescent cells[J]. J Biol Chem, 2000,275(27):20847-20852.
[15]Cho KA, Ryu SJ, Oh YS, et al. Morphological adjustment of senescent cells by modulating caveolin-1 status[J]. J Biol Chem, 2004,279(40):42270-42278.
[16]Cho KA, Park SC. Caveolin-1 as a prime modulator of aging: a new modality for phenotypic restoration?[J]. Mech Ageing Dev, 2005,126(1):105-110.
[17]Volonte D, Zhang K, Lisanti MP, et al. Expression of caveolin-1 induces premature cellular senescence in primary cultures of murine fibroblasts[J]. Mol Biol Cell, 2002,13(7):2502-2517.
[18]Bartholomew JN, Volonte D, Galbiati F. Caveolin-1 regulates the antagonistic pleiotropic properties of cellular senescence through a novel Mdm2/p53-mediated pathway[J]. Cancer Res, 2009,69(7):2878-2886.
[19]Heathfield SK, Le Maitre CL, Hoyland JA. Caveolin-1 expression and stress-induced premature senescence in human intervertebral disc degeneration[J]. Arthritis Res Ther, 2008,10(4):R87.
[20]Cho KA, Park SC. Caveolin-1 as a prime modulator of aging: a new modality for phenotypic restoration?[J]. Mech Ageing Dev, 2005,126(1):105-110.
[21]Debacq-Chainiaux F, Erusalimsky JD, Campisi J, et al. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo[J]. Nat Protoc, 2009,4(12):1798-1806.
中图分类号R681.5+3
文献标志码A
通讯作者:吴靖平,E-mail: drwujp@126.com
基金项目:上海市卫生和计划生育委员会科研项目(编号:2012-341)
