系统性硬化症下消化道受累13例
2016-04-11侯春凤
侯春凤,沈 敏
(中国医学科学院 北京协和医学院 北京协和医院风湿免疫科 风湿免疫病学教育部重点实验室, 北京 100730)
ChinJAllergyClinImmunol,2016,10(4):365- 370
系统性硬化症(systemic sclerosis,SSc)是一种原因不明的临床上以局限性或弥漫性皮肤增厚和纤维化为特征的结缔组织病,可以累及肺、心、肾和消化系统等多种脏器。其中,消化系统受累在弥漫性皮肤型SSc和局限性皮肤型SSc中都很常见,SSc患者消化道受累以食道病变最常见[1],而空肠、回肠、结肠、直肠部位的下消化道肠道症状容易被忽视,目前该病下消化道受累少有报道。本研究对近15年本院收治入院的SSc并下消化道受累患者进行回顾性分析。
对象和方法
对象
2000年11月至2015年6月北京协和医院住院SSc患者共569例,所有患者均符合1980美国风湿病学会(American College of Rheumatology,ACR)推荐的SSc分类标准[2]或2013年ACR/欧洲抗风湿病联盟推荐的SSc分类标准[3]。SSc根据皮肤受累分布进一步分为:(1)局限型SSc,指皮肤硬化仅局限于肘、膝关节远端,但可累及头、颈部;(2)弥漫型SSc,指皮肤硬化向四肢近端发展并累及肘、膝关节近端皮肤,或躯干部分皮肤受累。此外,重叠综合征是指同时符合SSc分类标准和其他结缔组织病的分类标准,如系统性红斑狼疮、皮肌炎、多发性肌炎、类风湿关节炎等。下消化道指距十二指肠悬韧带50 cm以下的肠段,包括空肠、回肠、结肠以及直肠病变,上述部位出现的病变为下消化道受累。569例SSc患者中符合下消化道受累标准患者13例。
方法
回顾性分析所有SSc并下消化道受累患者的临床资料、实验室、影像学、内镜及病理学资料。临床资料包括年龄、性别、SSc并下消化道受累时发病年龄、从SSc起病到出现下消化道受累的平均时间、出现下消化道受累时SSc类型(局限性皮肤型SSc或弥漫性皮肤型SSc)、雷诺现象、指端溃疡史、毛细血管扩张、心肌受累(超声心动图提示左心室射血分数<50%,且不能用其他原因解释)、肺间质病变、肺动脉高压、肾损害、消化系统表现(反流性食管炎、吞咽困难、恶心、呕吐、腹痛、腹泻、腹胀、血便)、肌炎等。实验室指标包括血常规、尿常规、便常规+潜血、抗核抗体(anti-nuclear antibody,ANA)谱、抗中性粒细胞胞浆抗体(anti-neutrophil cytoplastic antibodies,ANCA)、血红细胞沉降率(erythrocyte sedimentation rate,ESR)、超敏C反应蛋白(hypersensitive C-reactive protein,hsCRP)、免疫球蛋白、补体等。影像学包括肺部高分辨CT、超声心动图、腹部平扫/增强CT、腹部立位平片、小肠三维重建、核素淋巴显像及蛋白丢失显像。内镜包括胃(肠)镜检查以及病理检查。此外,还包括治疗、转归和随访。
统计学处理
结 果
一般资料
SSc住院患者中下消化道受累发生率为2.3%(13/569)。13例患者中男性4例,女性9例,男∶女=1∶2.25。SSc患者平均发病年龄(40±17)岁(16~69岁),并发下消化道受累时平均年龄(45±18)岁(19~69岁),从SSc起病至出现下消化道受累的中位病程时间为5年(0~20年)。从出现下消化道症状到明确诊断的中位时间为33个月(1~60个月),其中有7例(54%)患者达到12个月以上。13例患者中1例以下消化道症状(腹泻伴消瘦)为首发表现。本组患者中弥漫性皮肤型SSc 6例,局限性皮肤型SSc 7例,另包括重叠综合征2例(均重叠系统性红斑狼疮)(表1)。
临床表现
SSc全身表现:13例SSc患者中最常见的临床表现为雷诺现象(12/13,92%),其次为肺间质病变(8/13,62%)、肺动脉高压(5/13,38%)、关节痛(3/13,23%)、指端坏疽(2/13,15%)、心肌受累(2/13,15%)、毛细血管扩张(1/13,8%)、肌炎(1/13,8%)和肾危象(1/13,8%)。
消化道受累表现:13例SSc并下消化道受累患者的临床表现以腹泻为最主要的症状,发生率77%(10/13),腹痛、腹胀、恶心、呕吐发生率均为69%(9/13),便血33%(3/13)。消化道病变最终诊断为假性肠梗阻8例(67%),肠溃疡2例(15%)(其中1例肠溃疡并发严重下消化道出血),失蛋白肠病2例(15%),小肠细菌过度生长1例(8%),肛门括约肌功能障碍1例(8%)。此外,同时并发上消化道病变者共9例(69%),包括反流性食管炎8例(66.7%),吞咽困难2例(15%),食管溃疡及十二指肠溃疡2例(15%),食管狭窄1例(8%),胃窦血管扩张及上消化道出血1例(8%)。
实验室检查:SSc下消化道受累时,病情多无明显活动。13例患者中69%(9/13)ESR在正常范围内,中位数为23 mm/1 h(2~98 mm/1 h);69%(9/13)患者CRP在正常范围内,中位数为8.5 mg/L(1.38~21.7 mg/L);白细胞下降率8%(1/13)(该例患者白细胞为2.96×109/L),69%(9/13)患者有贫血,平均血红蛋白为(94±30)g/L;大便潜血阳性率31%(4/13);13例患者中31%(4/13)免疫球蛋白G升高;ANA阳性率92%(12/13),抗RNP抗体阳性率31%(4/13),抗SSA抗体阳性率23%(3/13),抗着丝点抗体阳性率8%(1/13),抗Sm抗体阳性率8%(1/13),抗SCL- 70抗体及ANCA均阴性。
影像学检查:13例患者中10例行立位腹部平片,其中8例均提示肠道积气、扩张伴气液平面,1例无明显异常发现,1例可见少量肠气,肠管未见扩张,未见气液平面。4例患者行小肠造影,3例结果显示异常:肠动力减低1例,肠腔扩张1例,空回肠移行处一过性狭窄1例。11例患者行腹部平扫/增强CT(其中1例同时行小肠三维重建),8例结果显示异常:腹(盆)腔积液5例,肠管扩张伴气液平面4例,肠管增厚2例,肠壁变薄及肠腔狭窄均1例。1例患者行肠道蛋白核素显像,结果显示肠道少量蛋白丢失。1例患者行核素淋巴显像,结果显示左小腿淋巴肿,左静脉角持续增宽显像(图1,2)。
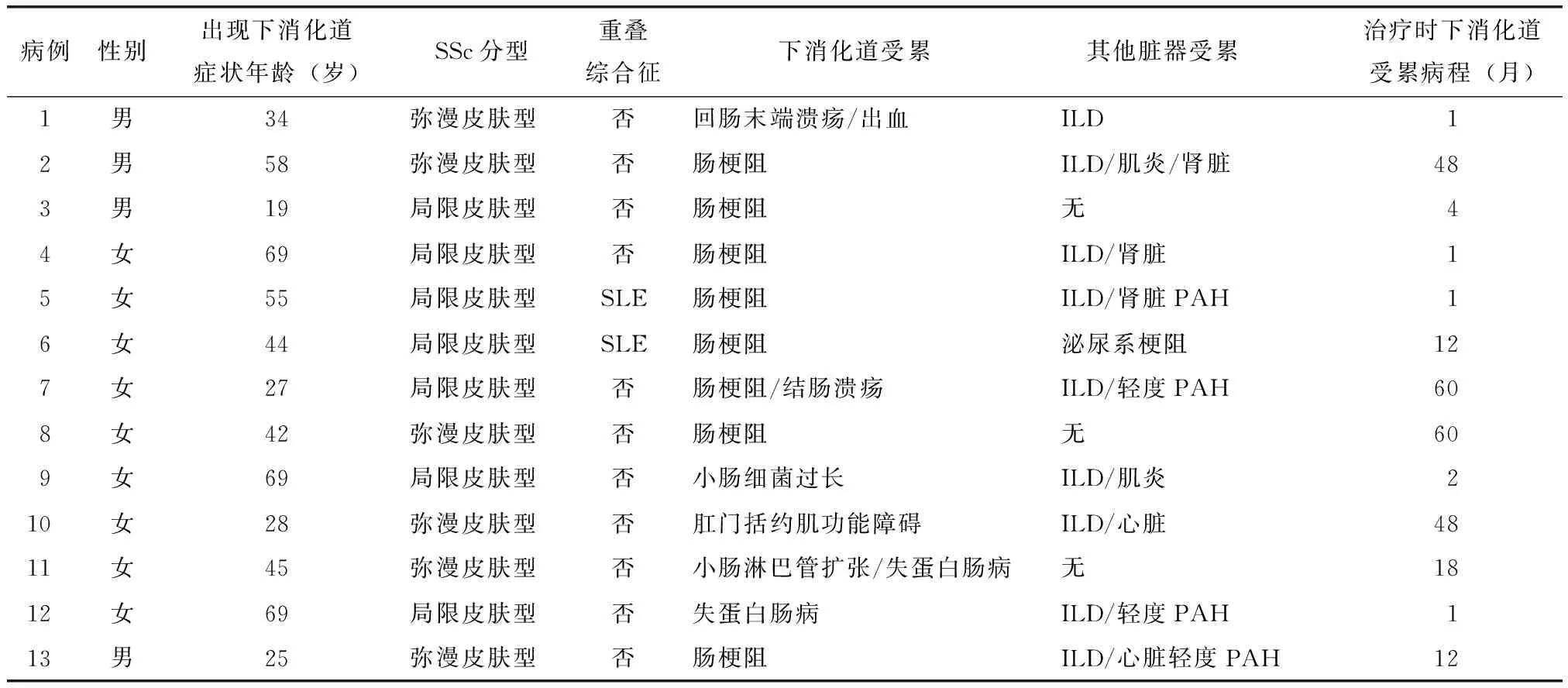
表1 13例SSc并下消化道受累患者一般资料Table 1 Clinical data of 13 cases with lower gastrointestinal involvement in systemic sclerosis
SSc:系统性硬化症;SLE:系统性红斑狼疮;ILD:间质性肺病;PAH:肺动脉高压
内镜及病理:13例患者中共4例行肠镜检查,镜下表现分别为:(1)小肠镜:从回盲瓣开始约80 cm小肠黏膜弥漫性充血和水肿,可见节段性环形表浅线状溃疡,未见活动性出血和肠腔狭窄;(2)结肠镜:直肠、乙状结肠黏膜散在点状出血;(3)小肠镜:空肠黏膜弥漫性充血和水肿;(4)结肠镜:末段回肠黏膜未见异常,升结肠、横结肠可见散在黏膜糜烂及环形溃疡,降、乙结肠交界处距肛门约40 cm可见一处环形溃疡。综上,下消化道受累部位可为回盲瓣、回肠末端、升结肠、横结肠、乙状结肠及直肠,病变可同时累及多个部位。总结内镜下表现为肠黏膜充血和水肿2例,肠溃疡2例、肠黏膜点状出血1例。4例患者病理结果均提示肠黏膜急慢性炎症。
治疗与转归
13例患者中9例给予糖皮质激素[0.8~1 mg/(kg·d)](其中1例予甲泼尼龙冲击治疗),联合环磷酰胺,同时给予抑酸、调节肠道菌群等治疗,病情好转。另1例患者小肠细菌过度生长并吸收不良,给予小剂量糖皮质激素及抗生素治疗后病情缓解。3例患者因胃肠道受累病程长,查体可见恶液质,故未应用糖皮质激素及免疫抑制剂,其中2例经过调节肠道菌群、肠外营养等治疗,腹泻停止,另1例给予对症支持治疗后病情有所好转,最终自动出院(表2)。
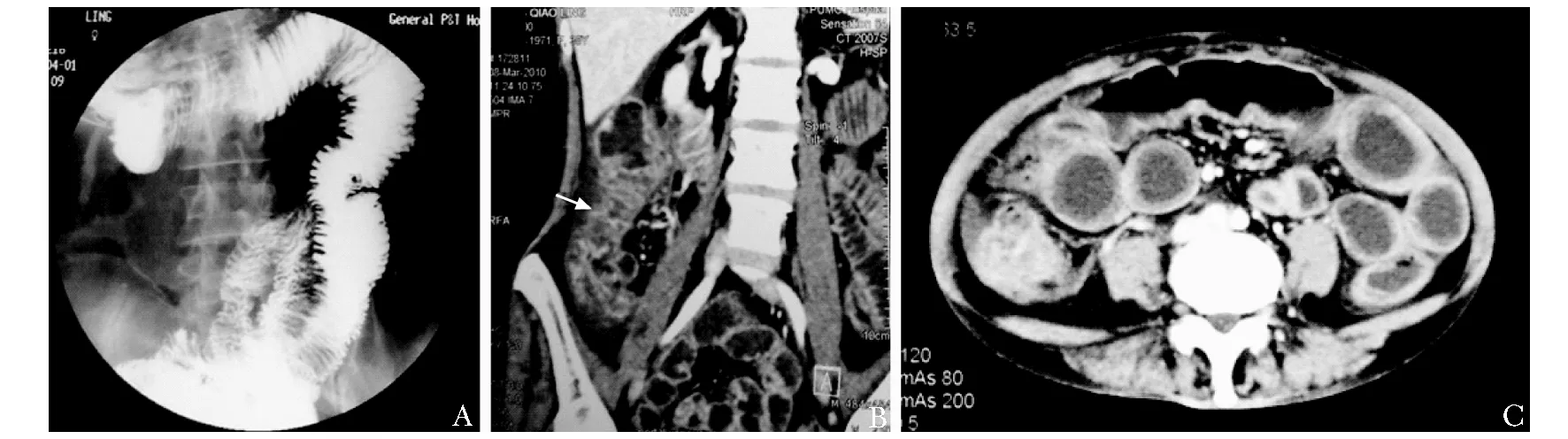
图1病例7,口服小肠造影
Fig1Multi-slice computer tomography enterography of patient 7
不完全小肠梗阻改变,空回肠移行处一过性狭窄,肠壁欠规整,胃肠动力较差(A);盆腹腔增强CT+小肠重建:盲肠及升结肠挛缩,肠腔狭窄,肠壁不规则伴强化,回盲瓣受累,末端回肠扩张(B),腹部肠管扩张伴气液平,肠梗阻可能(C)
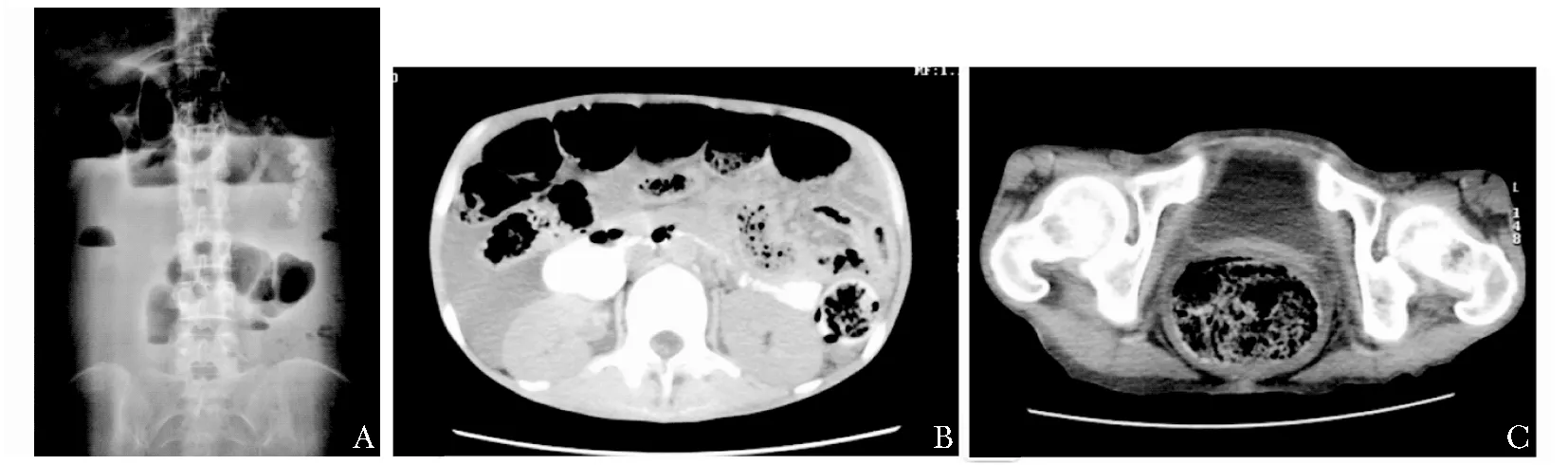
图2病例10,立位腹部平片及腹盆CT平扫
Fig2Plain abdominal radiograph and CT of patient 10
小肠积气扩张伴液平面,左腹部可见胃内容物(A);腹盆CT平扫:大量腹水;十二指肠降段、结肠扩张;左下腹小肠肠壁增厚、聚集改变(B);直肠和肛门括约肌松弛扩张(C)
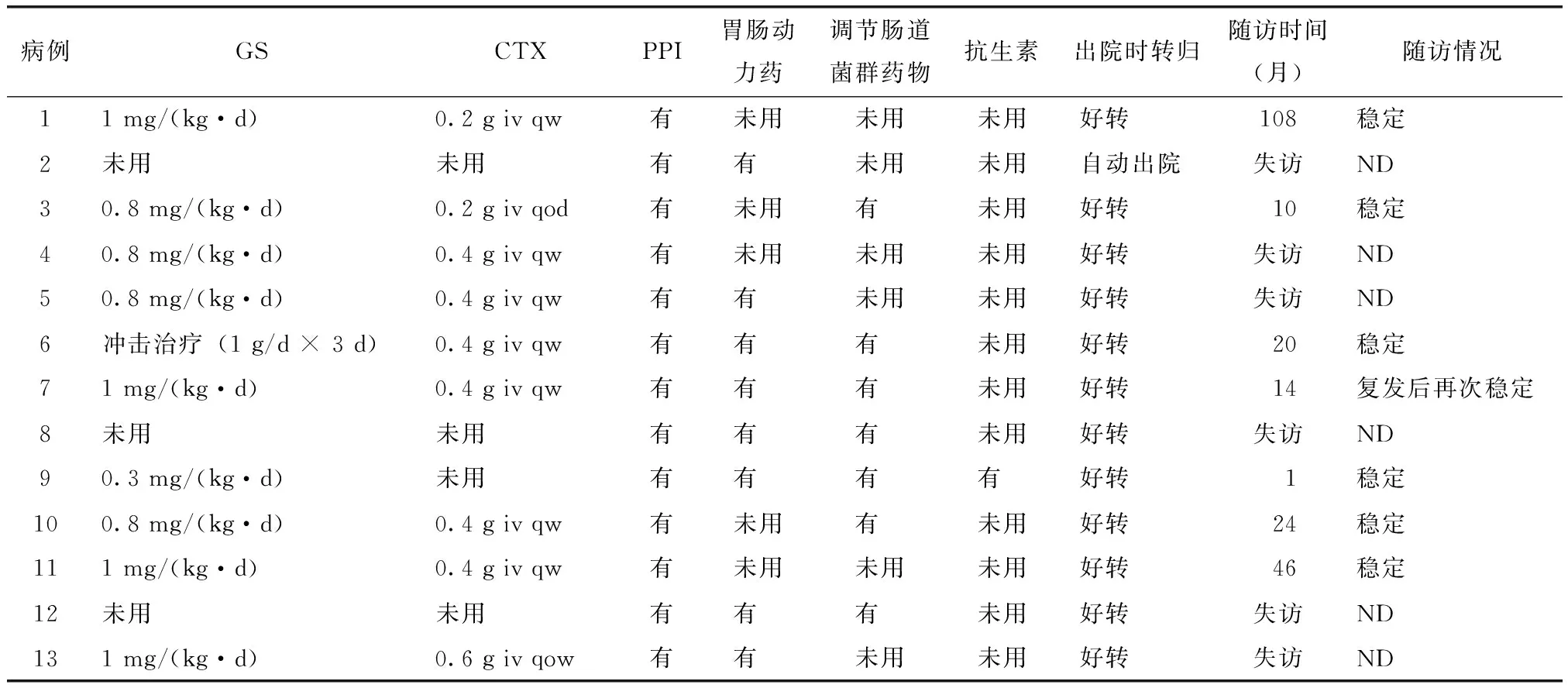
表2 13例SSc并下消化道受累患者的治疗及预后Table 2 Treatment and prognosis of 13 cases with lower gastrointestinal involvement in systemic sclerosis
SSc:系统性硬化症;GS:糖皮质激素;CTX:环磷酰胺;iv:静脉输注;qw:每周一次;qow:隔周一次;PPI:质子泵抑制剂;ND:无数据
13例患者中6例失访,其他7例患者在门诊随访,中位数随访时间20个月(1~108个月)。除1例自行停用药物而导致病情波动外,其他患者病情均较稳定。
讨 论
SSc是一种慢性结缔组织病,几乎90%的弥漫或局限皮肤型SSc患者均存在胃肠道受累的证据[4- 5],但下消化道受累发生率未见报道。据文献报道20%~60% SSc患者可出现小肠功能异常,超过50%患者尸体解剖时发现组织异常[6]。本研究SSc住院患者下消化道受累发生率仅2.28%,可能存在低估,与患者本人和医生对本病下消化道病变重视程度不够有一定关系。Jaovisidha等[7]研究表明弥漫性皮肤型SSc比局限性皮肤型SSc更易于发生胃肠道病变,但该研究并未区分上消化道或下消化道受累。本组研究13例患者中弥漫性皮肤型SSc 6例,局限性皮肤型SSc 7例,局限性与弥漫性SSc病例数无明显差别。本结果与文献报道之间的差异可能与本研究对象为SSc的下消化道病变,而不是如文献报道包含所有胃肠道病变有关,并且本组病例数较少,因此尚不能得出结论。但对于SSc患者均应警惕发生下消化道受累。
SSc胃肠道受累发生率非常高,与雷诺现象和皮肤硬化发生率相近甚至更高,而且在疾病的任何阶段均可发生[6,8]。文献强调应在SSc的早期进行胃肠功能评估,因为胃肠道受累提示SSc预后不良,与病死率有显著相关[7,9],早期诊治至关重要。但因SSc下消化道受累表现复杂多样[10- 11],缺乏特异性,且患者本人及医师没有意识到肠道症状与硬皮病的相关性,多数患者从出现下消化道症状到明确诊断之间经历了很长时间,不能做到早期诊断,而且临床上误诊、漏诊率很高。本组92%患者下消化道症状出现在SSc其他首发症状之后,常见症状包括腹胀、便秘和腹泻交替、假性肠梗阻、小肠细菌过度生长伴随吸收不良以及大便失禁。本研究发现下消化道受累常常同时并发上消化道病变,其中以反流性食管炎最常见,其次是吞咽困难、食管溃疡、十二指肠溃疡、胃窦血管扩张及上消化道出血。因此,对已诊断或疑似SSc患者如有消化道症状,宜尽早行腹部平片、胃肠造影和内镜等检查,以充分了解和评估下消化道受累情况。另一方面,对于以肠道症状为首发的患者,诊断则更加困难。本研究中1例以下消化道症状为首发的患者,长期辗转于多个科室而未得到正确诊断,导致病情延误。由此提示,临床上对难以用单纯消化道疾病解释病情全貌的患者,应警惕结缔组织病累及胃肠道可能,需详细询问病史,全面查体,以做到早期诊断。
SSc可同时累及肺、肾脏、心脏及消化道等内脏器官,并下消化道受累时经控制原发病和对症治疗病情可缓解。本组患者中有3例患者由于病程太长,就诊时已是晚期,全身恶液质表现,故丧失了治疗原发病的机会,只能采取姑息治疗。而另外9例患者因诊断及时,入院评估发现原发病病情活动,因此临床决策应用糖皮质激素及免疫抑制剂治疗,同时辅以调节肠道菌群及代谢支持治疗,之后下消化道受累均获得了好转而出院。长期随访的7例患者中,病情总体较稳定。由于本研究是回顾性分析,无法详细区分2例SSc重叠系统性红斑狼疮的患者消化道症状到底是SSc所致还是系统性红斑狼疮所致,这是本研究的不足。
综上,SSc并下消化道受累并不罕见。尽管一般并非致命性的并发症,但延误诊断可能严重影响患者生活质量,并可能导致消耗症状甚至恶液质。
[1]刘英, 杨华夏, 侯勇. 系统性硬化症并发食管瘘一例[J]. 中华临床免疫和变态反应杂志, 2016, 10:80- 81.
[2]Preliminary criteria for the classification of systemic sclerosis(scleroderma). Subcommittee for scleroderma criteria of the American Rheumatism Association Diagnostic and Therapeutic Criteria Committee [J]. Arthritis Rheum, 1980, 23:581- 590.
[3]Van den Hoogen F, Khanna D, Fransen J, et al. 2013 classification criteria for systemic sclerosis: an American College of Rheumatology/European League against Rheumatism collaborative initiative [J]. Arthritis Rheum, 2013, 65:37- 47.
[4]Turner R, Lipshutz W, Miller W, et al. Esophageal dysfunction in collagen disease [J]. Am J Med Sci, 1973, 265:191.
[5]Akesson A, Wollheim FA. Organ manifestationsin 100 patients with progressive systemic sclerosis: a comparison between the CREST syndrome and diffuse scleroderma[J]. Br J Rheumatol, 1989, 28:281.
[6]Szamosi S, Szekanecz Z, Szücs G. Gastrointestinal mani-festations in Hungarian scleroderma patients[J]. Rheumatol Int, 2006, 26:1120- 1124.
[7]Jaovisidha K, Csuka ME, Almagro UA, et al. Severe Gastrointestinal involvement in systemic sclerosis: a report of five cases and review of the literature[J]. Semin Arthritis Rheum, 2005, 34:689- 702.
[8]Schmeiser T, Saar P, Jin D, et al. Profile of gastrointestinal involvement in patients with systemic sclerosis[J]. Rheumatol Int, 2012, 32:2471- 2478.
[9]Khanna D, Hays RD, Park GS, et al. Development of a preliminary scleroderma gastrointestinal tract 1.0 quality of life instrument[J]. Arthritis Rheum, 2007, 57:1280- 1286.
[10] 沈敏, 李梦涛. 系统性硬化症并发肠道溃疡两例[J]. 中华医学杂志, 2011, 91:1368.
[11] 沈敏, 张文. 系统性硬化症合并失蛋白肠病一例[J]. 中华医学杂志, 2013, 93:806.