CD4+CD25+调节性T细胞对乳腺癌细胞上皮间质转化和ALDH1+干样细胞的影响*
2016-04-08孙立平刘军金昊李慧
孙立平刘军金昊李慧③
CD4+CD25+调节性T细胞对乳腺癌细胞上皮间质转化和ALDH1+干样细胞的影响*
孙立平①刘军②金昊①李慧①③
摘要目的:研究CD4+CD25+调节性T细胞(regulatory T cells,Tregs)对乳腺癌细胞上皮间质转化(epithelial-mesenchymal transi⁃tion,EMT)、细胞迁移侵袭能力,及ALDH1+干样细胞比例的影响。方法:采用免疫磁珠法分离乳腺癌患者外周血中CD4+CD25+Tregs,CD4+CD25+Tregs与乳腺癌BT474、MCF-7细胞系共培养(共培养组),BT474、MCF-7单独培养(对照组)。检测共培养组和对照组乳腺癌细胞EMT相关标志物表达的变化,及细胞迁移和侵袭能力的变化。此外,检测BT474细胞中ALDH1+干样细胞、微球形成能力和自我更新能力的变化。结果:CD4+CD25+Tregs诱导BT474和MCF-7细胞间质性标志物表达增高,诱导MCF-7细胞上皮性标志物E-cadherin表达降低。CD4+CD25+Tregs诱导BT474和MCF-7细胞迁移和侵袭能力上调。共培养组BT474细胞中ALDH1+干样细胞比例、微球体形成能力、自我更新能力较对照组增强。结论:CD4+CD25+Tregs可诱导乳腺癌细胞发生EMT,增强细胞体外迁移和侵袭能力,同时促进ALDH1+干样细胞增加。
关键词调节性T细胞乳腺癌上皮间质转化ALDH1+干样细胞
*本文课题受国家自然科学基金项目(编号:81171983)资助
CD4+CD25+regulatory T cells induce epithelial-mesenchymal transition and increase ALDH1+cancer stem cell-like cells in breast cancer
Liping SUN1,Jun LIU2,Hao JIN1,Hui LI1,3
Correspondence to:Hui LI;E-mail:lihui@tjmuch.com
1
Department of Immunology,Tianjin Medical University Cancer Institute and Hospital,National Clinical Research Center for Cancer,
Tianjin Key Laboratory of Cancer Prevention and Therapy,Tianjin Key Laboratory of Cancer Immunology and Biotherapy,Tianjin 300060,China;2Department of Chemotherapy,The Affiliated Hospital of Nantong University,Nantong 226000,China;3Department of
Gastrointestinal Cancer Biology,Tianjin Medical University Cancer Institute and Hospital,Tianjin 300060,China
This work was supported by the National Natural Science Foundation of China(No.81171983)
Abstract Objective:To investigate the effects of CD4+CD25+regulatory T cells(Tregs)on the epithelial-mesenchymal transition(EMT),migratory and invasive capacities,and proportion of ALDH1+cancer stem cell(CSC)-like cells in breast cancer cells.Methods:CD4+CD25+Tregs were isolated from the peripheral blood of breast cancer patients through immunomagnetic sand method.In the co-culture groups,breast cancer cell lines BT474 and MCF-7 were co-cultured with CD4+CD25+Tregs.In the control groups,BT474 and MCF-7 cells were cultured alone.EMT-related markers of breast cancer cells were then assayed in the control and co-culture groups.The migratory and invasive capacities of breast cancer cells were also detected in both groups.Furthermore,the changes in ALDH1+CSC-like cells,mammosphere-forming ability,and self-renewal capacity of BT474 cells were assayed.Results:After co-culture with CD4+CD25+Tregs,the expression of mesenchymal biomarkers increased in BT474 and MCF-7 cells,whereas the expression of the epithelial biomarker E-cadherin decreased in MCF-7 cells.Additionally,the migratory and invasive capacities of BT474 and MCF-7 cells increased after co-culture.Overall,the subpopulation of ALDH1+CSC-like cells,the mammosphere-forming ability,and the self-renewal capacity of BT474 cells improved in the co-culture group compared with the control group.Conclusion:The EMT process,migratory and invasive capacities,and CSC-like properties of breast cancer cells can be enhanced by CD4+CD25+Tregs.
Keywords:regulatory T cells,breast cancer,epithelial-mesenchymal transition,ALDH1+cancer stem cell-like cells
乳腺癌是女性发病率和死亡率最高的恶性肿瘤之一,患者死亡的首要原因是复发和转移[1]。因此,探寻降低肿瘤复发、转移的原因以提高治疗效果极为重要。研究发现上皮间质转化(epithelial-mesen⁃chymal transition,EMT)和肿瘤干细胞(cancer stem cells,CSCs)在肿瘤侵袭和转移中发挥重要作用[2-3]。乙醛脱氢酶1(aldehyde dehydrogenase 1,ALDH1)是催化细胞内乙醛氧化为乙酸的细胞溶质酶。ALDH1在乳腺癌CSCs中高表达,可作为CSCs的标记物[4]。免疫微环境与肿瘤细胞的相互作用和影响促进肿瘤细胞EMT和干性增加[5]。本实验主要是探讨CD4+CD25+调节性T细胞(regulatory T cells,Tregs)对乳腺癌细胞EMT和干性特征的影响,进一步阐述CD4+CD25+Tregs在肿瘤发生与发展过程中的作用。
1材料与方法
1.1材料
人乳腺癌BT474和MCF-7细胞系分别购自中国科学院和美国ATCC细胞库;RPMI 1640培养基和DMEM/F12培养基分别购自天津BIOROC和美国Gibco公司;胎牛血清(FBS)购自美国Hyclone公司;CD4+CD25+Tregs分选试剂盒购自德国Miltenyi公司;CD3/CD28磁珠购自美国Invitrogen公司;IL-2购自美国Sigma公司;外周血淋巴细胞分离液(Ficoll)购自中国医学科学院血液学研究所;Trizol购自美国Life Technology公司;逆转录试剂盒购自日本Takara公司;RNA引物及SYBR Premix Ex TaqTM试剂盒购于大连宝生物公司;E-cadherin、N-cadherin、Fibronectin、Vimentin和β-actin一抗购自美国BD公司;ALDH1一抗购自武汉BOSTER公司;ALDEFLUOR™试剂盒购自加拿大STEMCELL公司;bFGF和胰岛素购自美国Sigma公司;EGF购自美国Millipore公司;BSA购自美国Fisher Scientific公司。
1.2方法
1.2.1免疫磁珠法分选CD4+CD25+Tregs使用Ficoll密度梯度离心法分离乳腺癌患者外周血中单个核细胞,使用免疫磁珠方法按说明分离CD4+CD25+Tregs。
1.2.2细胞培养使用含10%FBS的RPMI 1640培养基在37°C、5%CO2条件下培养细胞。共培养组为CD4+CD25+Tregs和肿瘤细胞(1:1)共培养72 h,同时添加IL-2和CD3/CD28磁珠;对照组为肿瘤细胞常规培养。
1.2.3 RT-PCR检测按照Trizol提取试剂盒,提取细胞总RNA并逆转录成cDNA,再按照SYBR Premix Ex TaqTM试剂盒进行RT-PCR。RT-PCR引物序列如表1所示。
1.2.4 Western blot检测使用RIPA裂解液裂解细胞,提取总蛋白,在10%聚丙烯酰胺凝胶中电泳。将蛋白转移至PVDF膜上,5%脱脂奶粉封闭1 h,分别加入抗体稀释液稀释的E-cadherin(1:2 500)、N-cad⁃herin(1:2 000)、Fibronectin(1:10 000)、Vimentin(1:8 000)、β-actin(1:2 000)和ALDH1(1:200)一抗,4℃过夜。第2天取出膜,PBST漂洗后加入二抗,室温孵育1 h后PBST漂洗,ECL化学发光法显影。

表1 RT-PCR引物序列Table 1 Primer sequences used in RT-PCR
1.2.5 ALDH1流式细胞仪检测将1.0 mL细胞悬液加入测试管,DEAB试剂加入对照管;ALDEFLUOR™试剂加入测试管后混合,立即吸取0.5 mL混合物至对照管。室温孵育30 min,离心去上清,ALDEFLUOR™缓冲液重悬细胞,上机检测。
1.2.6体外微球体培养细胞消化离心后采用微球培养基(DMEM/F12培养基中含10 ng/mL bFGF、20 ng/mL EGF、5 μg/mL胰岛素和0.40% BSA)重悬,将细胞悬液接种于非黏附6孔板,计数10个视野(×100)的初始细胞数。10天后计数30个视野(×100)中直径>80 μm微球体数。基于最初接种量,计算微球体形成率。
1.2.7细胞划痕实验将2×105个/mL细胞接种于6孔板,细胞悬液体积为3 mL,待培养至90%融合度,用10 μL移液枪头在细胞表面划痕,PBS洗涤细胞,加入无血清培养基,并在倒置显微镜下观察,记录划痕间初始距离。于37℃、5%CO2培养,每12h取样,拍照。
1.2.8 Transwell侵袭实验Matrigel于冰浴融化,使用PBS稀释至1 mg/mL,铺于Transwell小室滤膜上,37℃放置使Matrigel聚合成凝胶。在24孔板内加入含10%FBS培养基500 μL,在小室内加入细胞2×104个/孔,细胞悬液体积为200 μL。待培养48 h后,取出Transwell小室,擦去未穿过膜的细胞,95%乙醇固定10 min,结晶紫染色30 min,PBS洗涤,干燥后取下微孔滤膜,倒置显微镜下观察。随机取每张滤膜中央和周围各10个视野,计数每个视野内穿过膜的细胞数目,取平均值。
1.3统计学方法
应用SPSS 20.0软件进行统计分析。定量资料比较采用t检验,数据用x±s表示,重复测量资料均数比较采用一般线性模型进行分析。P<0.05为差异具有统计学意义。
2 结果
2.1 CD4+CD25+Tregs诱导乳腺癌细胞EMT相关标志物表达改变
CD4+CD25+Tregs和乳腺癌细胞共培养72 h后,检测乳腺癌细胞EMT相关标志物表达的改变。RT-PCR和Western blot结果显示,与CD4+CD25+Tregs共培养后BT474细胞间质性标志物N-cadherin和Vi⁃mentin表达明显升高,差异具有统计学意义(P<0.01),上皮性标志物E-cadherin表达水平无显著变化(图1A、B);而MCF-7细胞间质性标志物N-cad⁃herin和Fibronectin表达增高,上皮性标志物E-cad⁃herin表达降低,差异具有统计学意义(P<0.01,图1C、D)。
2.2 CD4+CD25+Tregs诱导乳腺癌细胞迁移和侵袭能力变化
将BT474、MCF-7细胞和CD4+CD25+Tregs共培养后行细胞划痕实验以评价细胞的迁移能力。结果显示BT474细胞在72 h(图2A)、MCF-7细胞在48 h(图2B),共培养组细胞迁移的距离明显大于对照组。应用Transwell侵袭实验比较CD4+CD25+Tregs对乳腺癌细胞侵袭能力的影响,48 h后共培养组的BT474和MCF-7细胞穿过微孔膜的数目多于对照组,差异具有统计学意义(P<0.01,图3),结果显示经CD4+CD25+Tregs处理后BT474和MCF-7细胞的侵袭能力增强。

▶A.The mRNA expression in BT474 cells;B.The protein expression in BT474 cells;C.The mRNA expression in MCF-7 cells;D.The protein expression in MCF-7 cells图1 CD4+CD25+Tregs诱导乳腺癌细胞EMT相关标志物基因和蛋白表达改变Figure 1 mRNA and protein expression of EMT-related markers in breast cancer cells was detected after induction of CD4+CD25+Tregs
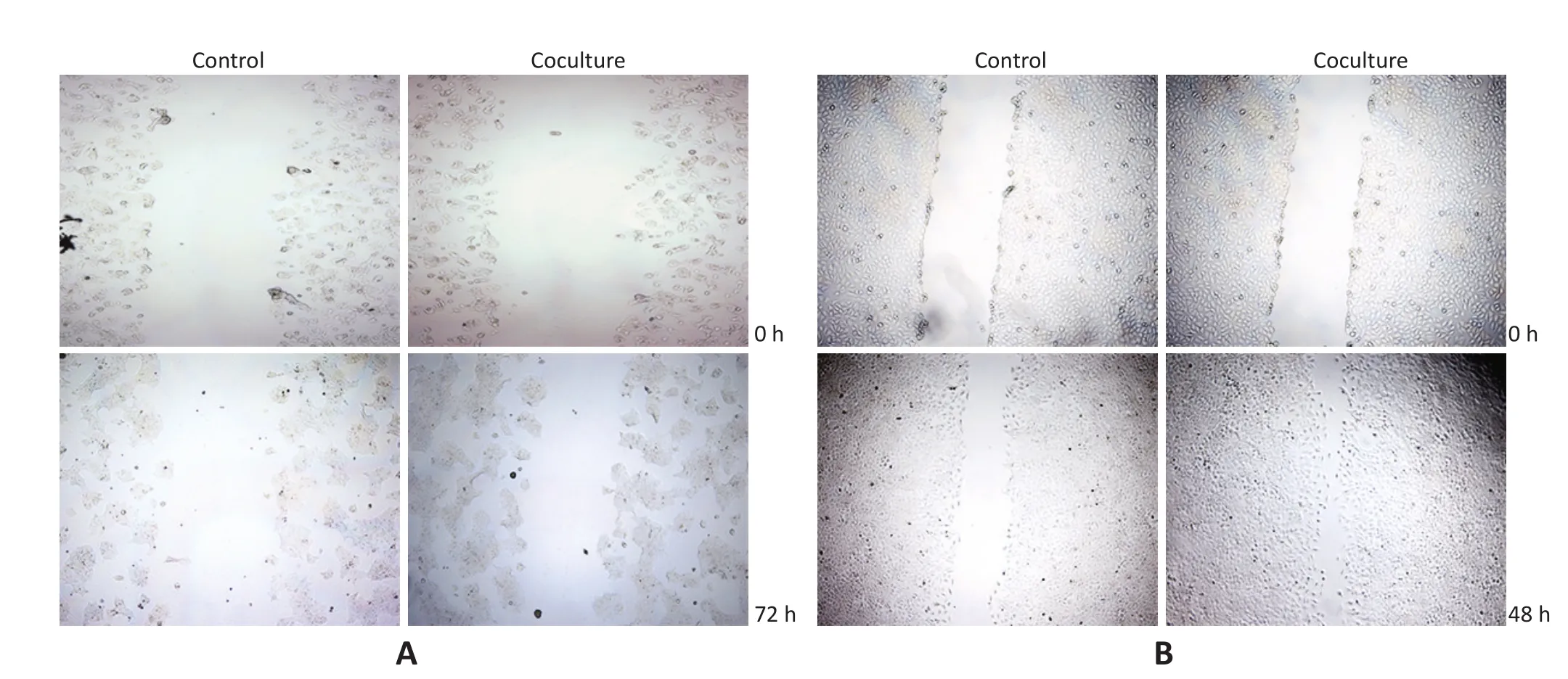
A.BT474 cells;B.MCF-7 cells图2 CD4+CD25+Tregs对乳腺癌细胞迁移能力的影响Figure 2 Migratory ability of breast cancer cells was detected after induction of CD4+CD25+Tregs
2.3 CD4+CD25+Tregs诱导BT474细胞中ALDH1+干样细胞比例改变
流式细胞仪检测CD4+CD25+Tregs诱导后BT474细胞中ALDH1+干样细胞比例。结果显示,BT474细胞中ALDH1+干样细胞比例在对照组和共培养组分别为45.37%±1.031%和73.73%±1.071%,共培养组ALDH1+干样细胞比例高于对照组,差异具有统计学意义(P<0.01,图4A、B)。RT-PCR结果显示,共培养后BT474细胞中ALDH1基因表达水平较对照组明显上升,差异具有统计学意义(P<0.01,图4C)。进一步采用Western blot检测ALDH1蛋白水平的改变,结果同样提示ALDH1蛋白表达上调(图4D)。

A-C.BT474 cells;D-F.MCF-7 cells图3 CD4+CD25+Tregs对乳腺癌细胞侵袭能力的影响Figure 3 Invasive ability of breast cancer cells was detected after induction of CD4+CD25+Tregs

A,B.Flow cytometry;C.RT-PCR;D.Western blot图4 CD4+CD25+Tregs对BT474细胞中ALDH1+干样细胞比例的影响Figure 4 Percentage of ALDH1+CSC-like cells in BT474 cells was detected after induction of CD4+CD25+Tregs.
2.4 CD4+CD25+Tregs诱导BT474细胞体外微球体形成能力变化
BT474细胞接种于低黏附培养板的DMEM/F12微球体培养基中,悬浮培养10天后计算微球体形成率。结果显示对照组BT474细胞微球体形成率为1.17%±0.27%,共培养组微球形成率增加至2.04%± 0.18%,此为第一代(G1)。将悬浮培养体系中的BT474细胞收集,进一步观察细胞的自我更新能力,胰酶消化为单细胞悬液,再次接种到低黏附孔板中进行连续传代微球体培养,共计3代。共培养组微球体形成率高于对照组,差异具有统计学意义(P<0.01,图5)。
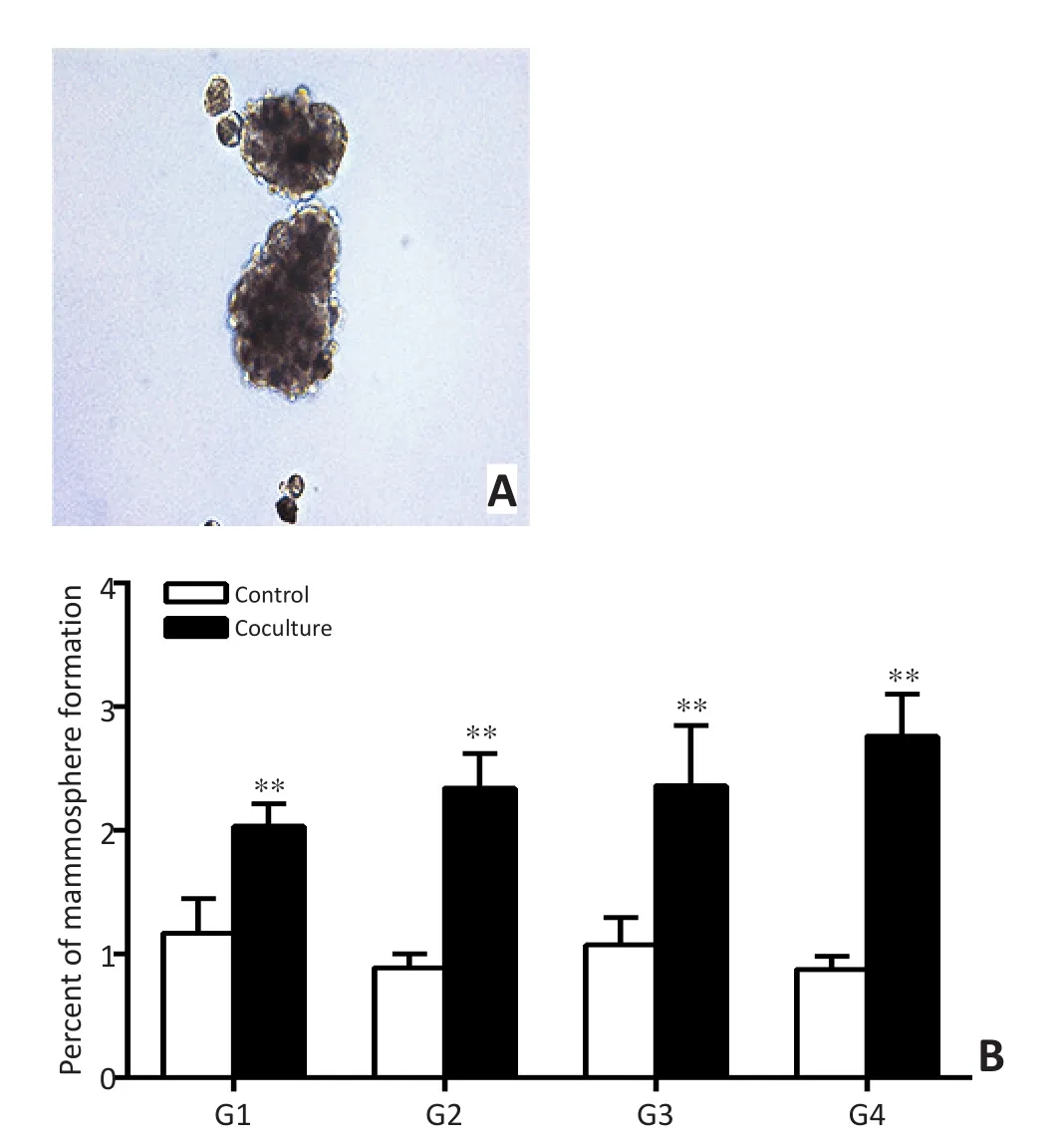
A.Representative images of tumor mammospheres;B.The self-renewal capacity of mammospheres图5 BT474细胞体外微球形成率变化Figure 5 Self-renewal capacity of mammospheres was detected in BT474 cells
3 讨论
CD4+CD25+Tregs通过多种机制抑制机体的免疫反应,是肿瘤免疫逃逸的重要机制之一[6]。研究发现乳腺癌组织中浸润性Tregs数量高于癌旁组织[7],Tregs在肿瘤聚集除了发挥免疫抑制作用外,是否对肿瘤细胞具有直接的作用目前尚缺乏研究。本研究主要探讨了CD4+CD25+Tregs在免疫效应细胞和抗原递呈细胞缺乏时诱导乳腺癌细胞EMT和ALDH1+干样细胞增加。
EMT是指上皮细胞在形态学上发生向间质细胞表型转变并获得迁移能力的过程[8]。在EMT过程中伴随着一系列分子标志物表达的改变,主要是上皮性蛋白表达下调和间质性细胞骨架结构的改变[9]。EMT按照其发生的特定生物学环境分为3种亚型,其中第3种亚型与上皮细胞性恶性肿瘤相关。原发性上皮性恶性肿瘤细胞通过EMT形成具有迁移能力的间质样细胞,并随血流迁移至不同部位,再通过EMT的逆向过程即间质上皮转化,形成与原发肿瘤相似的上皮性转移病灶[10]。发生EMT的肿瘤细胞并不完全丧失上皮性表型,在获得间质表型的同时仍然保持一定的上皮细胞特性[11]。有研究发现,上皮细胞生长因子诱导人乳头瘤病毒(HPV)阳性的头颈鳞癌细胞高表达Vimentin,但不抑制E-cadherin的表达[12]。本研究显示,Tregs诱导BT474细胞间质性标志物N-cadherin和Vimentin表达明显上升,但上皮性标志物E-cadherin的表达无明显变化,不完全丧失上皮性表型;而Tregs诱导MCF-7细胞间质性标志物N-cad⁃herin和Fibronectin高表达,上皮性标志物E-cadherin表达降低。另外,发生EMT的细胞同时伴随着迁移和侵袭能力增强,本研究通过细胞划痕、Transwell侵袭实验证实了发生EMT的BT474和MCF-7细胞的迁移和侵袭能力均有提高。
CSCs是一群具有自我更新、多向分化潜能以及肿瘤形成能力的细胞。CSCs对常规放化疗和免疫治疗等不敏感,是肿瘤治疗失败和复发、转移的根源[13]。EMT和CSCs是两个紧密联系的过程,EMT过程可以促进肿瘤细胞干性的产生。头颈部鳞癌细胞过表达EMT相关转录因子Snail后发生EMT,并获得间质性表型,同时ALDH1+干样细胞比例增加,并具有化疗抗性[14]。本研究中,Tregs可诱导BT474细胞获得ALDH1+干样细胞表型,另外在非黏附状态下连续数代形成微球体的能力与干细胞的自我更新能力相关,与Tregs共培养后的BT474细胞的微球形成能力增强,与ALDH1+干样细胞的流式细胞仪检测结果相符,并且在连续3代的传代培养中依然保持了较高的微球形成能力。以上结果说明Tregs可以直接作用于肿瘤细胞,诱导肿瘤细胞获得ALDH1+干样细胞表型和特征。
免疫细胞分泌的细胞因子如转化生长因子-β (transforming growth factor-β,TGF-β)被认为是肿瘤侵袭和转移中主要的EMT调控者之一[11]。Tregs是肿瘤微环境中TGF-β主要来源之一,TGF-β也是Tregs发挥作用的重要机制之一[15]。TGF-β信号通道的活化使永生化人乳腺上皮细胞发生EMT,同时获得干细胞的表型和特征。本研究推测Tregs可能通过TGF-β信号通路诱导肿瘤细胞发生EMT及干样细胞增加,而诱导后肿瘤干细胞的更多生物学特征以及Tregs诱导肿瘤细胞发生EMT及干样细胞增加的分子机制尚有待研究。
综上所述,本研究提示Tregs细胞除发挥免疫抑制作用外,还能直接促进肿瘤细胞发生EMT,同时促进肿瘤细胞获得干样细胞的表型和特征。肿瘤细胞一方面由于发生EMT更具有侵袭性,另一方面由于干细胞特性的增加使肿瘤细胞对免疫监视和放化疗不敏感,同时干细胞的自我更新能力增加形成转移病灶的概率,两方面相辅相成促进肿瘤的进展和转移。阐明Tregs诱导肿瘤细胞EMT和干样特征的关键机制,有助于为临床提供一个新的治疗靶点。
参考文献
[1]Redig AJ,McAllister SS.Breast cancer as a systemic disease:a view of metastasis[J].J Intern Med,2013,274(2):113-126.
[2]Gomes LR,Terra LF,Sogayar MC,et al.Epithelial-mesenchymal transition:implications in cancer progression and metastasis[J].Curr Pharm Biotechnol,2011,12(11):1881-1890.
[3]Li S,Li Q.Cancer stem cells and tumor metastasis(Review)[J].Int J Oncol,2014,44(6):1806-1812.
[4]Iqbal J,Chong PY,Tan PH.Breast cancer stem cells:an update[J].J Clin Pathol,2013,66(6):485-490.
[5]Fuxe J,Karlsson MC.TGF-β-induced epithelial-mesenchymal transition:a link between cancer and inflammation[J].Semin Cancer Biol,2012,22(5-6):455-461.
[6]Chang WC,Li CH,Huang SC,et al.Clinical significance of regulatory T cells and CD8+effector populations in patients with human endometrial carcinoma[J].Cancer,2010,116(24):5777-5788.
[7]Liyanage UK,Moore TT,Joo HG,et al.Prevalence of regulatory T cells is increased in peripheral blood and tumor microenvironment of patients with pancreas or breast adenocarcinoma[J].J Immunol,2002,169(5):2756-2761.
[8]Acloque H,Adams MS,Fishwick K,et al.Epithelial-mesenchymal transitions:the importance of changing cell state in development and disease[J].J Clin Invest,2009,119(6):1438-1449.
[9]De Craene B,Berx G.Regulatory networks defining EMT during cancer initiation and progression[J].Nat Rev Cancer,2013,13(2):97-110.
[10]Foroni C,Broggini M,Generali D,et al.Epithelial-mesenchymal transition and breast cancer:role,molecular mechanisms and clinical impact[J].Cancer Treat Rev,2012,38(6):689-697.
[11]Katsuno Y,Lamouille S,Derynck R.TGF-β signaling and epithelialialmesenchymal transition in cancer progression[J].Curr Opin Oncol,2013,25(1):76-84.
[12]Umbreit C,Flanjak J,Weiss C,et al.Incomplete epithelial-mesenchymal transition in p16-positive squamous cell carcinoma cells correlates with β-catenin expression[J].Anticancer Res,2014,34(12):7061-7069.
[13]Mallini P,Lennard T,Kirby J,et al.Epithelial-to-mesenchymal transition:what is the impact on breast cancer stem cells and drug resistance[J].Cancer Treat Rev,2014,40(3):341-348.
[14]Masui T,Ota I,Yook JI,et al.Snail-induced epithelial-mesenchymal transition promotes cancer stem cell-like phenotype in head and neck cancer cells[J].Int J Oncol,2014,44(3):693-699.
[15]Strauss L,Bergmann C,Szczepanski M,et al.A unique subset of CD4+CD25 highFoxp3+T cells secreting interleukin-10 and transforming growth factor-β1 mediates suppression in the tumor microenvironment[J].Clin Cancer Res,2007,13(15 Pt 1):4345-4354.
(2015-11-17收稿)
(2016-02-17修回)
(编辑:张亻抿校对:武斌)

孙立平专业方向为肿瘤免疫研究。E-mail:sunliping3344@163.com
·临床研究与应用·
作者简介
通信作者:李慧lihui@tjmuch.com
doi:10.3969/j.issn.1000-8179.2016.05.277
作者单位:①天津医科大学肿瘤医院免疫室,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市肿瘤免疫与生物治疗重点实验室(天津市300060);②南通大学附属医院肿瘤化疗科;③天津医科大学肿瘤医院胃肠肿瘤生物学研究室
