淋巴结阴性结肠癌伴同时性肝转移患者的临床病理因素分析*
2016-04-08张成海苏向前崔明邢加迪杨宏姚震旦张楠
张成海 苏向前 崔明 邢加迪 杨宏 姚震旦 张楠
淋巴结阴性结肠癌伴同时性肝转移患者的临床病理因素分析*
张成海苏向前崔明邢加迪杨宏姚震旦张楠
摘要目的:分析淋巴结阴性结肠癌患者发生同时性肝转移的危险因素,提高高危患者随访的效率和早诊率。方法:回顾性分析2008年1月至2012年12月就诊北京肿瘤医院胃肠肿瘤中心并且行手术治疗的140例淋巴结阴性结肠癌患者临床病理资料,通过单因素和多因素分析,研究淋巴结阴性结肠癌同期肝转移的高危因素。结果:140例淋巴结阴性结肠癌患者同期肝转移13例(9.2%),61.5%(8/13例)的患者伴有不全性结肠梗阻,6例患者接受原发灶和肝转移灶同期手术治疗。单因素分析和多因素分析均提示脉管浸润(P=0.010)和术前CEA水平异常(P=0.004)是淋巴结阴性结肠癌患者发生同时性肝转移的独立危险因素。结论:淋巴结阴性结肠癌存在较高的同时性肝转移风险,脉管浸润和术前CEA水平异常是这类患者发生同期肝脏转移的高危因素,对具有该特征的患者在就诊时或根治术后应该针对性地检查肝脏情况,避免漏诊。
关键词结肠癌同时性肝脏转移淋巴结阴性危险因素
*本文课题受国家自然科学基金项目(编号:81272766)、北京市医院管理局临床医学发展专项经费(编号:XM201309)和北京大学“985工程”三期临床医院合作专项资助
Analysis of clinicopathological factors for node-negative colon cancer patients with synchronous liver metastases
Chenghai ZHANG,Xiangqian SU,Ming CUI,Jiadi XING,Hong YANG,Zhendan YAO,Nan ZHANG
Correspondence to:Xiangqian SU;E-mail:suxiangqian@bjmu.edu.cn
Department of Gastrointestinal SurgeryⅣ,Peking University Cancer Hospital &Institute,Key Laboratory of Carcinogenesis and Translational Research(Ministry of Education),Beijing 100142,China
This work was supported by the National Natural Science Foundation of China(No.81272766),Beijing Municipal Administration of Hospitals Clinical Medicine Development of Special Funding Support(No.XM201309),Peking University(PKU)985 Special Funding for Collaborative Research with PKU Hospitals
Abstract Objective:To explore the clinicopathological factors in node-negative colon cancer patients with synchronous liver metastases and to improve the efficiency of follow-up and rate of early diagnosis for high-risk patients.Methods:Clinical data of 140 colon cancer patients who underwent operation from January 2008 to December 2012 in Beijing Cancer Hospital were analyzed.The highrisk variables associated with synchronous liver metastases were subjected to univariate and multivariate analyses.Results:Synchronous liver metastases developed in 13 out of the 140 node-negative colon cancer patients.Eight out of those 13 patients(61.5%)exhibited complications with incomplete colon obstruction,and 6 cases underwent surgical treatment for both primary tumor and liver metastases.Both univariate and multivariate analyses revealed that preoperative abnormal serum carcinoembryonic antigen levels(≥5 ng/mL)and vascular invasion were significant independent risk factors for synchronous liver metastases.Conclusion:The risk of synchronous liver metastases for colon cancer patients with negative lymph node is slightly high.Vascular invasion and abnormal preoperative CEA levels are significant independent risk factors for synchronous liver metastases.Specific examination of livers is necessary for the special cohort at the time of diagnosis or after operation to avoid misdiagnosis.
Keywords:colon cancer,synchronous liver metastases,lymph node-negative,risk factors
肝脏是结肠癌患者最常见的转移靶器官。临床实践中发现,大约有15%~25%的结肠癌患者就诊时即发现肝脏转移,即同时性肝转移,并且其中70%~80%的患者只局限于肝转移[1-4]。特别是当患者的肝脏结节<1 cm,甚至<5 mm,影像学很难做出肝转移诊断,往往在后期复查中发现继续增大,才考虑是转移病灶。但在初始治疗方案中未按照结肠癌肝转移的原则进行,因此不能给予患者及时有效的治疗。
此外,临床中经常遇到淋巴结阴性的结肠癌患者发生同时性肝转移[5]。因此,总结这部分患者的临床病理资料,分析淋巴结阴性结肠癌患者发生同时性肝转移的高危因素,来指导临床实践,尤其是提高对微小肝转移患者的重视。
1 材料与方法
1.1研究对象
收集2008年1月至2012年12月就诊北京肿瘤医院并且接受手术治疗的结肠癌患者资料。纳入标准:肿瘤位于结肠,术后病理诊断为腺癌;无淋巴结转移;限于肝转移;无合并其他恶性肿瘤。排除标准:原发灶未接受手术治疗患者;合并其它恶性肿瘤;除肝转移外,还有其它部位转移;淋巴结阳性患者;临床资料不完善患者。最终纳入研究患者为140例,男性85例(60.7%),女性55例(39.3%)。
1.2方法
1.2.1研究方法根据研究目的将纳入研究病例分为两组,以发生同时性肝转移患者为研究组(13例),未发生同时肝转移转移患者为对照组(127例)。通过单因素和多因素分析了解同时性肝转移患者的危险因素。同时严密随访患者,了解13例同时性肝转移患者的生存情况。
1.2.2同时性肝转移定义及肝转移诊断方法患者初次就诊时发生肝转移或结肠癌术后1个月内发生的肝转移,定义为同时性肝转移。肝转移诊断主要通过增强MRI,当肿瘤较小(<10 mm)或MRI转移表现不明确时辅以超声造影,如仍未确定,必要时行PET/CT检查明确。
1.3统计学分析
所有统计分析通过SPSS 16.0统计软件进行。同时性肝转移的单因素分析中,计数资料的比较分析运用χ2检验,在统计过程中将年龄、肿瘤大小、术前CEA水平转化为计数资料进行分析;多因素分析中,采用Logistic回归模型,筛选出与同时性肝转移相关的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1同时性肝转移患者基本情况
140例接受原发灶切除的淋巴结阴性结肠癌患者中,13例发生同时性肝转移。其中女性2例,男性11例;平均年龄61.5(47~81)岁,多数患者伴有肠腔狭窄,不全性结肠梗阻(8/13例);行肝转移灶切除患者6例,其中包括转移结节活检2例;所有患者术后均行全身化疗,主要应用奥沙利铂联合氟尿嘧啶化疗方案;平均清扫淋巴结数目16.3(10~42)枚;T分期偏晚,除1例T1期外,其余至少为T3期。中位生存时间11(5~83)个月。同时性肝转移患者具体临床病理特征见表1,2。
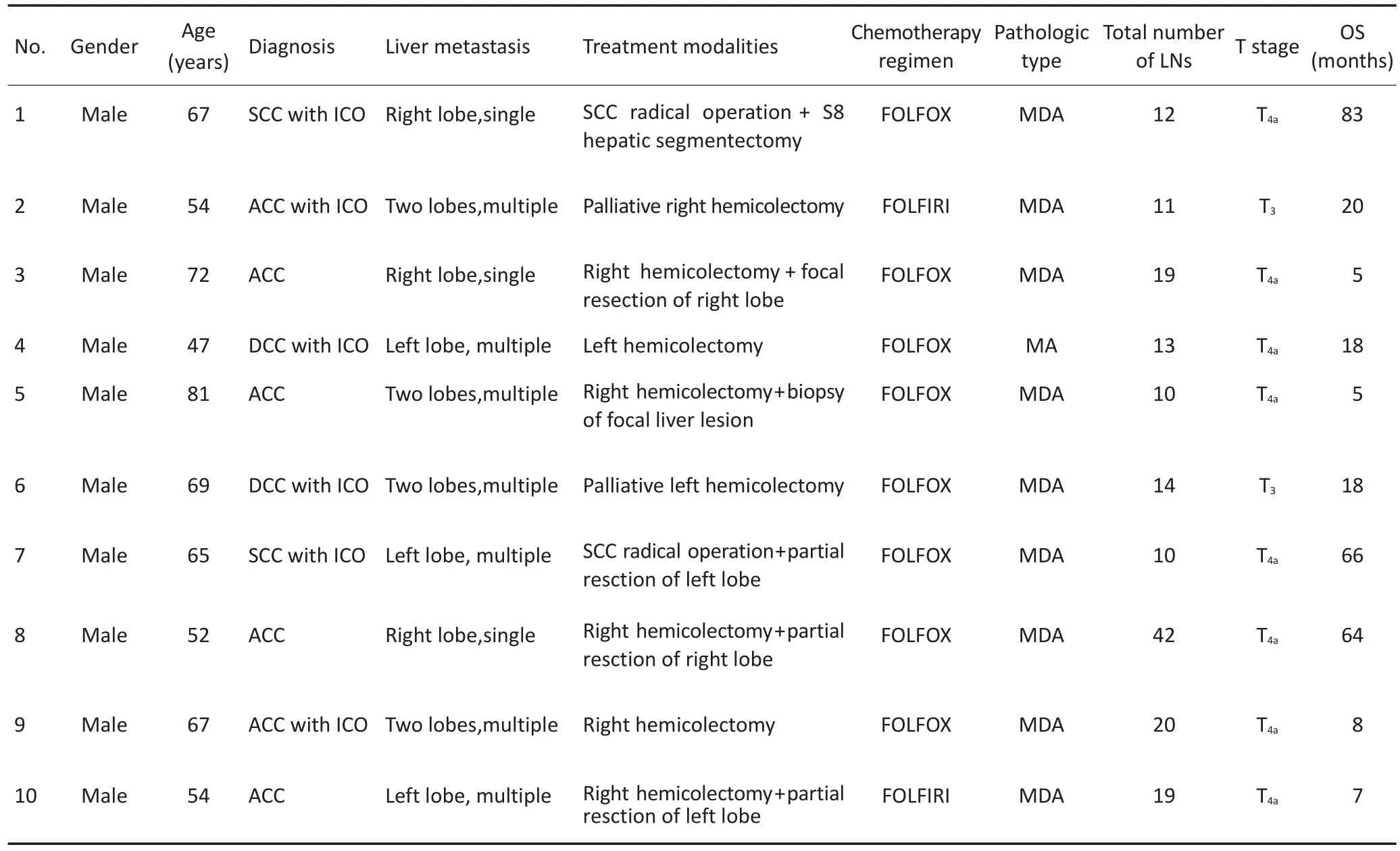
表1 同时性肝转移患者的临床特征及治疗情况Table 1 Clinical features and treatment modalities of colon cancer patients with synchronous liver metastases
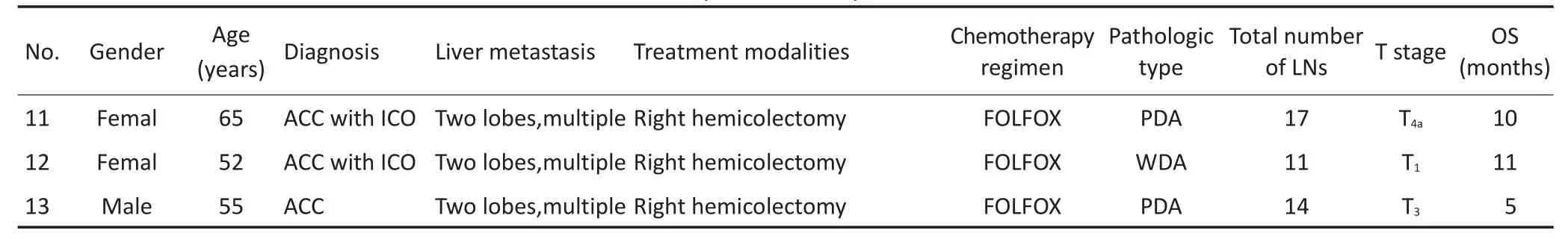
表1 同时性肝转移患者的临床特征及治疗概况(续表1)Table 1 Clinical features and treatment modalities of colon cancer patients with synchronous liver metastases
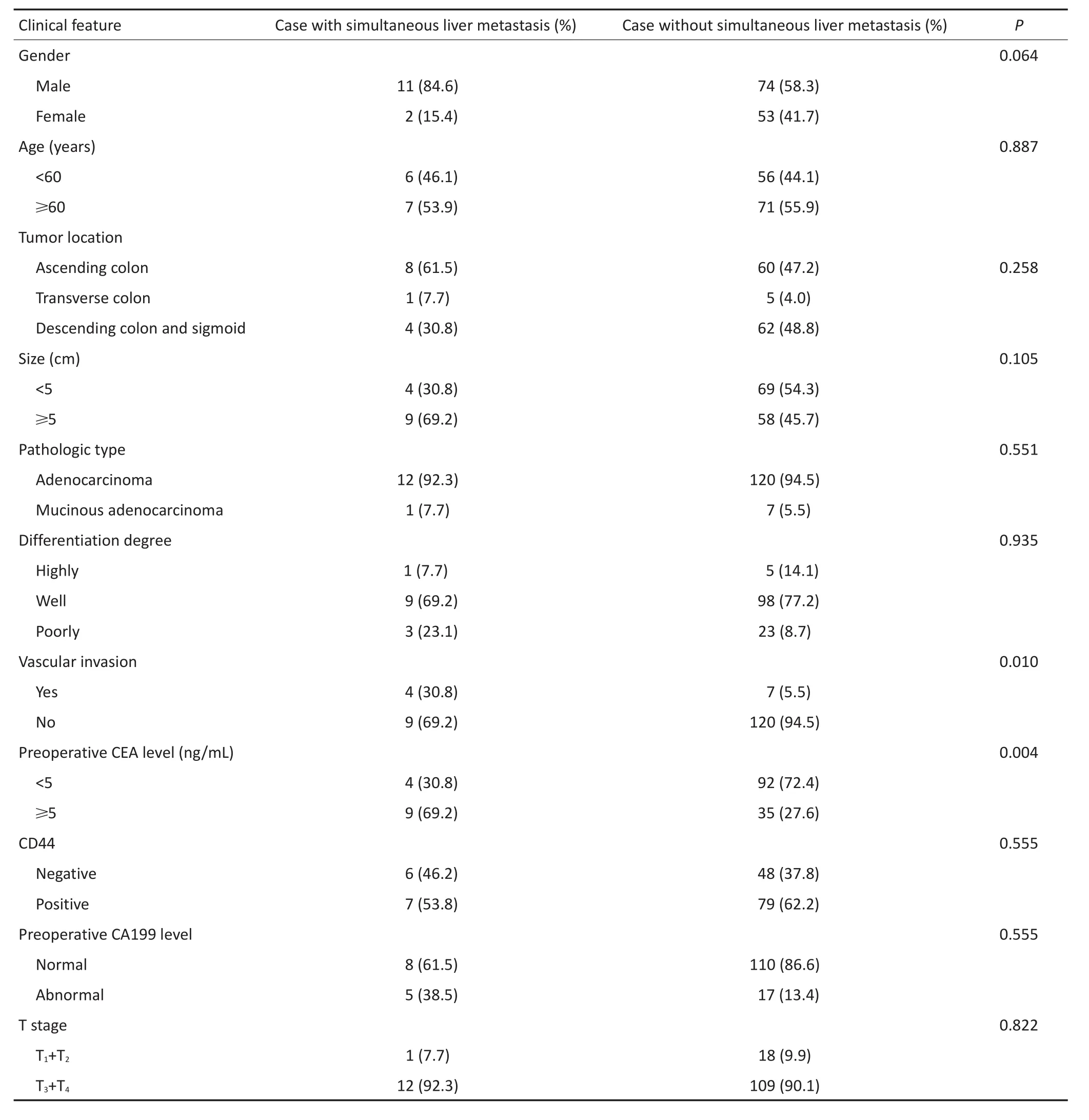
表2 同时性肝转移患者临床特征及单因素分析结果 n(%)Table 2 Clinical features and univariate analysis results of colon patients with synchronous liver metastases

表2 同时性肝转移患者临床特征及单因素分析结果 n(%)(续表2)Table 2 Clinical features and univariate analysis results of colon patients with synchronous liver metastases
2.2结肠癌同时性肝转移危险因素的单因素分析
本研究中脉管浸润是影响结肠癌同时性肝转移的危险因素(P=0.010)。13例同时性肝转移患者中有4例脉管浸润;在纳入分析的140例结肠癌患者中,脉管浸润11例,其中36.4%(4/11例)的患者发生同时性肝转移。术前CEA≥5 ng/mL也是结肠癌同时性肝转移的高危因素(P=0.004),13例同时性肝转移患者有9例(69.2%)患者术前CEA≥5 ng/mL。其余临床病理因素并不是结肠癌同时性肝转移的危险因素(P>0.05,表2)。
2.3结肠癌同时性肝转移危险因素的多因素分析
将12项与结肠癌同时性肝转移可能相关的临床病理因素纳入Logistic回归模型进行多因素分析,结果显示脉管浸润(P=0.047)及术前CEA≥5 ng/mL(P= 0.014)仍然是结肠癌同时性肝转移的独立危险因素(表3)。
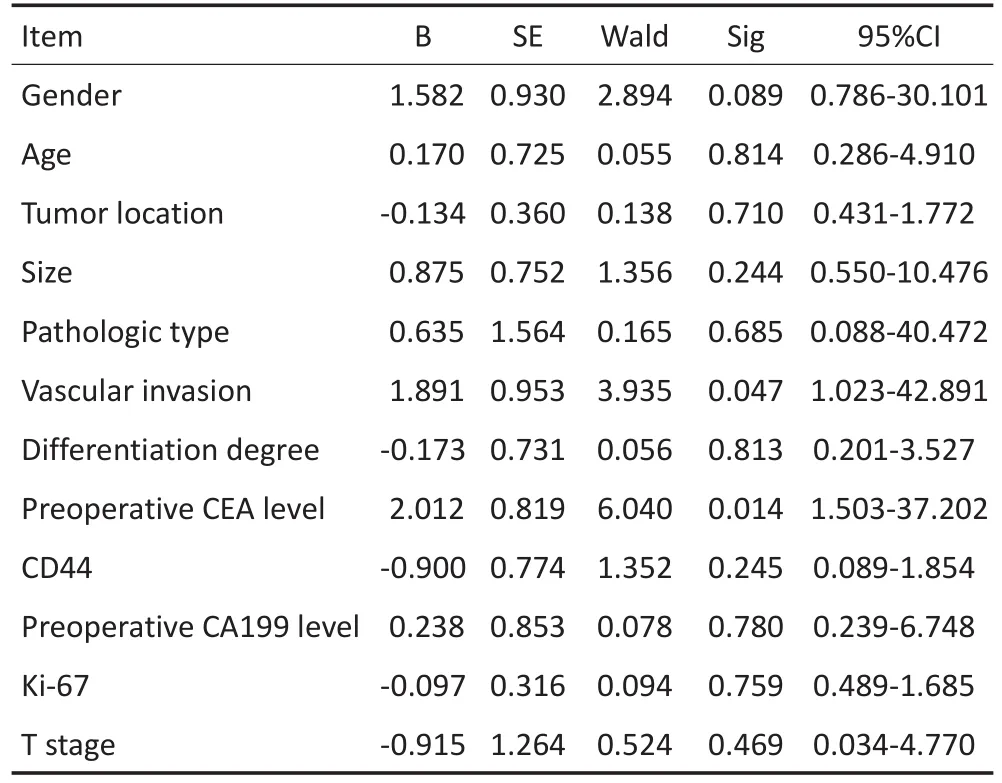
表3 Logistic多因素分析结肠癌同时性肝转移的相关因素Table 3 Logistic multivariate analysis of colon cancer patients with synchronous liver metastases
3 讨论
淋巴结阴性结肠癌伴同时性肝转移者,癌细胞基本是经过血道途径转移到肝脏。这主要是由解剖学特点决定,门静脉系统存在于肠道血液系统和肝脏血管网之间,癌细胞经过门脉系统转移至肝脏,有时甚至早于淋巴系统转移。结肠癌早期肝转移,治疗效果好,但往往早期肝转移病灶在影像学诊断中容易漏诊或不能确诊。而肝转移病灶进展至影像学表现典型转移征象时,一般无根治性手术机会。因此,通过结肠癌同时性肝转移高危因素的提示并进一步结合影像学表现,早期发现同时性肝转移,并给予及时治疗,提高患者预后。
同时性肝转移患者的治疗方式主要与原发灶的症状和肝转移数目、大小、位置有关。对于初始肝转移灶可切除患者,如果身体状况允许,可行原发灶和肝转移灶同期切除或分期手术治疗。对肝转移灶初始不可切除,可采取转化性化疗,获得手术机会后行同期或分期手术治疗。但如果患者合并结肠梗阻或穿孔情况下,可考虑先行原发灶手术切除,术后给与辅助治疗,争取患者肝转移灶的手术机会[6]。本组手术的61.5%(8/13例)同时性肝转移患者多数伴有不全性结肠梗阻表现,部分患者原发灶和肝转移灶能够同期切除。围手术期化疗主要以奥沙利铂+氟尿嘧啶类联合化疗方案为主,部分患者联合靶向药物治疗。本组患者最长生存时间为83个月,最短为5个月。有报道[4,7-8]肝转移灶切除患者的5年生存率为25%~58%,而肝转移未手术切除患者的5年生存率<5%。
研究提示脉管浸润是结肠癌发生同时性肝转移的独立危险因素。肿瘤组织微血管密度大,癌细胞容易侵及血管形成癌栓,通过门脉系统进入肝脏,形成肝转移灶[9]。如果患者术后病理提示脉管浸润,即使无淋巴结转移,也要警惕肝转移的风险,尤其对于术前肝内有微小结节(<5 mm)的结肠癌患者。研究提示,在结直肠癌肝转移的诊断方面,相比腹部增强CT,核磁共振具有相似的诊断敏感性和更优的特异性,更具无创性[10]。
CEA不仅是结直肠癌术后重要预后指标[11-13],其术前CEA水平异常也是淋巴结阴性结肠癌发生同时性肝转移的高危因素。CEA是肿瘤细胞表面糖蛋白和免疫球蛋白类细胞黏附分子功能类似,能够反应人体内肿瘤细胞负荷,并参与胞内信号识别及促进肿瘤细胞与宿主细胞的黏附[14-16]。循环血CEA由肝脏清除,与肝细胞结合后可作为黏附循环肿瘤细胞的受体,因此CEA在结肠癌肝脏转移中发挥重要作用。结肠癌分泌大量CEA,可导致癌细胞连接松弛、排列紊乱、促进癌细胞迁移、脱落[17]。本研究表明,术前CEA水平在两组中差异显著,同时性肝转移组术前CEA异常比例占69.2%,非转移组CEA异常比例仅为27.6%。因此,在临床实践中,淋巴结阴性的结肠癌患者如果术前CEA水平明显异常,注意可能伴有同时性肝转移的风险。
本研究发现性别、年龄、肿瘤大小、位置、病理类型、分化程度、浸润深度、CD44状态、术前CA199水平及Ki-67指数与淋巴结阴性结肠癌发生同时性肝转移无显著相关性。本组肝转移患者中甚至有1例T1期患者发生同时性肝转移,也说明了结肠癌经血道肝转移有时会早于淋巴转移。有报道CA199水平可以预测结肠癌患者术后或化疗后的复发风险[18],但本研究没有提示术前CA199水平影响淋巴结阴性结肠癌发生同时性肝转移的可能。
通过本研究提示,对于伴有脉管浸润和(或)术前CEA水平异常的结肠癌患者,即使无淋巴结转移,也有发生同时性肝转移的风险。尤其是术前发现肝脏微小结节同时合并了肝转移的高危因素,在普通影像学检查不能确定性质时,建议行肝脏增强核磁共振或超声造影检查,可早期发现或明确肝转移灶,提高患者治愈机会。
参考文献
[1]Borner MM.Neoadjuvant chemotherapy for unresectable liver metastases of colorectal cancer–too good to be true[J].Ann Oncol,1999,10(6):623-626.
[2]Manfredi S,Lepage C,Hatem C,et al.Epidemiology and management of liver metastases from colorectal cancer[J].Ann Surg,2006,244(2):254-259.
[3]Mantke R,Schmidt U,Wolff S,et al.Incidence of synchronous liver metastasis in patients with colorectal cancer in relationship to clinicpathologic characteristics.Results of a German prospective multicenter observational study[J].Eur J Surg Oncol,2012,38(3):259-265.
[4]Noren A,Eriksson HG,Olsson LI.Selection for surgery and survival of synchronous colorectal liver metastases;a nationwide study[J].European Journal of Cancer,2015,53(2016):105-114.
[5]Song CG,Lu HS,Zhang FX,et al.Clinical significance of risk factors analysis in colorectal carcinoma associated with liver metastasis[J].Jounal of Fujian Medical University,2001,31(s1):51-53.[宋传贵,卢辉山,张祥福,等.结肠癌肝转移高危因素探讨及其临床意义[J].福建医科大学学报,2001,31(s1):51-53.]
[6]Adam R,de Gramont A,Figueras J,et al.Managing synchronous liver metastases from colorectal cancer:A multidisciplinary international consensus[J].Cancer Treatment Reviews,2015,41(9):729-741.
[7]Adam R,Avisar E,Ariche A,et al.Five-year survival following hepatic resection after neoadjuvant therapy for nonresectable colorectal[J].Ann Surg Oncol,2001,8(4):347-353.
[8]Kanas GP,Taylor A,Primrose JN,et al.Survival after liver resection in metastatic colorectal cancer.Review and meta-analysis of prognostic factors[J].Clin Epidemiol,2012,4(6):283-301.
[9]Bognar G,Imdahl A,Bereczky B,et al.Prognostic role of vascularization and proliferation in rectal cancer with liver metastasis[J].Magy Seb,2009,62(1):15-21.
[10]Baqia JS,Chai A,Chou R,et al.Prospective diagnostic test accuracy comparison of computed tomography during arterial portography and Primovist magnetic resonance imaging in the pre-operative assessment of colorectal cancer liver metastases[J].HPB,2015,17(10):927-935.
[11]Thirunavukarasu P,Sukumar S,Sathaiah M,et al.C-stage in colon cancer:Implications of carcinoembryonic antigen biomarker in staging,prognosis,and management[J].J Natl Cancer Inst,2011,103(8):689-697.
[12]Lin BR,Lin YL,Lai HS,et al.Overall survival of stageⅢcolon cancer with only one lymph node metastasis is independently predicted by preoperative carcinoembryonic antigen level and lymph node sampling status[J].PLoS One,2015,10(9):1-10.
[13]Sakamoto Y,Miyamoto Y,Beppu T,et al.Post-chemotherapeutic CEA and CA19-9 Are Prognostic Factors in Patients with Colorectal Liver Metastases Treated with Hepatic Resection After Oxaliplatin-based Chemotherapy[J].Anticancer Research,2015,35(4):2359-2368.
[14]Regnard JF,Grunenwald D,Spaggiari L,et al.Surgical treatment of hepatic and pulmonary metastases from colorectal cancers[J].Ann Thorac Surg,1998,66(1):214-218.
[15]Gutman M,Fidler IJ.Biology of human colon cancer metastasis[J].World J Surg,1995,19(2):226-234.
[16]Honqliang C,Shaojun H,Aihual L,et al.Correlation between expression of miR-155 in colon cancer and serum carcinoembryonic antigen level and its contribution to recurrence and metastasis forecast[J].Saudi Med,2014,35(6):547-553.
[17]Yoshioka T,Masuko T,Kotanagi H,et al.Homotypic adhesion through carcinoembryonic anti gen plays a role in hepatic metastasis development[J].Jpn J Cancer Res,1998,89(2):177-185.
[18]Park IJ,Choi GS,Jun SH.Prognosticvalueofserumtumorantigen CA19-9 after curative resection of colorectal cancer[J].Anticancer Res,2009,29(10):4303-4308.
(2016-01-14收稿)
(2016-02-05修回)
(编辑:周晓颖校对:杨红欣)

张成海专业方向为胃肠道肿瘤的综合治疗及临床研究。
E-mail:drchenghaizhang@163.com
·临床研究与应用·
作者简介
通信作者:苏向前suxiangqian@bjmu.edu.cn
doi:10.3969/j.issn.1000-8179.2016.05.031
作者单位:北京肿瘤医院暨北京市肿瘤防治研究所胃肠肿瘤中心四病区,恶性肿瘤发病机制及转化研究教育部重点实验室(北京市100142)
