不同浓度锶对 MC3T3-E1 细胞增殖、ALP 活性及成骨分化的影响
2016-04-08李忠海韩丽伟赵彦涛杨枭雄衷鸿宾王福利侯树勋
李忠海 韩丽伟 赵彦涛 杨枭雄 衷鸿宾 王福利 侯树勋
不同浓度锶对 MC3T3-E1 细胞增殖、ALP 活性及成骨分化的影响
李忠海 韩丽伟 赵彦涛 杨枭雄 衷鸿宾 王福利 侯树勋
( 81201380 );军事医学项目 ( 13CXZ028,AWS14C007 );北京市科技新星项目 ( Z1511000003150134 )
作者单位:100048 北京,解放军总医院第一附属医院、全军骨科研究所、北京市骨科植入医疗器械工程技术研究中心通信作者:赵彦涛,Email: 45828016@qq.com
【摘要】目的 观察不同浓度锶 ( Sr ) 对 MC3T3-E1 细胞增殖、碱性磷酸酶 ( alkaline phosphatase,ALP ) 活性及成骨分化的影响规律。方法 体外培养 MC3T3-E1 细胞,将浓度不同的 Sr 作用于成骨细胞系MC3T3-E1 细胞,利用 MTT 法检测细胞增殖活性,PNPP 法检测细胞 ALP 活性,RT-PCR 法检测几种成骨标志分子 mRNA 的表达情况。结果 Sr 离子浓度>500 μg / ml 时,成骨细胞增殖明显降低,生长受到抑制;浓度在 3.91~250.00 μg / ml 时,促进作用达到最高水平;之后随着浓度降低,促进作用逐渐减弱。在观察范围内,Sr 对成骨细胞 ALP 活性的影响呈明显的浓度依赖性,Sr 能显著的增加 MC3T3-E1 的 ALP 活性,浓度在3.91~125 μg / ml 范围时,成骨细胞 ALP 活性显著提高。RUNX2、ALP、Col1 等 mRNA 的表达量随 Sr 的浓度在一定范围内逐渐升高,Sr 浓度为 31.25 μg / ml 左右时,其 mRNA 表达量达到峰值。结论 Sr 促进成骨细胞的增殖和分化具有显著的剂量依赖关系,超过最优浓度范围其促进作用下降,在一定阈值后甚至会出现毒性抑制作用。
【关键词】锶;成骨细胞;细胞分化;细胞增殖;生物活性
锶 ( Sr ) 是与钙元素同族的碱土金属元素,是人体骨中必需元素之一。在成骨活性元素的研究中,人们发现 Sr 具有促进骨形成和抑制骨吸收的双重作用。在骨质发生的早期,缺乏 Sr 可以导致骨形成不足及骨钙化不良,新骨形成的初期,Sr 离子的浓度较高,随着骨基质的成熟,Sr 离子逐渐被钙离子替换,Sr 离子在骨基质中保持一定的比例以维持骨质的正常功能;而骨质中 Sr 的含量还与骨质的抗压强度大小密切相关[1]。目前研究表明,Sr 可以显著促进成骨细胞的生长复制,刺激新骨形成;体外成骨前体细胞培养中发现,含 Sr 组细胞培养 24 h 后,DNA 合成量是空白组的 3~4 倍,而成骨细胞内的胶原和非胶原蛋白增加了 35%[2-4]。然而,Sr 离子对成骨细胞的增殖及分化的浓度依赖性范围及其具体影响规律未见相关报道。本实验将浓度不同的 Sr 作用于成骨细胞系 MC3T3-E1 细胞,观察不同浓度 Sr对成骨细胞的增殖及分化的影响,以期为目前各种掺 Sr 材料的研究和应用提供参考依据。
资料与方法
一、实验材料与设备
SrCl2( 国药,中国 )、α-MEM 培养基 ( Gibco,美国 )、特级胎牛血清 ( Hyclone,美国 )、双抗( Hyclone,美国 )、0.25% 胰蛋白酶 ( Hyclone,美国 )、MTT 试剂 ( Sigma,美国 )、PNPP ( 大连美仑生物 )、MgCl2( 北京化工厂,中国 )、二乙醇胺 ( 大连美仑生物,中国 )、RT 试剂盒 ( 宝生生物,中国 )、PCR 试剂盒 ( 宝生生物,中国 )、PCR 引物 ( 上海生工合成,中国 )。
二、实验方法
1. 细胞培养:MC3T3-E1 细胞用含 10% FBS 的α-MEM 培养基常规培养。细胞 80% 融合时,接种到细胞培养板。用 PBS 洗涤细胞 1 次,然后加入 0.25%胰酶进行消化,1000 r / min 离心 5 min 后用含 10% FBS 的 α-MEM 培养基重悬细胞,调整细胞密度为2×104/ ml。96 孔板每孔接种 100 μl,12 孔板每孔接种 2 ml。
2. 药物干预:细胞接种到培养板 24 h 后,每组分别加入 2000.00、1000.00、500.00、250.00、125.00、62.50、31.25、15.63、7.81、3.91、1.95、0.98、0.49、0.24 μg / ml 的 Sr 进行药物干预。
3. MTT 实验:药物干预 72 h 后,取其中一个 96孔板进行 MTT 实验。弃去原培养基后,用 PBS 洗涤细胞 1 次,加入用 α-MEM 培养基稀释的 5 mg / ml 的 MTT 溶液,每孔 100 μl。37 ℃ 孵育 4 h,弃上清液,加 DMSO 150 μl,震荡 10 min,490 nm 波长检测吸光度,计算相对增殖率。
4. PNPP 法检测细胞碱性磷酸酶 ( alkaline phosphatase,ALP ) 活性:细胞加药干预 72 h 后,取另一个 96 孔板进行 ALP 活性的测定。PNPP 反应液的配制:6.7 mmol / L PNPP、25 mmol / L 二乙醇胺、1 mmol / L MgCl2溶于 PBS ( pH 7.4 ) 中。弃去原培养基,用 PBS 冲洗细胞 1 次,每孔加上述 PNPP 反应液 100 μl,30 min 后加 0.1 N 氢氧化钠终止反应,405 nm 波长检测吸光度。
5. 细胞总 RNA 的提取:细胞加药干预 72 h 后取 12 孔板进行细胞总 RNA 的提取。弃去原培养基,用 PBS 冲洗 1 次。每孔加入 TRIzol 溶液 0.5 ml,静置5 min 后反复吹打细胞,使其裂解,将裂解液收集到1.5 ml 无 RNA 酶离心管中。每管加入 0.1 ml 氯仿,剧烈混匀,静置 5 min 后 4 ℃、12 000 g 离心 15 min。离心后液体分层,取上层透明水相到另一个 1.5 ml 离心管中,加入等体积的异丙醇,混匀后静置 5 min,4 ℃、12 000 g 离心 15 min。离心后弃去管中液体,用 75% 乙醇洗涤沉淀,4 ℃、7500 g 离心 15 min。离心后弃去液体,晾干沉淀,用 10 μl 无 RNA 酶水溶解。紫外分光光度计检测总 RNA 的浓度及纯度。
6. RT-PCR 反应:取待测样品总 RNA 100 ng 进行逆转录反应合成 cDNA。将生成的 cDNA 稀释成100 ng / μl,取 1 μl 稀释后的 cDNA 进行 RT-PCR 反应。按照表 1 配制成 PCR 反应体系。反应条件见表 2,引物序列见表 3。
7. 细胞生长形态观察:分别在培养 1 天和 3 天时间点用倒置显微镜记录细胞生长状态。
三、统计学分析
应用 SPSS 11.0 软件进行统计学处理,数据用x-±s 来表示,采用 t 检验进行分析。P<0.05 为差异有统计学意义。

表 1 PCR 反应体系Tab.1 PCR reaction system
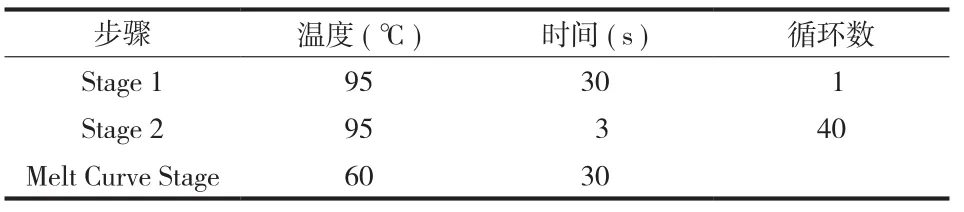
表 2 PCR 反应条件Tab.2 PCR reaction conditions
结 果
一、不同浓度 Sr 对 MC3T3-E1 细胞增殖的影响
MTT 实验提示,Sr 浓度为 1.95 μg / ml 时开始促进细胞的增殖 ( P<0.05 ),到 Sr 浓度为 3.91~250.00 μg / ml 时促进作用达到较高水平 ( P<0.05 ),继续增大 Sr 浓度,细胞增殖活力开始下降,至超过500 μg / ml 浓度时出现了细胞毒性,增殖抑制作用随浓度增加显著增强,在 8 mg / ml 以上浓度细胞不能存活 ( 图 1 )。
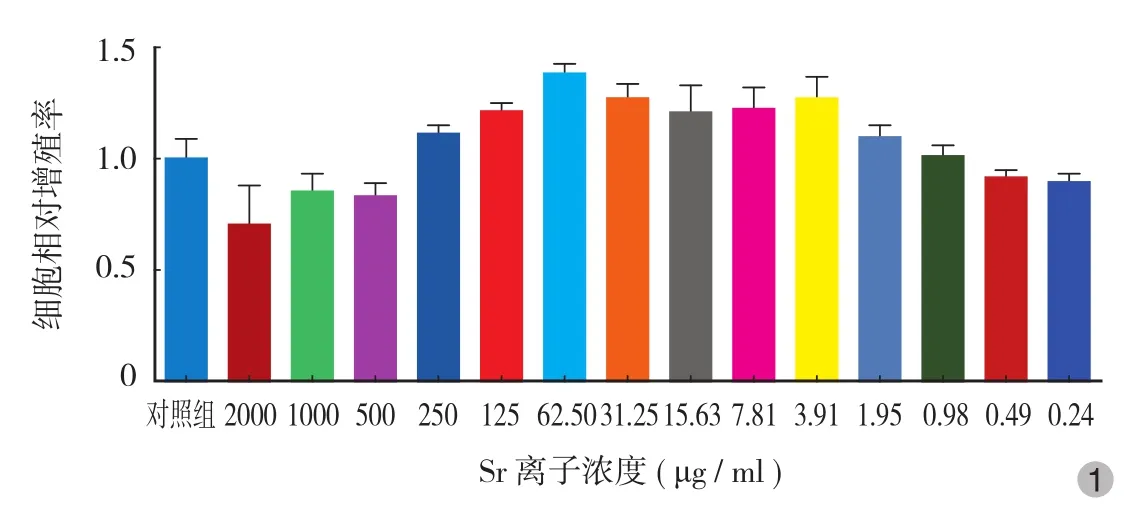
图 1 Sr 对 MC3T3-E1 细胞增殖的影响情况Fig.1 Effects of strontium on the proliferation of MC3T3-E1 cells
二、不同浓度 Sr 对 MC3T3-E1 细胞 ALP 活力的影响
Sr 浓度为 1.95 μg / ml 时,ALP 活性出现升高趋势;随着浓度达到 3.91~125 μg / ml 范围时,ALP 活性显著提高 ( P<0.05 );Sr 浓度至 250 μg / ml 时,ALP活力显著降低 ( P<0.05 ),水平接近对照组 ( 图 2 )。
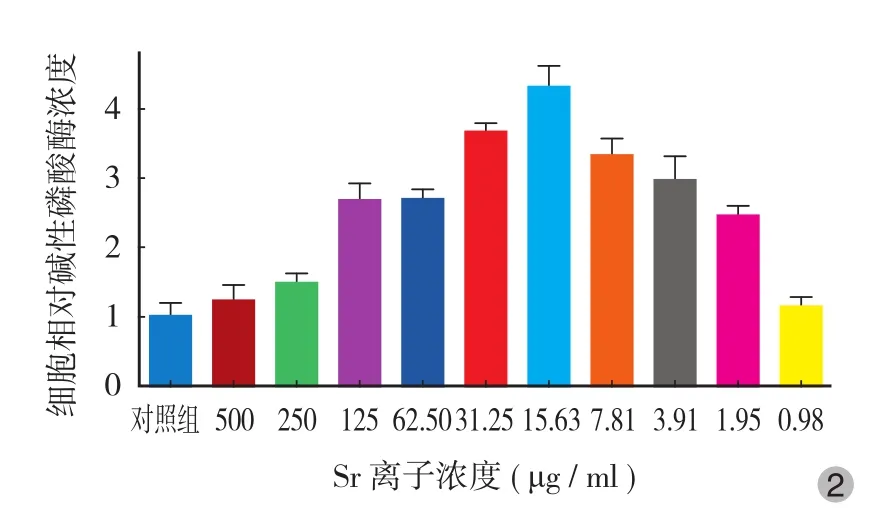
图 2 Sr 对 MC3T3-E1 细胞 ALP 活力的影响情况 ( 7 天 )Fig.2 Effects of strontiumon ALP activity in MC3T3-E1 cells ( 7 days )
三、不同浓度 Sr 对 MC3T3-E1 细胞成骨特异性分子基因表达的影响
从 RT-PCR 实验可以看出,ALP、COL1α 以及转录因子 RUNX2 的 mRNA 含量均在加入 31.25 μg / ml Sr 后明显升高 ( P<0.05 ),在此基础上加大或减小 Sr的用量,其表达水平均下降,在高浓度 250 μg / ml时已接近对照组水平,在低浓度 7.81 μg / ml 时其促进效应也接近对照组水平 ( 图 3~5 )。
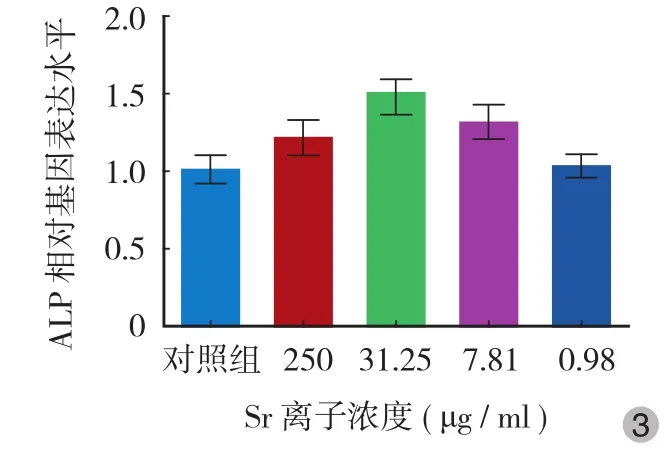
图 3 不同浓度 Sr 对 MC3T3-E1 细胞 ALP 表达水平的影响Fig.3 Effects of different concentrations of strontiumon on the expression of ALP in MC3T3-E1 cells
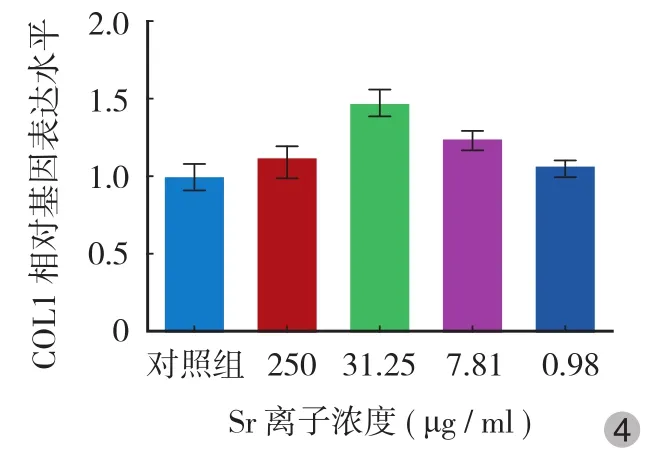
图 4 不同浓度 Sr 对 MC3T3-E1 细胞 COL1 表达水平的影响Fig.4 Effects of different concentrations of strontium on the expression of COL1 in MC3T3-E1 cells
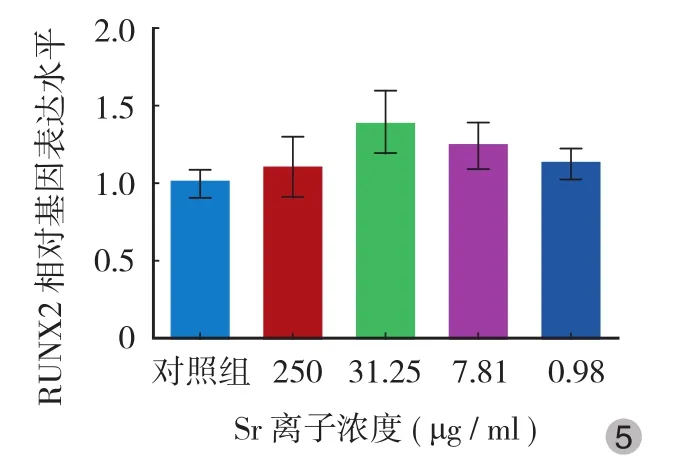
图 5 不同浓度 Sr 对 MC3T3-E1 细胞 RUNX2 表达水平的影响Fig.5 Effects of different concentrations of strontium on the expression of RUNX2 in MC3T3-E1 cells
四、细胞的显微镜观察
显微镜观察可见,成骨细胞成三角或多角形外观。观察后 1 天细胞贴壁,伸展形态正常,细胞折光度良好,胞质透亮,外观平滑饱满。细胞成群集落样生长,推测这种聚集现象为细胞贴壁后增殖分裂而成,两组细胞形态无显著差异 ( 图 6 )。观察后3 天细胞密度显著增加,尤以加入 31.25 μg / ml Sr组细胞密度更高,细胞间空隙较少,已接近长成平层。细胞折光度依然良好,胞质透亮,外观平滑饱满,表现为旺盛增殖期的细胞状态。对照组第 3 天时可见一些细胞出现胞质内颗粒,少部分细胞有类似老化现象,且细胞间空隙多,细胞密度低于实验组 ( 图 7 )。

表 3 PCR 引物序列Tab.3 PCR primer sequences
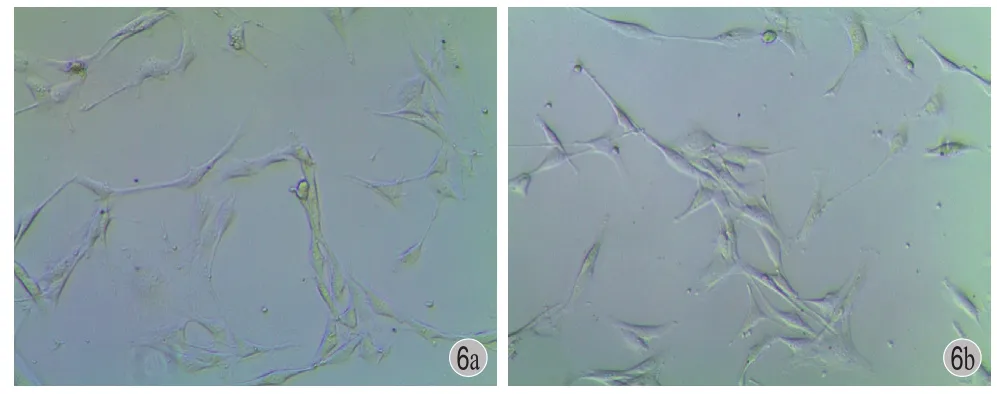
图 6 第 1 天细胞贴壁 a:Sr 含量 31.25 μg / ml 组;b:对照组Fig.6 The fi rst day of cell adherence a: Strontium content of 31.25 μg / ml group; b: The control group
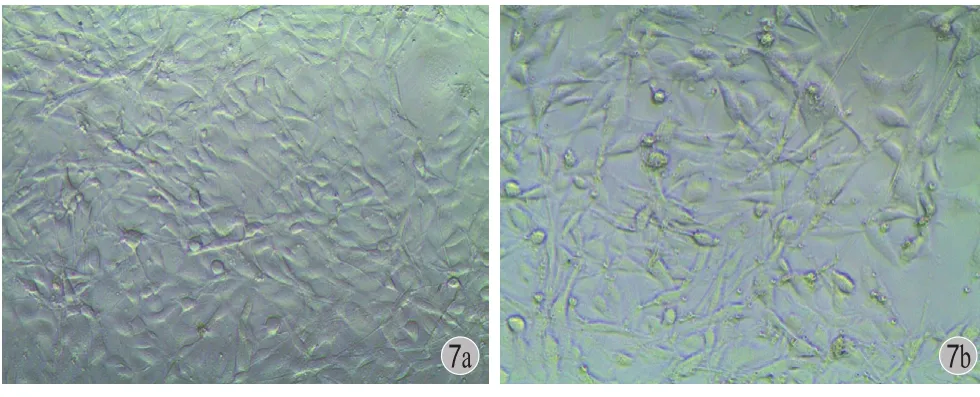
图 7 第 3 天细胞形态和密度观察 a:Sr 含量 31.25 μg / ml 组;b:对照组Fig.7 The third day of cell morphology and density of the observation a: Strontium content of 31.25 μg / ml group; b: The control group
讨 论
成骨活性元素 Sr 的应用具有相对的稳定性和较高的安全预期,这是因为化学元素 Sr 是与钙元素同族的碱土金属元素,在成熟骨骼中约相当于钙元素含量的 0.035%,是人体骨中必需元素之一[5-8]。在骨质发生的早期,Sr 元素的缺乏可以导致骨形成不足及骨钙化不良。Sr 元素在代谢上与钙离子排泄途径相似,因而具有较高的安全性。然而在植骨材料的应用中其应用浓度差异巨大,应用形式和含量比例各不相同,其规范使用需要基础研究提供基本的细胞实验依据。笔者认为各类掺 Sr 材料发挥作用的根本机制是依赖于溶解出的 Sr 离子进而发挥对成骨细胞的刺激和调控作用。本研究中,笔者在MC3T3-E1 成骨细胞的培养液中添加了不同浓度含量的 Sr 离子,用于检测成骨细胞对 Sr 离子浓度相依赖的生物反应,对其关键性增殖和代表性成骨分化的指标进行了相关检测。
细胞增殖是细胞生长代谢最重要的基础性指标,它可以反映材料植入后生物相容性的优劣,用于指示组织修复细胞在支架表面生长能力以及最终组织再生修复能力的强弱。本研究结果提示,在 Sr离子浓度高于 500 μg / ml 时,成骨细胞增殖明显降低,生长受到抑制,说明对细胞产生了毒性反应。当植入材料的溶出 Sr 离子浓度超过这一浓度范围时,Sr 离子所发挥的将不再是对于组织修复的促进作用,相反地,是对修复细胞的毒性和对再生的抑制。因此这一结果对组织工程支架材料的研究具有重要的指导意义,而当 Sr 离子的浓度降至一定的阈值后,其促进作用也不再显著,可以为各类相关研究提供参考。
ALP 活性是反应成骨细胞分化水平的一个重要指标,其活性越高,说明成骨细胞分化越明显[9]。本实验采用国际上公认的 PNPP 法检测成骨细胞ALP 活性,发现在一定范围内,Sr 对成骨细胞 ALP活性的影响呈浓度依赖性,同时也发现了 Sr 元素作用的最大效应浓度。
RUNX2 是一个功能多样的转录因子,是 Runt家族的一员,在成骨细胞的整个分化过程中均有表达。有研究证明,RUNX2 既调控骨发生过程中骨的形成,又在出生后骨的形成中起到重要的调控作用,而且 RUNX2 能直接诱导间充质干细胞向成骨细胞的分化[10-11]。本实验中,RUNX2 mRNA 的表达量随 Sr 的浓度在一定范围内逐渐升高,Sr 浓度为31.25 μg / ml 左右时,RUNX2 mRNA 表达量达到峰值,这与细胞增殖和碱性磷酸酶实验的规律基本一致。MTT 结果与 PCR 和 ALP 等结果互相支持,细胞的形态学观察也为实验提供了有力的佐证。
综上所述,本研究证实 Sr 促进成骨细胞的增殖和分化具有显著的剂量依赖关系,超过最优浓度范围其促进作用下降,在一定阈值后甚至会出现毒性抑制作用。本研究为深入阐明 Sr 元素的促成骨机制以及组织工程支架材料的研究提供了重要的参考依据。
参 考 文 献
[1] Boyd SK, Szabo E, Ammann P. Increased bone strength is associated with improved bone microarchitecture in intact female rats treated with strontium ranelate: a finite element analysis study. Bone, 2011, 48(5):1109-1116.
[2] Li Y, Shui X, Zhang L, et al. Cancellous bone healing around strontium-doped hydroxyapatite in osteoporotic rats previously treated with zoledronic acid. J Biomed Mater Res B Appl Biomater, 2015.
[3] Takaoka S, Yamaguchi T, Yano S, et al. The Calcium-sensing Receptor (CaR) is involved in strontium ranelate-induced osteoblast differentiation and mineralization. Horm Metab Res, 2010, 42(9):627-631.
[4] Bonnelye E, Chabadel A, Saltel F, et al. Dual effect of strontium ranelate: stimulation of osteoblast differentiation and inhibition of osteoclast formation and resorption in vitro. Bone, 2008, 42(1):129-138.
[5] Silverman S, Christiansen C. Individualizing osteoporosis therapy. Osteoporos Int, 2012, 23(3):797-809.
[6] Cooper C, Reginster JY, Chapurlat R, et al. Ef fi cacy and safety of oral strontium ranelate for the treatment of knee osteoarthritis: rationale and design of randomised, double-blind, placebocontrolled trial. Curr Med Res Opin, 2012, 28(2):231-239.
[7] 张春丽, 赵彦涛, 侯树勋, 等. 新型掺锶硫酸钙材料的成骨细胞生长活性研究. 中国骨伤, 2014, 27(5):415-418.
[8] 赵彦涛, 侯树勋, 闫钧, 等. 一种新型掺锶冻干骨材料的细胞相容性研究. 中国组织工程研究, 2012, 12(51):1024-1029.
[9] Kyeyune NE, Lau KH, Baylink DJ, et al. l,25-Dihydorxyvitamin D3 stimulates both alkaline phosphatase gene tarnseription and mRNA stability in human bone cells. Aerh Biochem Bio Phys, 1991, 291(2):316-325.
[10] Pi SH, Lee SK, Hwang YS, et al. Differential expression of periodontal ligament-specific markers and osteogenic differentiation in human papilloma virus 16-immortalized human gingival fibroblasts and periodontal ligament cells. Periodontal Res, 2007, 42(2):104-113.
[11] Zhang X, Yang M, Lin L, et al. Runx2 overexpression enhances osteoblastic differentiation and mineralization in adiposederived stem cells in vitro and in vivo. Calcif Tissue Int, 2006, 79(3):169-178.
( 本文编辑:王萌 )
Effects of strontium on the proliferation, ALP activity and the differentiation of MC3T3 cells
LI Zhong-hai, HAN Li-wei, ZHAO Yan-tao, YANG Xiao-xiong, ZHONG Hong-bin, WANG Fu-li, HOU Shu-xun. Orthopaedic Institute of CPLA, the fi rst Af fi liated Hospital of PLA General Hospital, Beijing, 100048, PRC
【Abstract】Objective To study the effects of strontium concentration on the proliferation, ALP activity and the differentiation of MC3T3-E1 cells. Methods MC3T3-E1 cells were cultured in vitro, and added with strontium of different concentrations. We used MTT to detect the proliferation of MC3T3-E1 celsl, PNPP to detect ALP activity, and RT-PCR to detect mRNA of key proteins of osteoblast differentiation. Results When the concentration of strontium was higher than 500 μg / ml, the proliferation of osteoblasts was signi fi cantly decreased, and the growth was inhibited. When the concentration of strontium was 3.91 - 250.00 μg / ml, the promoting effect reached the highest level. With the decrease of strontium concentration, the promoting effect was gradually weakened. In the observation range, the effects of strontium on the activity of ALP was obviously dependent. Strontium could signi fi cantly increase the ALP activity of MC3T3-E1. When the concentration of strontium was in the range of 3.91 - 125 μg / ml, the ALP activity of osteoblasts was signi fi cantly increased. The expressions of RUNX2, ALP, Col1 and mRNA gradually increased with the concentration of strontium in a certain range. The expression of mRNA reached the peak value, while the concentration reached 31.25 μg / ml. Conclusions Strontium promotes the proliferation and differentiation of osteoblasts in a dose-dependent manner. However, when the concentration of strontium exceeds the optimal concentration range, its promotion effect is decreased, and the toxicity is inhibited after a certain threshold value.
【Key words】Strontium; Osteoblasts; Cell differentiation; Cell proliferation; Bioactivity
( 收稿日期:2016-02-04 )
Corresponding author:ZHAO Yan-tao, Email: 45828016@qq.com
基金项目:中国博士后科学基金特别资助 ( 2015T81101 );北京市自然科学基金 ( 7152144 );国家自然科学基金项目
DOI:10.3969/j.issn.2095-252X.2016.03.015
中图分类号:Q291
