实验活动7酸、碱的化学性质
2016-04-07魏海
魏海
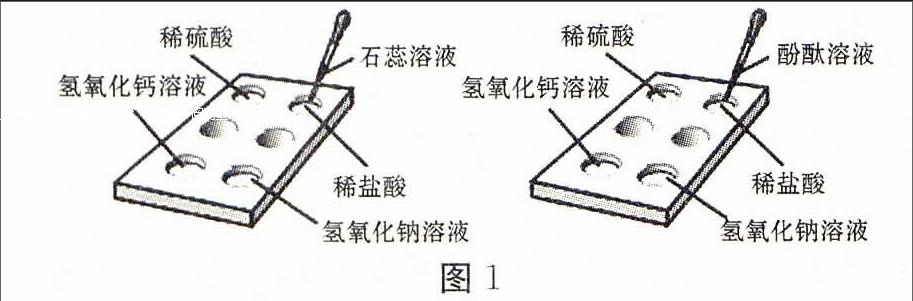
本实验旨在加深学生对酸、碱化学性质的认识,并借助酸、碱的性质解释生活中的一些现象,从而培养学生解决实际问题的能力。
一、比较酸、碱与指示剂的作用
1.实验操作
(1)在一块点滴板空穴中分别滴上几滴稀硫酸、稀盐酸、稀氢氧化钠溶液、氢氧化钙溶液,然后在几种溶液里分别滴入2滴紫色的石蕊溶液;在另一块点滴板空穴中也分别滴上几滴稀硫酸、稀盐酸、稀氢氧化钠溶液、氢氧化钙溶液,然后在几种溶液里分别滴入2滴无色的酚酞溶液(见图1)。
(2)观察到:石蕊溶液遇酸溶液变红色,遇碱溶液变蓝色;酚酞溶液遇酸溶液不变色,遇碱溶液变红色。
2.实验结论
(1)紫色的石蕊溶液遇酸溶液变红色,遇碱溶液变蓝色。
(2)无色酚酞溶液遇酸溶液不变色,遇碱溶液变红色。
二、探究酸、碱的化学性质
1.酸与金属、金属氧化物的反应
(1)实验操作:将一枚生锈的铁钉放入试管中,然后倒入少许稀盐酸(使铁钉一半浸入酸中)。一会儿铁锈逐渐溶解,溶液变为黄色,再过一会儿,溶液中冒气泡。取出铁钉,洗净后发现,浸在酸中的部分呈现银白色,而上半部铁钉仍然锈迹斑斑。
(2)实验结论:酸溶液能与活泼金属反应放出氢气,能与金属氧化物反应生成可溶性盐。有关化学方程式:Fe2O3+6HCl=2FeCl3+3H2O,Fe+2HCl=FeCl2+H2↑。
(3)注意事项:将生锈的铁钉放入试管中时,按照“一横、二放、三慢竖”的要求操作,不能将铁钉直接投入试管,以免击穿试管底部。
2.酸与碱的反应
(1)氢氧化钠溶液与稀盐酸反应。
①实验操作:在一支试管中加入1 mL氢氧化钠溶液,滴入2滴酚酞溶液;再用滴管慢慢滴入稀盐酸,并不断振荡试管,至溶液恰好变为无色;取完全褪色后的溶液1 mL,放入蒸发皿中蒸干。
②现象及分析:氢氧化钠溶液中滴入酚酞溶液后变为红色,说明氢氧化钠溶液显碱性;当逐滴滴入稀盐酸后,溶液褪为无色,说明氢氧化钠已不存在,进而说明氢氧化钠已被盐酸反应;将反应后的无色溶液蒸干,得白色固体,此白色固体不是反应物盐酸,因为盐酸受热挥发;不是反应物氢氧化钠,因为溶液红色已经褪去,显然,白色固体是盐酸与氢氧化钠反应的产物,由盐酸、氢氧化钠的化学式(HCl、NaOH)可知,白色固体是氯化钠。
③实验结论:氢氧化钠溶液能与盐酸发生中和反应,生成盐和水,即NaOH+HCl=NaCl+H2O。
(2)氢氧化钙溶液与稀盐酸反应。
①实验操作:用药匙的小端,取等质量的氢氧化钙两份,放入两支试管中;分别加入1mL的蒸馏水,振荡,再各滴入2滴酚酞溶液;接下来,向其中一支试管中加入1 mL的蒸馏水,并充分振荡,在另一支试管中加入1 mL的稀盐酸,并充分振荡。
②现象及分析:极少的氢氧化钙加入水后,得到浑浊液体,说明其溶解性较小(微溶);滴入酚酞溶液后,溶液显红色,说明氢氧化钙溶液显碱性;加入蒸馏水后红色不褪去,说明溶液稀释后化学性质不变;滴加稀盐酸后,红色褪去,说明氢氧化钙被盐酸反应了;得到的溶液澄清,说明氢氧化钙与盐酸反应生成了易溶于水的物质。
③实验结论:氢氧化钙微溶于水;氢氧化钙溶液显碱性;氢氧化钙能与盐酸发生中和反应生成盐和水,即Ca(OH)2+2HCl=CaCl2+2H2O。
对比上述两个实验还可知,酸、碱溶液具有一些相似的化学性质。
(3)注意事项。
①酸碱中和过程中要不断振荡,既能使溶液充分接触,也能防止滴入过量的盐酸。
②氢氧化钙微溶于水,取用量要很少。
3.碱与盐的反应
(1)实验操作:在试管中加入2 mL硫酸铜溶液,然后用滴管向硫酸铜溶液中滴加氢氧化钠溶液,观察到有蓝色沉淀出现;再向蓝色沉淀中加入稀盐酸,沉淀消失,又得到蓝绿色溶液。
(2)现象分析:硫酸铜溶液与氢氧化钠溶液反应产生蓝色氢氧化铜沉淀,即CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;氢氧化铜能与盐酸反应(属于中和反应),得到蓝绿色的氯化铜溶液,即Cu(OH)2+2HCl=CuCl2+2H2O。
(3)实验结论:碱能与某些盐发生复分解反应,生成另一种盐和另一种碱。
三、疑难解答
1.酸或碱溶液具有相似化学性质的原因
酸或碱的水溶液(如盐酸、硫酸、氢氧化钠溶液和氢氧化钙溶液)均能导电,因此这些溶液中存在自由移动的离子。如HCl在水中可以解离出H+和 Cl-,H2SO4在水中会解离出H+和SO2-4,NaOH在水中会解离出Na+和OH-,Ca(OH)2在水中会解离出Ca2+和OH-。显然,酸溶于水都能解离出H+,碱溶于水都能解离出OH-,即不同的酸溶液里都含有相同的H+,不同的碱溶液里都含有相同的OH-,所以酸或碱的溶液具有一些相似的化学性质。
2.复分解反应发生的条件
上面涉及的中和反应,盐酸与铁锈的反应,硫酸铜与氢氧化钠的反应,都属于复分解反应。复分解反应发生的条件,不仅涉及对产物的要求,其实对反应物的性质也有要求。
(1)酸+盐→新盐+新酸。
反应物中酸必须可溶,生成物中至少有一种物质是气体、沉淀或水,如H2SO4+Ba(NO3)2=2HNO3+BaSO4↓。
(2)酸+金属氧化物→盐+水。
反应物中的酸必须是可溶性酸,如6HCl+Fe2O3=2FeCl3+3H2O。
(3)酸+碱→盐+水。
反应物中至少有一种物质是可溶的,如H2SO4+2NaOH=Na2SO4+2H2O。endprint
(4)碱+盐→新碱+新盐。
反应物全可溶,生成物中至少有一种物质是沉淀或气体,如Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。
(5)盐+盐→两种新盐。
反应物全可溶,生成物中有沉淀,如K2CO3+Ba(NO3)2=2KNO3+BaCO3↓。
综上,复分解反应的条件归纳起来就是:反应物中,有酸酸溶、无酸两溶;生成物中,要有气体、沉淀或水生成。
四、例题导学
【例1】(2015·重庆)硫酸厂的废水中因含硫酸而显酸性,需要处理呈中性后才能排放。某兴趣小组的同学取少量废水按下列步骤进行实验:
(1)验证废水酸性。往废水中滴加石蕊溶液,溶液变,说明废水呈酸性。
(2)处理废水。该小组同学设计了以下两个方案。
方案一:用熟石灰处理废水,其反应的化学方程式为。
方案二:用BaCl2处理废水,观察到废水中出现。
经过分析,同学们认为方案二没有达到处理废水的目的,因为处理后的废水中含有较多的。
【解析】(1)往废水中滴加石蕊溶液,溶液变红色,说明废水呈酸性。(2)用熟石灰处理废水,该反应生成硫酸钙和水。用BaCl2处理废水,反应生成硫酸钡沉淀和盐酸(BaCl2+H2SO4=BaSO4↓+2HCl),所以观察到废水中出现白色沉淀,但是,这样处理后的废水中含有较多的盐酸。
【答案】(1)红色(2)Ca(OH)2+H2SO=CaSO4 +2H2O白色沉淀(或浑浊)盐酸
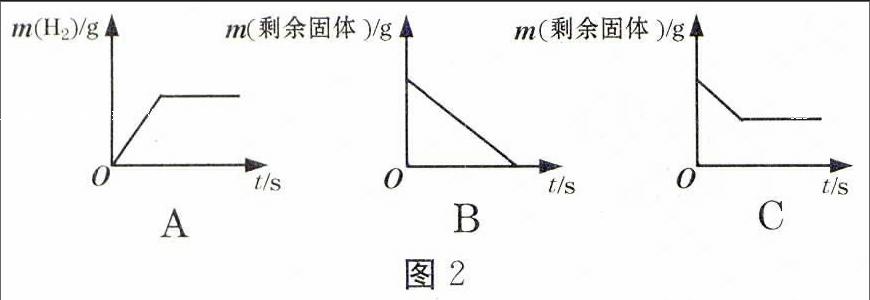
【例2】(2015·福州)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式:。图2是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是(填字母)。
【解析】铜与稀盐酸不反应,铁与稀盐酸反应放出氢气。在反应过程中,不断产生氢气,当铁反应完全,氢气的质量不再增加,A项正确;在反应过程中,剩余的固体逐渐减少,但不会为零,因为铜仍然存在,B项错误,C项正确。
【答案】Fe+2HCl=FeCl2+H2↑A、C
五、对点训练
1.下列有关说法中,不正确的是()
A.酸溶液中都含有H+,所以有相似的化学性质
B.酸、碱在水溶液中都可解离出带电的粒子
C.在实验室,常用烧碱来干燥某些气体
D.不溶于水的酸也能使紫色石蕊溶液变红
2.下列物质长期敞口放置在空气中,质量增加而不变质的是()
A.浓硫酸B.氢氧化钠溶液
C.铁粉D.氢氧化钙
3.以下说法中,不正确的是()
A.酸中都含有氢元素,只要含有氢元素的化合物都是酸
B.氧化物中含有氧元素,但含氧元素的化合物不一定是氧化物
C.离子是带电粒子,但带电的粒子不一定是离子
D.中和反应一定是复分解反应
4.某同学在油菜地不慎被蜜蜂蜇伤,蜜蜂的刺液呈酸性,为了减轻痛痒,宜在蜇伤处涂抹的物质是()
A.牛奶(pH≈6)B.苹果汁(pH≈3)
C.牙膏(pH≈9)D.矿泉水(pH≈7)
5.下列应用与中和反应原理无关的是()
A.用浓硫酸干燥湿润的氧气
B.用熟石灰改良酸性土壤
C.服用含氢氧化铝的药物治疗胃酸过多
D.用氢氧化钠溶液洗涤石油产品中的残留硫酸
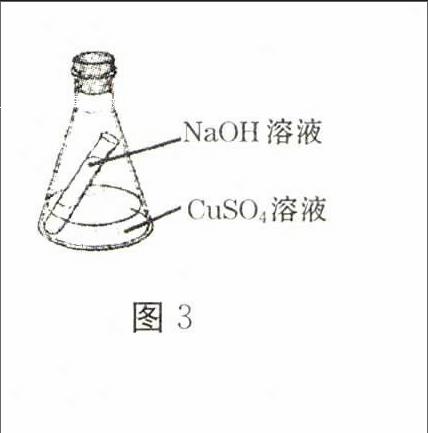
6.把盛有5 g 16%的NaOH溶液的短试管放入盛有10 g 16%的CuSO4溶液的锥形瓶里,见图3。倾斜锥形瓶直到使两溶液充分混合,混合后不可能的是()
A.产生蓝色沉淀0.98 g
B.锥形瓶内物质总质量不变
C.所得溶液的Na2SO4质量分数大于9.5%
D.所得的Na2SO4溶液质量与原CuSO4溶液质量相等
7.物质X、Y之间存在如下关系:X+2NaOH=2Y+Cu(OH)2↓,则()
A.X一定是Cu(NO3)2
B.X的相对分子质量比Y大
C.Y中阴离子的化合价为-2
D.该反应类型为置换反应
8.氢氧化铝是一种不溶于水的白色固体,能与稀盐酸反应,也能与氢氧化钠溶液反应。氢氧化铝与氢氧化钠溶液反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O。下列有关说法错误的是()
A.向稀盐酸中加入氢氧化铝,发生中和反应
B.在NaAlO2中铝元素的化合价为+3
C.氢氧化铝属于氧化物
D.向氯化铝溶液中逐滴加入氢氧化钠溶液,先产生白色沉淀,后白色沉淀又消失
9.某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像(见图4)。下列说法正确的是()
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是Na2SO4和H2SO4
C.该实验是将氢氧化钠溶液逐滴滴入盛有硫酸的烧杯中
D.由a点到b点的pH变化过程证明酸和碱发生了中和反应
10.将等质量、等质量分数的氢氧化钠溶液和硫酸溶液混合,混合后的溶液不能与下列哪种物质发生反应()
A.Ba(OH)2B.Fe
C.HClD.FeCl3
11.构建模型和构建知识网络是化学学习中重要的学习方法,李华同学利用左手构建酸的性质知识网络(见图5)。请结合图示回答下列问题。endprint
(1)如用湿润的pH试纸测定稀硫酸的pH,则结果会(填“偏大”“偏小”或“无影响”)。
(2)图5中①的现象是。
(3)写出一个符合图5中③的化学方程式:。
(4)图5中性质④属于(填基本反应类型)反应。
(5)图5中⑤的性质在工业上可用于(填用途)。
12.氧化钙俗称生石灰,某同学针对氧化钙设计了如下实验方案:
(1)A中发生反应的化学方程式为。分离B中难溶物的操作Ⅰ叫做。
(2)如果要用实验证明C中不是水而是一种溶液,可以选择下列中的(填序号)进行实验。
①稀盐酸②酚酞溶液
③二氧化碳④氯化钠溶液
(3)操作Ⅱ是加入某种物质使无色澄清液出现白色固体,如果加入的是饱和碳酸钠溶液,白色固体的化学式是;如果加入的是固体氢氧化钠(全部溶解),白色固体的化学式是。
13.盐酸是一种重要的化工产品,也是实验室中重要的化学试剂。
(1)增大压强,HCl由气态变为液态,从微观的角度分析,该变化过程中改变的是。
(2)在盐酸中加入过量的铁粉,充分反应:
①可以看到的现象是。
②图7表示该反应前后溶液中存在的主要离子, 请写出每种图形代表的离子(填离子符号)。
③下列金属中,能与盐酸发生类似反应的是(填字母)。
A.CuB.Mg C.AlD.Ag
14.兴趣小组的同学在做镁条和盐酸反应实验时发现,试管外壁很烫,试管口出现白雾。白雾是什么呢?
Ⅰ.同学们作出猜想。
猜想一:是小水滴。因为盐酸中的水受热会汽化上升,在试管口(填物态变化名称)成小水滴。
猜想二:是盐酸小液滴。因为浓盐酸具有性,若实验中使用的盐酸浓度过高,试管口就会形成盐酸小液滴。
同学们将干燥的蓝色石蕊试纸放在内有正在反应的镁条和盐酸的试管口,试纸变红,证明猜想二是合理的。
Ⅱ.小柯提出质疑。
为什么刚才打开盛放实验所用盐酸的试剂瓶,瓶口没有白雾,却在反应过程中出现白雾?
小柯联系反应时试管外壁很烫,于是猜想:白雾的形成可能与温度有关。
他用试管取少量盐酸,将干燥的蓝色石蕊试纸放在试管口,试纸不变红;然后(填操作),试纸变红。
得出结论:这种盐酸浓度并不高,是镁和盐酸反应放热促使盐酸形成白雾。
15.氢氧化钠和氢氧化钙是两种常见的碱。李红同学将两种碱的溶液分别装入试管A、B 中,并进行了如图8所示的三组实验。
(1)实验1中,两支试管的溶液都变成色。
(2)实验2中,若B 盛装的是NaOH 溶液,发生反应的化学方程式为。
(3)实验3中,李红同学向两支试管吹气,A 中有白色沉淀生成,发生反应的化学方程式为。B 中无现象,为了探究吹气后B 中溶质的成分,李红进行了如下探究。
【提出猜想】
猜想1:溶质只有氢氧化钠;
猜想2:溶质只有碳酸钠;
猜想3:溶质有氢氧化钠和碳酸钠;
……
【实验与结论】
实验实验现象结论
取B 中少量溶液,加入澄清石灰水至不再产生沉淀为止,过滤后取上层清液,向其中加几滴酚酞溶液
产生白色沉淀溶液呈现红色猜想3成立
【反思与评价】
老师评价李红得出的结论不正确,是因为猜想(填数字)也会产生相同的现象。如果要验证“猜想3成立”,必须要换试剂,将溶液换成溶液。
附:对点训练参考答案
1.D2.A3.A4.C5.A6.D7.B
8.C9.D10.B
11.(1)偏大(2)石蕊溶液变成红色(3)H2SO4+BaCl2=BaSO4↓+2HCl(合理即可)(4)复分解(5)除铁锈(合理即可)
12.(1)CaO+H2O=Ca(OH)2过滤(2)②③(3)CaCO3Ca(OH)2
13.(1)分子的间隔(2)①固体部分溶解,溶液由无色变为浅绿色,有气泡产生②H+
Cl-Fe2+③B、C
14.液化挥发加热试管,将干燥的蓝色石蕊试纸放在试管口
15.(1)红(2)2NaOH+CuSO4=Na2SO4+Cu(OH)2↓(3)Ca(OH)2+CO2=CaCO3↓+H2O【反思与评价】2氢氧化钙
氯化钙(或硝酸钙)endprint
