pET-32a载体介导的生长抑制素基因在大肠杆菌中表达
2016-04-07刘成倩易建中孙晓云
陈 磊,刘成倩,李 红,易建中*,王 静,孙晓云
(1上海海洋大学水产与生命学院,上海201306;2上海市农业科学院畜牧兽医研究所,上海201106)
pET-32a载体介导的生长抑制素基因在大肠杆菌中表达
陈 磊1,2,刘成倩2,李 红2,易建中2*,王 静1,2,孙晓云1,2
(1上海海洋大学水产与生命学院,上海201306;2上海市农业科学院畜牧兽医研究所,上海201106)
摘 要:为构建pET-32a-2SS28-SS14和pET-32a-3SS28原核表达质粒并检测其在大肠杆菌中的表达,将两种形式的生长抑制素SS14和SS28基因克隆到pET-32a载体中;酶切及测序鉴定后,采用不同终浓度的IPTG在37℃条件下进行诱导表达。Western blot结果显示:两组分别诱导出分子量大小为28" 4 kD和29" 8 kD的目的蛋白,不同终浓度的IPTG诱导对目的蛋白的表达量没有明显影响。目的蛋白主要为可溶性蛋白,少数以包涵体形式存在。本研究为生长抑制素基因工程疫苗生产应用奠定了基础。
关键词:生长抑素;表达质粒;蛋白质印迹
生长素抑制激素是一种多肽类激素,主要由下丘脑分泌释放,放射免疫测定结果表明,其主要分布于心脏、甲状腺、中枢及末梢神经、消化系统中。生长抑制激素在体内有着广泛的抑制作用,例如:它通过抑制生长激素、胰高血糖素、胰岛素、促甲状腺激素等而抑制机体生长。研究证明,通过注射生长激素,可以增加动物的生长速度和饲料转化效率。因此,理论上我们可以通过免疫中和动物体内的生长抑制素,从而达到促进动物生长的目的。
有学者研究表明,通过人工合成的方法偶联生长抑制素和异种的动物蛋白,用其免疫不同动物,能有效的促进动物生长[1-9]。但是人工合成生长抑制素成本限制其在生产实践中的推广应用。随着基因工程技术的发展,利用蛋白表达系统获得生长抑制素蛋白,在生长抑制素从应用到生产实践具有较高的可操作性。
生长抑制激素存在形式较多,例如:SS14、SS28和SS25等,一般认为它们的分子结构和生物效应均相似,并且在哺乳动物体内其氨基酸序列也相同。鉴于表达的蛋白将用于免疫动物,本实验选取用免疫原性和生物活性较好的SS28和SS14,将其克隆到pET-32a质粒上,通过大肠杆菌融合表达系统对生长抑制素大肠杆菌基因进行表达。由于生长抑制素分子量小(1 658 D),本研究将生长抑制素基因进行重复串联以提高其表达量以及增强目的蛋白免疫原性,为后续研究奠定基础。
1 材料与方法
1.1 材料
限制性内切酶、T4 DNA连接酶购自Promega公司;DH5a、BL21(De3)菌株、IPTG、DNA胶回收试剂盒均购自北京全式金公司;pET-32a表达系统购自Novagen公司;小鼠抗his-tag一抗和山羊抗小鼠二抗购自世纪康维公司。
1.2 方法
1" 2" 1 生长抑制素基因的合成
根据生长抑制素基因设计BB-SS28、EH-SS28、XX-SS28、XX-SS14四个带有不同酶切位点的SS28和SS14[10]基因单链。序列由上海捷瑞生物有限公司合成。
BB-SS28:
1" GATCCGGTGGTAGCGCTAACTCTAACCCGGCCATGGCACCGCG
2" TGAACGCAAAGCTGGCTGCAAGAATTTCTTCTGGAAGACCTTCACATCTTGTGGCGGCG
3" GATCCGCCGCCACAAGATGTGAAGGTCTTCCAGAAGAAATTCT
4" TGCAGCCAGCTTTGCGTTCACGCGGTGCCATGGCCGGGTTAGAGTTAGCGCTACCACCG EH-SS28:
1" AATTC GGTGGTAGCGCTAACTCTAACCCGGCCATGGCACCGCG
2" TGAACGCAAAGCTGGCTGCAAGAATTTCTTCTGGAAGACCTTCACATCTTGTGGCGGCG
3" AGCTT GCCGCCACAAGATGTGAAGGTCTTCCAGAAGAAATTCT
4" TGCAGCCAGCTTTGCGTTCACGCGGTGCCATGGCCGGGTTAGAGTTAGCGCTACCACCG XX-SS28:
1" TCGAG GGTGGTAGCGCTAACTCTAACCCGGCCATGGCACCGCG
2" TGAACGCAAAGCTGGCTGCAAGAATTTCTTCTGGAAGACCTTCACATCTTGTGGCGGCG
3" TCGAG GCCGCC ACAAGATGTGAAGGTCTTCCAGAAGAAATTCT
4" TGCAGCCAGCTTTGCGTTCACGCGGTGCCATGGCCGGGTTAGAGTTAGCGCTACCACCG XX-SS14:
1" TCGAGGGTGGTGCTGGCTGCAAGAATTTCTTCTGGAAGACCTTCACATCTTGTGGCC
2" TCGAGGCCACAAGATGTGAAGGTCTTCCAGAAGAAATTCTTGCAGCCAGCACCACCC
将合成好的单链基因按照要求加水稀释成50 μmol/L,每条单链取4 μL再加同样体积的Annealing Buff混合均匀,沸水浴2 min后自然冷却至室温。
1" 2" 2 pET-32a-2SS28-SS14表达质粒的构建
利用分子克隆技术构建质粒[11],提取pET-32a空载质粒。取3 μL质粒用BamHⅠ单酶切后,PCR清洁试剂盒清洁回收,再与BB-SS28用T4连接酶16℃链接16 h。将链接产物(pET-32a-SS28)转化到E.coli DH5α,37℃培养过夜。送铂尚生物技术有限公司进行测序鉴定。
将测序正确的菌株命名为pET-32a-SS28,并抽提质粒,取3 μL该质粒用EcoRⅠ和HindⅢ酶切后,用PCR清洁试剂盒清洁回收,再与EH-SS28用T4连接酶16℃链接16 h。将链接产物pET-32a-2SS28转化到E.coli DH5α,37℃培养过夜。将测序正确的菌株命名为pET-32a-2SS28,并抽提质粒,取3 μL该质粒用XhoⅠ单酶切后,用PCR清洁试剂盒清洁回收,再与XX-SS14用T4连接酶16℃链接16 h。将链接产物pET-32a-2SS28-SS14转化到E.coli DH5α,37℃培养过夜。测序正确后-20℃冻存备用。
1" 2" 3 pET-32a-2SS28-SS14的目的基因诱导表达
取测序正确的菌种保藏液,在氨苄固体选择培养基上划线培养12 h,再选取单个菌落在液体LB培养基内培养16 h后抽提pET-32a-2SS28-SS14质粒,并同时与pET-32a空载质粒分别转化到E.coli BL21 De3,37℃培养过夜。挑取单个菌落液体氨苄LB培养基培养16 h后,转接到200 mL LB培养基中培养,37℃,190转培养90 min左右,测定OD值,当OD值在0" 5—0" 7时,试验组加入IPTG,使终浓度分别为0 mmol/L、0" 05 mmol/L、0" 1 mmol/L、0" 2 mmol/L、0" 4 mmol/L、0" 8 mmol/L、1" 2 mmol/L,pET-32a空载质粒组取0" 4 mmol/L IPTG 2 mL加入到培养基中,然后继续37℃,190转培养6 h。取1 mL菌液处理后进行15%SDS-PAGE电泳,然后通过考马斯亮蓝染色,脱色后进行灰度扫描。将培养基5 000 r/min 4℃离心10 min后,去上清,加入30 mL超声波液溶解,用超声波破碎仪破碎至液体清亮,8 000 r/min,4℃离心10 min,收集上清,用30 mL超声波液溶解沉淀。取30 μL上清和沉淀经处理后,进行15%SDS-PAGE电泳[12],然后通过考马斯亮蓝染色,脱色后进行灰度扫描。
1" 2" 4 pET-32a-3SS28表达质粒的构建
抽提pET-32a-2SS28质粒,取3 μL该质粒用XhoⅠ单酶切后,用PCR清洁试剂盒清洁回收,再与XXSS28用T4连接酶16℃链接16 h。再将链接产物pET-32a-3SS28转化到E.coli DH5α,37℃培养过夜。测序正确后菌种保藏。
1" 2" 5 pET-32a-3SS28的目的基因诱导表达
步骤同1" 2" 3
1" 2" 6 带his-tag标签的2SS28-SS14和3SS28目的蛋白的Western blot检验
将pET-32a-2SS28-SS14和pET-32a-3SS28菌液破碎后的离心上清进行15%SDS-PAGE电泳,再通过转印仪进行转膜,60 mA,1 h,将蛋白胶上的蛋白转移到PVDF膜上,然后用脱脂奶粉封闭后用抗his-tag标签的小鼠一抗孵育,再用山羊抗小鼠的二抗孵育,通过ECL方法压片曝光显影。
2 结果与分析
2.1 2SS28-SS14和3SS28目的蛋白在pET-32a表达系统中的表达
2SS28-SS14和3SS28目的蛋白在不同浓度IPTG诱导表达,图1和图2中的电泳条带经灰度扫描后可知,2SS28-SS14和3SS28目的蛋白在终浓度IPTG分别为0 mmol/L、0" 05 mmol/L、0" 1 mmol/L、0" 2 mmol/L、0" 4 mmol/L、0" 8 mmol/L、1" 2 mmol/L诱导5 h的表达量无明显差异。
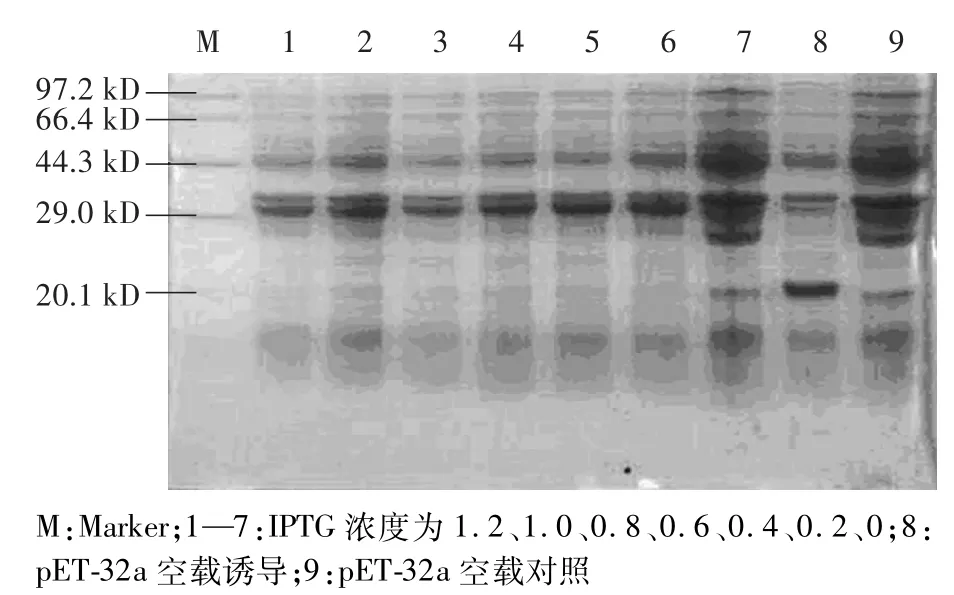
图1 pET-32a-2SS28-SS14目的蛋白(约28 418 D)在不同IPTG浓度诱导下的表达结果Fig.1 Expression of pET-32a-2SS28-SS14 protein (approximately 28 418 D)at different IPTG concentrations

图2 pET-32a-3SS28目的蛋白(约29 887 D)在不同IPTG浓度诱导下的表达结果Fig.2 Expression of pET-32a-3SS28 protein (approximately 29 887 D)at different IPTG concentrations
2SS28-SS14和3SS28目的蛋白的水溶性,菌体破碎离心后,进行SDS-PAGE电泳,条带灰度扫描后显示(图3),在37℃表达目的蛋白主要以水溶性存在只有少量为不溶性。

M:Marker;1—2:pET-32a-2SS28-SS14上清、沉淀;3—4:pET-32a-3SS28上清、沉淀图3 pET-32a-2SS28-SS14和pET-32a-3SS28目的蛋白的水溶性Fig.3 Water solubility of expressed pET-32a-2SS28-SS14 and pET-32a-3SS28
2.2 带有his-tag标签的2SS28-SS14和3SS28目的蛋白的Western blot检验
通过Western blot检测验证带有his-tag标签的2SS28-SS14和3SS28目的蛋白(图4)。

M:蛋白质印迹Marker;1:pET-32a-3SS28蛋白质印迹;2:pET-32a-2SS28-SS14蛋白质印迹图4 pET-32a-2SS28-SS14和pET-32a-3SS28蛋白质印迹Fig.4 Western blots of pET-32a-2SS28-SS14 and pET-32a-3SS28
3 结论与讨论
本试验通过基因克隆技术,将生长抑制素中生物活性较高、免疫原性较好的两种形式SS14、SS28基因克隆到pET-32a表达系统中,再通过IPTG诱导表达生长抑制素蛋白。通过此方法获得的生长抑制素疫苗,可以解决人工合成生长抑制素成本太高的问题,为生长抑制素用于免疫经济动物促进生长和增强免疫[13-16]提供重要基础。
在诱导蛋白时,一般IPTG的终浓度的合理调整可能会对诱导结果有一定的影响,但是本试验中,在对IPTG终浓度在0" 05—1" 2 mmol/L范围内调整后诱导结果无明显差异,该试验结果提示,用不同终浓度IPTG对于在pET-32a表达系统中诱导表达2SS28-SS14和3SS28目的蛋白影响不明显。由于IPTG价格较高,且有一定的毒性,所以在应用到工业生产时选用低浓度的IPTG即可达到生产目的,而且更有利于控制产品成本和质量。
本试验中,2SS28-SS14和3SS28目的蛋白在pET-32a表达系统37℃中诱导表达结果显示,蛋白既有水溶性蛋白也有不溶性,其中水溶性蛋白比例更高,说明pET-32a表达系统对2SS28-SS14和3SS28目的蛋白有较好的表达效果。本研究为生长抑制素基因工程疫苗的生产奠定了基础。
参 考 文 献
[1]Spencer G S G,Garssen G J,Hart I C" A novel approach to growth promotion using autoimmunization against somatostatin"Ⅰ" Effects on growth and hormone levels in lambs[J]" Liverst Prod Sci,1983,10(1):25-37"
[2]Spencer G S G,Garssen G J,Hart I C" A novel approach to growth promotion using autoimmunization against somatostatin"Ⅱ" Effects on appetite,carcass composition and food utilization in lambs[J]" Livest Prod Sci,1983,10(5):469-477"
[3]SpencerG S G,HallettK G,Fadalla A M" A novel approach to growth promotion using autoimmunization against somatostatin"Ⅲ" Effects in a commercial breed of sheep[J]" Livest Prod Sci,1985,13(1):43-52"
[4]Mears G J" Immunization of lambs against somatostatin to improve growth rate[J]" Canadian Journal of Animal Science,1990,70(4):1091-1097"
[5]Sun Y X,Drane G L,Currey S D,et al" Immunization against somatotropin release inhibiting factor improves digestibility of food,growth and wool production of crossbred lambs[J]" Crop and Pasture Science,1990,41(2):401-411"
[6]Ingvartsen K L,Sejrsen K" Effect of immunization against somatostatin(SS)in cattle:a review of performance,carcass composition and possible mode of action[J]" Acta Agriculturae Scandinavica A-Animal Sciences,1995,45(2):124-131"
[7]Dawson J M,Soar J B,Buttery P J,et al" The effect of immunization against somatostatin and β-agonist administration alone and in combination on growth and carcass composition in young steers[J]" Animal Science,1997,64(1):37-51"
[8]Buonomo F C,Sabacky M J,Della-Fera M A,et al" Effects of somatostatin immunoneutralization on growth and endocrine parameters in chickens [J]" Domestic Animal Endocrinology,1987,4(3):191-200"
[9]刘永庆,陈溥言,杜念兴,等"非激素类免疫制剂促动物生长的研究进展[J]"中国兽医学报,2002,22(1):102-104"
[10]Shen L P,Rutter W J" Sequence of the human somatostatin I gene[J]" Science,1984,224(4645):168-171"
[11]萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯T"分子克隆实验指南[M]" 2版"北京:科学出版社,1992:16-69,304-340,852-898"
[12]Harwood A J" Basic DNA and RNA protocols[M]" Totowa,New Jersey:Humana press,1996:93-96"
[13]毕爱华,龚非力"医学免疫学[M]"北京:人民军医出版社,1995:68-75"
[14]丁玄宙"巨噬细胞功能的神经内分泌调节[J]"生理科学进展,1989,20(1):33-35"
[15]Clark R" The somatogenic hormones and insulin-like growth factor-1:stimulators of lymphopoiesis and immune function[J]" Endocrine Reviews,1997,18(2):157-179"
[16]Kelley K W" Growth hormone,lymphocytes and macrophages[J]" Biochemical Pharmacology,1989,38(5):705-713"
(责任编辑:程智强)
Expression of pET-32a vector-mediated somatostatin gene in E.coil
CHEN Lei1,2,LIU Cheng-qian2,LI Hong2,YI Jian-zhong2*,WANG Jing1,2,SUN Xiao-yun1,2
(1College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China;2Animal Husbandry and Veterinary Research Institute,Shanghai Academy of Agricultural Sciences,Shanghai 201106,China)
Abstract:In order to construct pET-32a-2SS28-SS14 and pET-32a-3SS28 prokaryotic expression plasmids and detect their expression in E.coil,both SS14 and SS28 somatostatin genes were cloned into pET-32a vector;and after enzyme digestion and sequencing,the inducible expression of target proteins was conducted at 37℃by using different final concentrations of IPTG" The Western blot showed that the induction at different final concentrations of IPTG had an insignificant effect on the expression of target proteins,and the induced expression molecular weights of both somatostatin genes were 28" 4 kD and 29" 8 kD respectively" The products were mainly a soluble protein and less inclusion body" The research laid the basis for production and application of somatostatin engineering vaccine"
Key words:Somatostatin;Expression plasmid;Western bolt
*通信作者,E-mail:yijianzhong@yahoo" com
作者简介:陈磊(1987—),男,硕士,主要从事亚单位疫苗研究。Tel:021-62204612,E-mail:64052087@163" com
收稿日期:2015-04-07
文章编号:1000-3924(2016)01-015-04
中图分类号:Q78
文献标识码:A
