猪圆环病毒2型Rep基因真核表达载体的构建和免疫原性分析
2016-04-07刘成倩易建中于宗幸孙晓云
王 静,刘成倩,李 红,易建中*,于宗幸,陈 磊,孙晓云
(1上海海洋大学水产与生命学院,上海201306;2上海市农业科学院畜牧兽医研究所,上海201106)
猪圆环病毒2型Rep基因真核表达载体的构建和免疫原性分析
王 静1,2,刘成倩2,李 红2,易建中2*,于宗幸1,2,陈 磊1,2,孙晓云1,2
(1上海海洋大学水产与生命学院,上海201306;2上海市农业科学院畜牧兽医研究所,上海201106)
摘 要:根据GenBank发表的猪圆环病毒2型(PCV2)基因序列设计并合成1对特异性引物,进行PCR扩增,从PCV2突变株中扩增出PCV2 Rep基因,对PCR扩增产物清洁后进行双酶切,连接到pEGFP-C1载体上,转化到大肠杆菌DH5α感受态细胞中,经PCR筛选和测序后鉴定出正确的重组基因,完成真核表达载体的构建。将重组质粒转染到PK15细胞中,收取病毒液抽提DNA,PCR检测到Rep基因,证明转染是成功的。进行间接免疫荧光试验,可以检测Rep基因在PK15细胞中的表达,试验结果很好的验证了Rep基因的免疫原性。这为进一步研究PCV2的生物学活性及PCV2新型疫苗奠定了坚实的基础。
关键词:猪圆环病毒2型;Rep基因;真核表达载体;间接免疫荧光
猪圆环病毒(Porcine circovirus,PCV)是已知的最小的动物病毒之一,为单股环状DNA病毒[1]。根据其抗原性和基因组组成的不同,可分成2种类型,即PCV1和PCV2[2-3]。PCV1没有致病性,研究的不多;PCV2有致病性,可经口腔、呼吸道等多种途径感染不同年龄的猪[4],引起断奶仔猪多系统衰竭综合征(PMWS)。此病目前呈世界性分布[5],给养猪业带来了巨大的损失。并且PCV2能够破坏猪体免疫系统,形成免疫抑制,诱发多种病原混合感染或继发感染,导致难以控制的严重疾病[6]。
PCV2病毒有11个开放阅读框,即OPF1—ORF11,其中,ORF1和ORF2是主要的2个阅读框。ORF1是最大的开放阅读框,位于核苷酸的正链上,编码病毒的复制酶蛋白(Rep),参与病毒的复制[7]。PCV2 Rep基因的大小为945 bp,编码314个氨基酸,具有严格的保守性[8]。
本研究通过PCR方法扩增出Rep基因,并克隆到真核表达载体pEGFP-C1上,转染到PK15细胞中,研究Rep基因在PK15细胞上的表达特性,建立猪圆环病毒间接免疫荧光技术。此技术具有良好的敏感性和特异性,可为PCV2疫苗提供必要的抗体检测方法,进一步为PCV2疫苗的研究奠定基础。
1 材料与方法
1.1 材料
感受态细胞DH5α、PCV2全基因组突变质粒、真核表达载体pEGFP-C1均为上海市农业科学院畜牧兽医研究所禽病防控研究室保存。内切酶AgeⅠ、XhoⅠ、T4 DNA连接酶均购自Thermo Scientific公司。高保真PCR扩增KOD酶购自TaKaRa公司。Taq DNA聚合酶购自北京全式金生物公司。转染试剂Lipofectamine©2000 Reagent购自Lifetech公司。
1.2 引物设计与合成
根据GenBank发表的PCV2基因序列(登陆号:DQ180392" 1)设计并合成Rep基因的特异性引物,在引物的上、下游分别加入AgeⅠ、XhoⅠ这两个酶切位点。引物序列为:
PCV-Rep-F(AgeⅠ):5’-GTATGACCGGTCGCCACCATGCCCAGCAAGAAGAGTGG-3’;
PCV-Rep-R(XhoⅠ):5’-TTCGACTCGAGTCAGTAATTTATTTCATATGGAAAT-3’。
引物由上海捷瑞生物工程有限公司合成。
1.3 PCV2 Rep基因的PCR扩增
以PCV2全基因组突变质粒为模板进行PCV2 Rep基因的PCR扩增。扩增体系为质粒稀释10倍作为模板取2 μL,10×Buffer(Mg2+free)5 μL,dNTP(2 mmol/L)5 μL,MgSO44 μL,上、下游引物(10 μmol/L)各1" 5 μL,KOD酶2 μL,ddH2O 29 μL,操作时在冰上进行。PCR的反应条件:94℃预变性4 min;94℃变性40 s,56℃退火30 s,68℃延伸90 s,35个循环;68℃再延伸10 min。PCR结束后取5 μL在1%琼脂糖凝胶电泳,用紫外分析仪观察条带大小,判断是否为目的条带。
1.4 PCV2 Rep基因的真核表达载体的构建和鉴定
用限制性内切酶AgeⅠ和XhoⅠ分别对PCV2 Rep基因的PCR清洁产物和表达载体pEGFP-C1双酶切,取3 μL琼脂糖电泳,观察目的条带正确后,将纯化回收的PCR清洁产物与载体pEGFP-C1连接,连接产物转化到大肠杆菌DH5α感受态细胞中。通过PCR筛选出含有目的片段的重组菌,送到铂尚生物技术(上海)有限公司测序。取测序正确的抽提质粒,命名为C1-Rep,双酶切确定重组质粒的正确性。
1.5 重组质粒转染PK15细胞
将在96孔、24孔细胞培养板上制备的长成单层的PK15细胞各以PBS冲洗2次,按照转染说明书,将经过转染试剂处理的重组质粒分别加入细胞培养板孔,编号。37℃、5%CO2培养箱中培养约6 h,换加2%血清的DMEM细胞液,再培养72 h。同时设立不转染的正常PK15细胞作阴性对照。PCV病毒液感染作为阳性对照。
1.6 重组质粒转染PK15细胞的检测
在培养箱培养72 h后,将24孔板直接放入-80℃冰箱,反复冻融3次后,2 000 g离心10 min,取上清,用酚氯仿法抽提DNA。
以抽提的DNA为模板进行PCR检测,引物采用PCV2-Rep-F/R,模板取4 μL,10×Buffer(Mg2+)2" 5 μL,dNTP(10 mmol/L)1 μL,上、下游引物(10 μmol/L)各1 μL,Taq酶0" 3 μL,加ddH2O补至25 μL。反应结束后,取PCR产物5 μL在1%琼脂糖胶上电泳。
1.7 免疫荧光试验
将96孔板中的细胞培养液倒去,于各孔中加入100 μL-20℃预冷的75%乙醇,4℃放置0" 5 h固定。随后,弃去乙醇,PBS洗涤2次,务必使有机溶剂挥发干净。之后,用5%脱脂奶粉在37℃恒温培养箱中封闭50 min。结束后,每孔加入100 μL用5%脱脂奶稀释的PCV一抗,稀释比例为1∶1 500,37℃作用1" 5 h。PBS洗3次后每孔加入一定稀释度的FITC标记山羊抗猪IgG,37℃避光作用1 h。PBS洗3次后甩干,镜检。
2 结果与分析
2.1 PCV2 Rep基因的PCR扩增
以PCV2全基因组质粒为模板,以PCV2-Rep-F、PCV2-Rep-R为引物进行PCR扩增,扩增得到的片段全长约为945 bp(图1),与预期片段相符。

图1 PCV2-Rep基因的PCR扩增Fig.1 PCR amplification of PCV2-Rep gene
2.2 C1-Rep基因的真核表达载体的构建和鉴定
将pEGFP-C1质粒与PCV2 Rep基因的PCR扩增产物分别用Age I和Xho I双酶切连接后,挑取转化后的菌落进行PCR筛选,在1%琼脂糖凝胶中点样电泳,能检测到约945 bp的基因片段即阳性菌(图2)。
经测序正确后的阳性菌接菌后提取质粒,分别用Age I和Xho I进行双酶切鉴定,得到约4 731 bp和945 bp 2个片段,分别与载体和Rep基因的长度一致(图3)。

图2 重组质粒阳性菌的筛选电泳图Fig.2 Screening electropherogram of recombinant plasmid’s Gram-positive bacteria
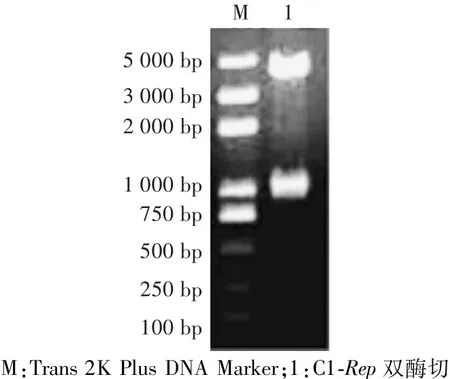
图3 重组质粒的酶切鉴定电泳图Fig.3 Enzyme digestion electropherogram of recombinant plasmid
2.3 重组质粒转染PK15细胞的检测
重组质粒转染PK15细胞后,经过72 h的培养反复冻融后收取上清液,提取上清液中的DNA,用PCR方法检测。通过在1%琼脂糖凝胶中点样电泳,在C1-Rep重组质粒和阳性对照中均观察到约945 bp的基因片段,阴性对照则无。说明重组质粒转染PK15细胞后收取的上清液中含有Rep基因,重组质粒成功转染PK15细胞,符合预期结果(图4)。
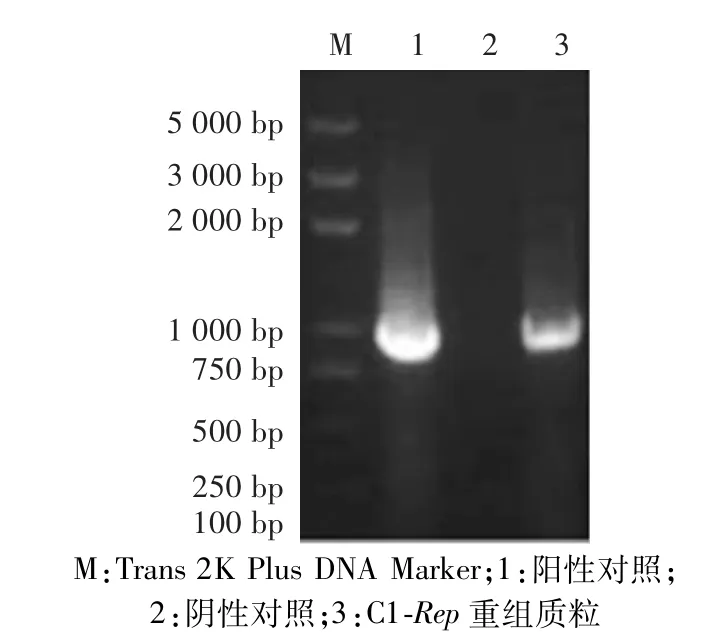
图4 病毒液DNA PCR检测电泳图Fig.4 PCR electropherogram of virus liquid’s DNA
2.4 重组质粒的免疫荧光试验试验
重组质粒转染PK15细胞后,经过72 h的培养进行免疫荧光试验,通过荧光显微镜观察,根据荧光的强弱判断免疫荧光的结果,阳性细胞孔内可观察到典型的特异性亮绿色荧光,而阴性对照的细胞孔内无特异性绿色荧光。设定PCV病毒液感染的PK15细胞孔为阳性对照,单纯PK15细胞孔为阴性对照。由观察可见,在C1-Rep重组质粒和阳性对照中发现绿色荧光,阴性对照没有(图5)。

1:阳性对照;2:C1-Rep重组质粒;3:阴性对照图5 重组质粒的免疫荧光试验(100×)Fig.5 Immunofluorescence assay of recombinant plasmid(100×)
3 讨论
一般认为,PCV2-OPF2编码病毒的主要结构蛋白,即Cap蛋白,是PCV2的主要免疫保护性抗原,对PCV2疫苗的研究有重要的意义,研究较多,本实验室亦成功构建了Cap基因的原核表达载体并表达[9],验证了Cap蛋白的反应原性。而对Rep蛋白的生物学特性报道不多。Rep蛋白作为PCV2病毒的复制酶蛋白,主要参与病毒的复制。而PCV2只有在动物体内增殖时才可刺激机体产生抗Rep蛋白抗体[10],在PK15细胞中Rep蛋白可以同时存在于细胞浆和细胞核中,随着表达量的高低分布稍有变化,但不表现出对某一方面的亲嗜性[11]。有报道说明Rep基因上含有一个优势免疫反应区[12],有一定的免疫原性。
间接免疫荧光试验作为实验室检测PCV2的方法之一,宜用于检测细胞培养物中的PCV2[13]。本研究通过间接免疫荧光试验检测PCV2 Rep蛋白在PK15细胞中的表达情况,说明构建的真核PCV2 Rep基因在PK15上可以表达,初步确定了Rep蛋白的免疫原性,为接下来的研究提供了检测依据和实验基础。因为没有一个定量指标,本实验无法准确的测定蛋白表达的多少,有待于下一步研究。
参 考 文 献
[1]Tischer I,Gelderblom H,Vettermann W" A very small porcine virus with a circular single stranded DNA[J]" Nature,1982,295:64-66"
[2]Allan G M,Phenix K V,Todd D" Some biological and physico-chemical proporties of porcine circovius[J]" J Vet Med,1994,41:17-26"
[3]Mankertz A,Hillenbrand B" Analysis of transcription of porcine circovirus type 1[J]" J Gen Viral,2002,83(11):2743-2751"
[4]Stevenson G W,Kiupel M,Mittal S K" Ultera-structure of papovavirus-and picornavirus-like particles in permanent pig kidney cell lines[J]" Vet Path,1999,36:36-378"
[5]杨汉春"猪免疫抑制性疾病的流行特点与控制对策[J]"中国畜牧兽医,2004,31(5):41-43"
[6]Chae C" A review of porcine circoviruses 2-associated syndromes and diseases[J]" Vet J,2005,169(3):326-336"
[7]张艳霞,朱连德"猪圆环病毒疫苗应用现状[J]"猪业科学,2011,28(11):32-34"
[8]郭颖初,王开功,周碧君,等"猪圆环病毒2型ORF1基因的克隆与原核表达[J]"中国畜牧兽医,2013,40(11):30-33"
[9]范兴琼,刘成倩,易建中,等"猪圆环病毒2型Cap基因原核表达载体的构建及表达[J]"上海农业学报,2014,30(1):49-53"
[10]Liu Q,Wang L,Willson P,et al" Quantitative,competitive PCR analysis of porcine circovirus DNA in serum from pigs with postweaning multisystemic wasting synarome[J]" J Clin Microbiol,2000,38(9):3474-3477"
[11]申会刚,周继勇,陈庆新,等"猪圆环病毒Ⅱ型Rep基因在PK15细胞中的表达及特性[J]"中国兽医学报,2005,25(3):244-246"
[12]Mahe D,Blanchard P,Truong C,et al" Differential recognition of ORF2 protein from type1 and type2 porcine circoviruses and identification of immunorelevant epitopes[J]" J Gen Virol,2000,81(7):1815-1824"
[13]蒋成砚,李开明,谢昆,等"猪圆环病毒2型检测技术研究进展[J]"中国畜牧兽医,2012,39(1):188-191"
(责任编辑:程智强)
Construction andimmunogenicity analysis of eukaryotic expression vector of porcine circovirus type 2 Rep gene
WANG Jing1,2,LIU Cheng-qian2,LI Hong2,YI Jian-zhong2*,YU Zong-xing1,2,CHEN Lei1,2,SUN Xiao-yun1,2
(1College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China;2Animal Husbandry and Veterinary Research Institute,Shanghai Academy of Agricultural Sciences,Shanghai 201106,China)
Abstract:A pair of specific primers was designed and synthesized according to the porcine circovirus type 2(PCV2)gene sequence published in the GenBank,the PCV2 Rep gene was amplified by PCR from mutant strains of PCV2,and after cleaning and double digests the amplified products were connected to the pEGFP-C1 vector and transformed into E.coli DH5α competent cells" The correct recombinant gene was identified by PCR screening and sequencing,indicating the construction of eukaryotic expression vector was finished" The recombinant plasmid was transfected into PK15 cells,and then the virus liquid was collected to extract the DNA" The Rep gene detected by PCR proved that the transfection was successful" The experimental results well verified the immunogenicity of Rep gene in PK15 cells,thus laying a solid foundation for further study of the biological activities and new vaccine of PCV2"
Key words:Porcine circovirus type 2;Rep gene;Eukaryotic expression vector;Indirect immunofluorescence
*通信作者,E-mail:yijianzhong@yahoo" com
作者简介:王静(1989—),女,硕士,主要从事动物疾病的分子生物学及免疫学研究。E-mail:jing1248@126" om
基金项目:上海市科学技术委员会重点科技攻关项目(12391901900)
收稿日期:2015-02-03
文章编号:1000-3924(2016)01-006-04
中图分类号:S852" 65
文献标识码:A
