鸽副黏病毒Ⅰ型(川沙株)纯化及其检验
2016-04-07张俊平蒋凤英杨惠萍李春华倪建平赵本进何锡忠
张俊平,蒋凤英,杨惠萍,李春华,倪建平,赵本进,何锡忠*
(1上海市农业科学院畜牧兽医研究所,上海201106;2上海佳牧生物制品有限公司,上海201106)
鸽副黏病毒Ⅰ型(川沙株)纯化及其检验
张俊平1,2,蒋凤英1,2,杨惠萍1,李春华1,2,倪建平2,赵本进2,何锡忠1,2*
(1上海市农业科学院畜牧兽医研究所,上海201106;2上海佳牧生物制品有限公司,上海201106)
摘 要:在鸽副黏病毒Ⅰ型(川沙株)分离鉴定试验确定为鸽副黏病毒Ⅰ型强毒株的基础上,对该病毒株进行了蚀斑纯化,获得了鸽副黏病毒Ⅰ型(川沙株)纯化毒株,并对纯化株传代后进行无菌检验、血凝试验、血凝抑制试验和病毒含量测定。结果显示,该纯化毒株纯净、有血凝性和血凝抑制性,病毒含量为108" 5ELD50/0" 1 mL,初步判定纯化的鸽副黏病毒Ⅰ型(川沙株)可作为鸽副黏病毒Ⅰ型灭活疫苗(S-1株)免疫效力试验攻毒毒株。
关键词:鸽副黏病毒Ⅰ型;纯化;检验
鸽副黏病毒Ⅰ型(Pigeon Paramyxovirusl,PPMV-Ⅰ)病又称鸽新城疫,是由禽Ⅰ型副黏病毒(Avian Paramyxovirusl,APMV-1)引起的急性、高度接触性传染病,以肠炎、严重下痢和神经症状为特征,是危害养鸽业的主要疫病之一[1-2]。该病于1981年首先在苏丹和埃及的信鸽中发现,随后迅速传播到欧洲、美国、加拿大等地[1-3],我国1985年在香港进口种鸽中分离到此病毒,同年8月珠海拱北动物检疫局在中国台湾引进的种鸽中也检出该病毒,现全国大多数地区已有发病报道[4-6]。目前我国控制鸽副黏病毒Ⅰ型病多用鸡新城疫疫苗,在一些鸽场起到了一定的预防作用,但该病仍有发生,常出现免疫失败[7-8]。目前没有针对此病的特效药,比较成熟、免疫效果好的专用疫苗尚未见报道[9]。为了有效预防该病,开展鸽副黏病毒Ⅰ型灭活疫苗(S-1株)的研制及疫苗免疫效力试验是必不可少的,免疫效力的成败与选择的攻毒用强毒株的纯净及毒力直接相关。在对鸽副黏病毒Ⅰ型分离株(川沙株)分离鉴定试验确定为鸽副黏病毒Ⅰ型强毒株的基础上,本研究通过蚀斑纯化获得鸽副黏病毒Ⅰ型(川沙株)纯化株,并对纯化株进行了相关检验,以期为鸽副黏病毒Ⅰ型灭活疫苗(S-1株)的研究奠定基础。
1材料与方法
1.1 材料
1" 1" 1 毒株
鸽副黏病毒Ⅰ型(川沙株)第5代(E5代)由上海市农业科学院畜牧兽医研究所分离、鉴定、保存。
1" 1" 2 试剂
DMEM干粉、琼脂糖、特级新生牛血清(FBS)购自GIBCO BRL公司;中性红购自上海试剂三厂;胰蛋白酶购自上海化学试剂站。
1" 1" 3 试验动物
SPF鸡胚为购自梅里亚-维通实验动物技术有限公司的SPF种蛋自行孵化至所需的日龄获得。
1" 1" 4 无菌检验用培养基
硫乙醇酸盐培养基(T" G)小管、酪胨琼脂(G" A)斜面、葡萄糖蛋白胨(G" P)按常规方法[10]配制。
1" 1" 5 1%红细胞悬液
取SPF青年鸡血液,按常规方法[10]洗涤制备。
1" 1" 6 参考血清
抗鸡NDV阳性血清、EDS76V阳性血清购自中国兽医药品监察所;AIV-H5、AIV-H9、AIV-H7阳性血清购自哈尔滨兽医研究所。
1.2 方法
1" 2" 1 病毒鸡胚复壮
将本实验室保存的鸽副黏病毒Ⅰ型(川沙株)E5代用灭菌生理盐水按照1∶10 000稀释,经尿囊腔接种10日龄SPF鸡胚15枚,0" 1 mL/枚,37℃继续孵育,24 h照蛋,将死亡鸡胚弃去,以后每6 h照蛋1次,将死亡鸡胚随时取出放于4℃冰箱冷藏,直至56 h全部取出,收获死亡鸡胚尿囊液,混合后分装于西林瓶中,标记为E6代,冷冻保存备用。
1" 2" 2 病毒细胞培养
将E6代病毒冻融1次,按总量10%接种鸡胚成纤维细胞(CEF)单层,37℃吸附1 h,将接种液弃去,加入含2%血清的DMEM营养液,37℃、5 mol/L CO2饱和湿度培养箱中培养,逐日观察病变,当细胞病变达到80%时收获病毒。连续传3代,分别标为C1代、C2代、C3代,冷冻保存备用。
1" 2" 3 病毒蚀斑纯化
用琼脂法做蚀斑。取细胞毒C3代用DMEM倍比稀释,取10-4—10-85个稀释度,按10%接种CEF单层(弃去培养液,用DMEM洗涤2次),每个稀释度接种3个孔,37℃吸附1 h,用DMEM洗涤2次,加入3%预热的琼脂与含4%FBS的2×DMEM混合液,37℃、5%CO2环境中避光培养,每隔6 h观察1次蚀斑形成情况,待蚀斑形成后选取最高稀释度1个典型蚀斑用毛细吸管挑斑,将蚀斑再分别接种CEF单层进行反复纯化4代,获得鸽副黏病毒Ⅰ型(川沙株)纯化株,标记为A1代、A2代、A3代、A4代。
1" 2" 4 纯化病毒细胞扩增
将形成CEF单层的细胞培养瓶弃去培养液,用DMEM洗涤2次,A4代种毒用DMEM 1∶10稀释接毒,37℃、5%CO2环境中培养,逐日观察病变,当细胞病变达到80%时收获病毒,获得鸽副黏病毒Ⅰ型(川沙株)纯化细胞毒,标记为A4C1,冷冻保存备用。
1" 2" 5 纯化株细胞毒鸡胚传代
按常规方法取原倍、1∶500、1∶1 000、1∶10 000稀释的A4C1病毒液尿囊腔接种10日龄SPF鸡胚,观察鸡胚的死亡情况,直至48 h全部取出,收获死亡鸡胚尿囊液,获得鸽副黏病毒Ⅰ型(川沙株)纯化鸡胚毒,标记为A4E1代、A4E2代、A4E3代、A4E4代,冷冻保存备用。
1" 2" 6 无菌检验
按常规方法[10]对鸽副黏病毒Ⅰ型(川沙株)收获尿囊液、细胞毒、纯化株细胞毒和纯化鸡胚毒进行无菌检验。
1" 2" 7 血凝(HA)和血凝抑制(HI)试验
应用β-微量法,对鸽副黏病毒Ⅰ型(川沙株)收获尿囊液、细胞毒、纯化株细胞毒和纯化鸡胚毒进行血凝效价测定,并用鸡新城疫(ND)标准阳性血清、EDS76V阳性血清和AIV-H5、AIV-H9、AIV-H7阳性血清进行HI试验[11]。
1" 2" 8 鸽副黏病毒Ⅰ型(川沙株)A4E3代病毒含量测定
按常规方法[11]测定A4E3代病毒液病毒含量,计算其ELD50。
2 结果与分析
2.1 病毒蚀斑纯化结果
鸽副黏病毒Ⅰ型(川沙株)C3代病毒接种CEF后60 h左右形成不同大小的蚀斑,挑取单个蚀斑进行传代,传两代后,出斑时间和蚀斑大小趋于稳定,大约在2 mm(图1)。

图1 纯化后蚀斑(川沙株)Fig.1 The purified plaque(Chuansha strain)
2.2 无菌检验结果
对鸽副黏病毒Ⅰ型(川沙株)收获尿囊液、细胞毒、纯化株细胞毒和纯化鸡胚毒进行无菌检验,结果均为阴性。
2.3 血凝(HA)和血凝抑制(HI)试验结果
对鸽副黏病毒Ⅰ型(川沙株)收获尿囊液、细胞毒、纯化株细胞毒和纯化鸡胚毒进行HA和HI测定,结果见表1,根据HA试验结果判定病毒含量测定选择A4E3代。

表1 HA和HI试验结果Table 1 Results of hemagglutination test(HA)and hemagglutination-inhibition test(HI)
2.4 鸽副黏病毒Ⅰ型(川沙株)A4E3代病毒含量测定
由表2可见,鸡胚集中死亡时间为60 h内,病毒含量为108" 5ELD50/0" 1 mL,符合副黏病毒强毒株致鸡胚死亡时间规律。
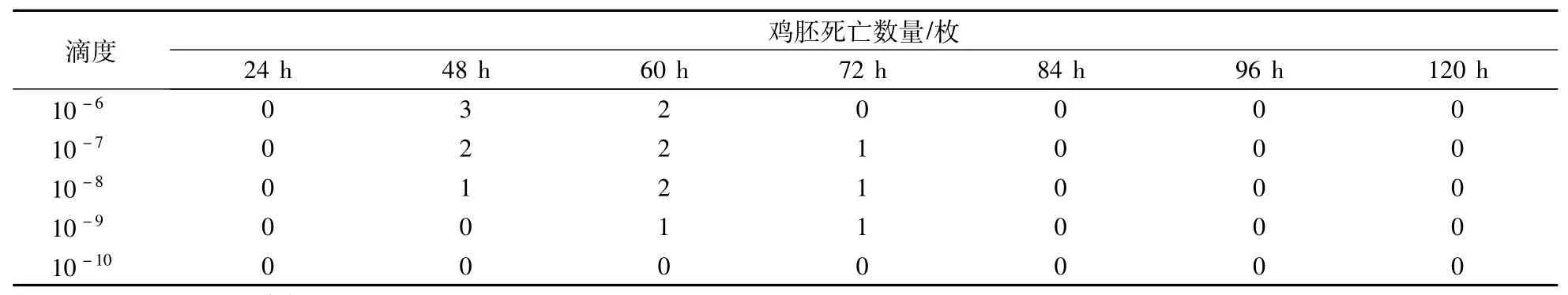
表2 病毒含量测定结果Table 2 Determination results of virus content
3 结论与讨论
3" 1 本试验通过对纯化株细胞传代和鸡胚传代获得纯化株的传代病毒,并对纯化株的传代病毒进行了无菌检验、血凝试验、血凝抑制试验和病毒含量测定。试验结果表明:该纯化毒株无菌,具有血凝性,能被ND阳性血清抑制,但不能被禽流感H5、H7、H9株阳性血清、EDS76阳性血清所抑制,因此判定该纯化病毒为鸽副黏病毒Ⅰ型(川沙株)纯化株。鸡胚测定病毒含量为108" 5ELD50/0" 1 mL,鸡胚集中死亡时间为60 h内,符合副黏病毒强毒株致鸡胚死亡时间规律。
3" 2 由于直接从病死鸽体内用SPF鸡胚分离获得的病毒可能不单纯为一种病毒,若要想获得纯净的一种病毒必须对分离株进行纯化。本实验室通过蚀斑纯化的方法对鸽副黏病毒Ⅰ型(川沙株)进行了纯化。
3" 3 本实验室通过对鸽副黏病毒Ⅰ型(川沙株)分离鉴定[12]测得致死鸡胚的平均死亡时间(MDT)为55" 2 h,脑内致病指数(ICPI)为1" 8,静脉致病指数(IVPI)为2" 39,鸽副黏病毒Ⅰ型(川沙株)攻毒剂量确定[13]判定该病毒为鸽副黏病毒Ⅰ型强毒株。因此,初步判定鸽副黏病毒Ⅰ型(川沙株)纯化株可作为研究鸽副黏病毒Ⅰ型疫苗免疫效力试验攻毒毒株。
参 考 文 献
[1]Alexander D J" Avian paramyxoviride recent developments[J]" Vet Microbiol,1990,23:103-104"
[2]Alexander D J,Russell P H,Parson G,et al" Antigenic and biological characterization of avian paramyxovirus typeⅠisolates from pigeon an international collaboration study[J]" Avian Pathol,1985,14:365-376"
[3]Alexander D J,Russell P H,Collins M S" Paramyxovirus typeⅠinfections of racing pigeon:characterization of isolated viruses[J]" Veterinary Record,1984,114:444-446"
[4]刘业兵,田春利,胡艳丽,等"鸽Ⅰ型副黏病毒的分离鉴定及生物学特征研究[J]"中国家禽,2006,28(24):63-65"
[5]陈钟鸣,刘怀然,孙敏华,等"鸽Ⅰ型副黏病毒的分离鉴定及其F基因、HN基因的序列分析[J]"中国兽医学报,2010,30(9):1167-1172"
[6]隋修锟,李刚,李铁,等"四株鸽Ⅰ型副黏病毒的分离鉴定及基因型分析[J]"中国兽医科学,3013,43(2):136-140"
[7]崔晓萍,秦爱建,崔治中,等"鸽新城疫病毒的分离及鸽群自然感染状况的调查[J]"中国兽药杂志,2000,31(2):6-10"
[8]杨瑛"鸽新城疫野毒株的分离及生物学特性研究[J]"畜牧与兽医,1998(5):198-199"
[9]陈丽君"鸽Ⅰ型副黏病毒(HT-40)的纯化与防治试验研究[D]"保定:河北农业大学,2007"
[10]中华人民共和国农业部"中华人民共和国兽用生物制品规程2000年版[Z]"北京:化学工业出版社,2000"
[11]中国兽药典委员会"中华人民共和国兽药典二〇一〇年版三部[S]"北京:中国农业出版社,2010"
[12]张俊平,杨惠萍,蒋凤英,等"鸽副黏病毒Ⅰ型(川沙株)的分离鉴定[J]"中国兽药杂志,2013,47(11):13-17"
[13]张俊平,杨惠萍,蒋凤英,等"鸽副黏病毒Ⅰ型(川沙株)攻毒剂量研究[J]"病毒学报,2014,30(2):177-179"
(责任编辑:闫其涛)
Purification and test of pigeon paramyxovirus typeⅠ(Chuansha strain)
ZHANG Jun-ping1,2,JIANG Feng-ying1,2,YANG Hui-ping1,LI Chun-hua1,2NI Jian-ping2,ZHAO Ben-jin2,HE Xi-zhong1,2*
(1Institute of Animal Husbandry&Veterinary Science,Shanghai Academy of Agricultural Sciences,Shanghai 201106,China;2Shanghai Jiamu Biological Products Company Limited,Shanghai 201106,China)
Abstract:On the basis of isolation and identification of pigeon paramyxovirus typeⅠas virulent strain (PPMV-Ⅰ,Chuansha strain),the strain was purified by plaque purification,and the purified strain of pigeon paramyxovirus typeⅠ(Chuansha strain)was obtained" The results of sterility test,hemagglutination test,hemagglutination-inhibition test and virus content determination showed that the purified PPMV-Ⅰwas sterility,with hemagglutination and hemagglutination-inhibition,and the virus content was 108" 5ELD50/0" 1 mL" It was preliminary determined that the purified strain of pigeon paramyxovirus typeⅠ(Chuansha strain)can be used as a pigeon paramyxovirus type I virus inactivated vaccine(S-1 strain)challenge strain for immune efficacy test"
Key words:Pigeon paramyxovirus type I;Purification;Test
*通信作者:何锡忠(1966—),男,硕士,兽医师,研究方向为兽医传染病的诊断和疫苗研制,Tel:13817780200;E-mail:sjhxz@163" com
作者简介:张俊平(1978—),女,硕士,助理研究员,从事动物生物制品研发工作。Tel:15301903906;E-mail:zhangjunping5259@sina" com
基金项目:上海市科委科技支撑项目(133919N2000)
收稿日期:2014-12-17
文章编号:1000-3924(2016)01-029-04
中图分类号:S852" 4
文献标识码:A
