某规模化猪场猪瘟抗体水平的监测
2016-04-07南文金黄健强胡鸿惠吴静波彭国良
南文金,黄健强,胡鸿惠,吴静波,彭国良
(1.韶关学院动物疫病实验室,广东韶关 512005;2.韶关学院英东农业科学与工程学院,广东韶关 512005;3.粤北生猪生产及疫病防控协同创新发展中心,广东韶关 512005)
兽医临床
某规模化猪场猪瘟抗体水平的监测
南文金1,3,黄健强1,3,胡鸿惠1,3,吴静波1,3,彭国良2,3
(1.韶关学院动物疫病实验室,广东韶关 512005;2.韶关学院英东农业科学与工程学院,广东韶关 512005;3.粤北生猪生产及疫病防控协同创新发展中心,广东韶关 512005)
摘要:为了对某猪场猪瘟疫苗免疫效果做出评估并进一步优化免疫程序,应用猪瘟疫苗抗体阻断ELSIA检测试剂盒对该场不同日龄仔猪及育肥猪的猪瘟疫苗抗体水平进行检测,对抗体合格率、平均阻断率和变异系数统计分析。检测数据显示,该猪场猪瘟免疫空白期过长,疫苗免疫接种后抗体合格率较低,增加了感染猪瘟病毒的风险,应及时进行猪瘟免疫程序的优化。猪瘟疫苗抗体水平监测对猪瘟防控具有重要意义,可为规模化猪场开展猪瘟疫苗抗体检测,制定合理的免疫措施提供参考。
关键词:猪瘟; 抗体水平;免疫程序;监测
猪瘟(Classical swine fever, CSF)是一种高度接触性传染病,被世界动物卫生组织(OIE)列为必须报告的动物疫病[1]。猪瘟是危害养猪业发展的主要传染病之一,也是给养猪业带来损失最直接、危害最严重的疫病之一。20世纪50年代我国专家研制的猪瘟兔化弱毒疫苗株经临床应用效果显著,不少国家引进该疫苗后消灭了猪瘟,为世界养猪业做出了巨大贡献。目前,我国对猪瘟采取强制免疫措施,有效的防控了猪瘟的暴发,但经过几十年的发展,猪瘟在我国至今没有被消灭。
近些年,在高密度免疫下,经典猪瘟的发生少有报道,出现了潜伏期长、排毒周期长、临床症状不典型的非典型猪瘟,一旦发生,同样影响猪场生产效益,造成严重经济损失。研究证明,猪瘟兔化弱毒疫苗对当前流行的猪瘟野毒株仍然有良好的保护作用,非典型猪瘟的发生和疫苗的免疫效果关系密切,因此对猪瘟疫苗抗体水平监测,根据抗体水平变化制定科学的免疫程序,提高疫苗免疫效果对防控猪瘟发生具有重要意义[2]。本研究对某规模化猪场猪瘟抗体水平进行监测,通过抗体水平变化分析,对该猪场目前采取的猪瘟免疫程序科学性进行合理评价并提出优化方案,为猪场猪瘟疫苗抗体监测与免疫程序优化提供参考。
1材料与方法
1.1材料
血清样本来自粤北某猪场,该场存栏基础母猪900多头。根据该猪场生产模式情况,分别选择怀孕30 d~40 d的母猪;出生 6 d~8 d、15 d~17 d、20 d~23 d的哺乳仔猪;出生28 d~34 d、37 d~44 d、45 d~51 d、52 d~60 d的保育仔猪和出生61 d~69 d、70 d~82 d、83 d~90 d的育肥猪,每一阶段(批)的猪群中随机选择10头猪前腔静脉采血3 mL~5 mL,共计110份血液样品,实验室常规方法分离制备血清,4℃冷藏待检。猪瘟病毒抗体阻断ELISA检测试剂盒,美国Idexx公司产品,批号:D361。
1.2方法
1.2.1猪瘟免疫接种信息调查 认真调查该场猪瘟免疫程序,样品采集时查看每一批次猪群的猪瘟疫苗详细免疫接种记录,包括免疫接种日期、疫苗生产厂家及规格、免疫接种剂量等免疫信息。
1.2.2猪瘟病毒抗体检测按照美国Idexx公司猪瘟病毒抗体阻断ELISA检测试剂盒操作说明书进行,检测前试剂盒和检测样本恢复至室温,试剂盒反应步骤置于23℃恒温箱中进行孵育。
1.2.3试验成立条件及结果计算按照试剂盒要求,只有阴性对照的平均OD值大于0.500,阳性对照的阻断率大于50%时,该检测结果才能有效。阻断率=(阴性对照平均OD值-样本OD值)/阴性对照平均OD值×100%。
1.2.4检测结果判断标准如果被检测样本的阻断率大于或等于40%,该样本可以判断为阳性(有CSFV抗体存在);如果被检测样本的阻断率小于或等于30%,该样本就可以判为阴性(无抗CSFV抗体存在);如果被检测样本的阻断率在30%~40%之间,则数据可疑,应在数日后再对该动物进行重测。如果被检测样本阻断率大于等于50%,该样品猪瘟抗体水平为合格,即能提供有效的保护力。
2结果
2.1该场猪瘟疫苗免疫接种信息调查
经过现场调查和查看该场猪群猪瘟疫苗免疫接种记录,该场猪瘟疫苗一直使用某公司生产的ST猪瘟活疫苗(传代细胞源)。母猪猪瘟的免疫程序为普免和跟胎免疫接种相结合方式,即每年春秋两季集中免疫接种2次,每窝仔猪断奶当天母猪再跟胎免疫接种1次,免疫接种剂量为4头份/头;商品代猪21日龄左右首免猪瘟疫苗1头份,60日龄左右二免猪瘟疫苗2头份。根据每批商品代猪群猪瘟免疫接种记录可以详细了解采样时各个批次猪群的猪瘟免疫接种信息,准确计算该猪群猪瘟疫苗距离首免和二免猪瘟疫苗的时间(表1)。
2.2母猪猪瘟疫苗抗体水平检测结果
对采集的怀孕母猪猪瘟疫苗抗体检测结果表明(表1),该场怀孕母猪猪瘟疫苗抗体水平合格率达到100%,平均阻断率为82.3%,变异系数为17.31%。
2.3哺乳仔猪猪瘟疫苗抗体水平结果
表1数据统计显示,哺乳仔猪高水平母源抗体维持到2周龄左右,仔猪在出生后1周龄左右(出生6日龄~8日龄)母源抗体平均阻断率为70.0%,抗体阳性率和合格率均为90%,在采集的15日龄~17日龄的仔猪样品母源抗体水平平均阻断率略有上升,达到71.3%,母源抗体阳性率和合格率还能达到90%,采集的20日龄~23日龄哺乳仔猪猪瘟病毒母源抗体抗体水平开始下降,抗体平均阻断率为66.0%,抗体阳性率和合格率下降到70%。
2.4猪瘟疫苗免疫接种后抗体水平变化情况
研究分别采集了该场猪瘟疫苗首免后和二免后不同时间猪群样本进行猪瘟疫苗抗体水平检测,表1显示,猪瘟疫苗首免后抗体水平开始下降,抗体离散度增加。首免后5 d猪瘟疫苗抗体合格仅为40%,平均阻断率为44.2%;首免后20 d抗体阳性率为20%,抗体合格率为0,抗体水平平均阻断率仅为27.9%;首免后26 d抗体阳性率和合格率分别为20%和10%,平均阻断率和免疫接种后20 d相比没有明显提升;首免后36 d阻断率上升到39.5%,样品阳性率和合格率开始缓慢上升到40%和30%;猪瘟疫苗首免后45 d,二次免疫接种后6 d所采集的仔猪样品猪瘟疫苗抗体阳性率和合格率才分别上升到80%和70%,抗体水平平均阻断率也达到62.9%,但较高水平猪瘟疫苗抗体并没有维持较长时间,在采集的出生83日龄~90日龄猪群样品,即猪瘟二免后23 d,猪瘟疫苗抗体已经下降到很低水平,虽然抗体阳性率为50%,但合格率仅为10%。
2.5猪瘟疫苗免疫接种对猪群抗体水平变化的影响
将采集的该场商品代猪群猪瘟疫苗抗体阳性率、合格率、平均阻断率和变异系数以柱形图进行表示,对猪瘟疫苗两次免疫接种前后抗体水平变化情况进行比较分析,从图1可以看出,在猪瘟疫苗首免前仔猪猪瘟母源抗体水平都维持在较高水平,抗体变异系数相对较低;仔猪进行猪瘟疫苗首次免疫接种后,采集的各阶段猪群样品抗体阳性率、合格率和平均阻断率都迅速下降,抗体水平变异系数也呈增高趋势,除首免后23 d,即出生45 d~51 d仔猪群抗体水平变异系数在30%左右外,其他日龄猪群抗体变异系数都在50%以上,其中首次免疫接种猪瘟疫苗后26 d(出生52 d~60 d猪群),样品抗体变异系数高达68.05%;首次免疫接种后45 d,二次免疫接种后6 d(出生70 d~82 d猪群),抗体水平才明显提高,抗体均匀度也显著改善,抗体合格率达到70%,变异系数降低到30%以下;二次免疫接种后23 d(出生83 d~90 d猪群)采集的样品猪瘟疫苗抗体水平再次降低,变异系数升高到50%以上。
2.6该猪场猪瘟免疫效果评价及免疫方案优化
根据猪瘟疫苗抗体检测结果数据统计分析,该猪场猪瘟疫苗免疫程序不科学,21日龄左右首免时间过早,来自疫苗的抗原被高水平母源抗体中和了,少量的疫苗抗原无法刺激机体免疫反应,导致母源抗体迅速下降而疫苗刺激机体抗体上升缓慢;间隔40 d左右进行猪瘟疫苗二免时按常规免疫接种剂量进行免疫操作,而此时一免产生的抗体正处于高峰,二次免疫接种的疫苗抗原再次被抗体中和,形成免疫复合物被机体免疫系统清除,无法激活免疫记忆细胞启动体液免疫机制迅速产生疫苗抗体,导致二免后20多天猪瘟抗体水平不升反降。鉴于该猪场母猪猪瘟抗体水平较高,结合仔猪抗体检测结果,可以采用30日龄~35日龄首次免疫接种猪瘟疫苗,60日龄~65日龄进行猪瘟二次免疫接种,具体免疫效果还需进一步监测。
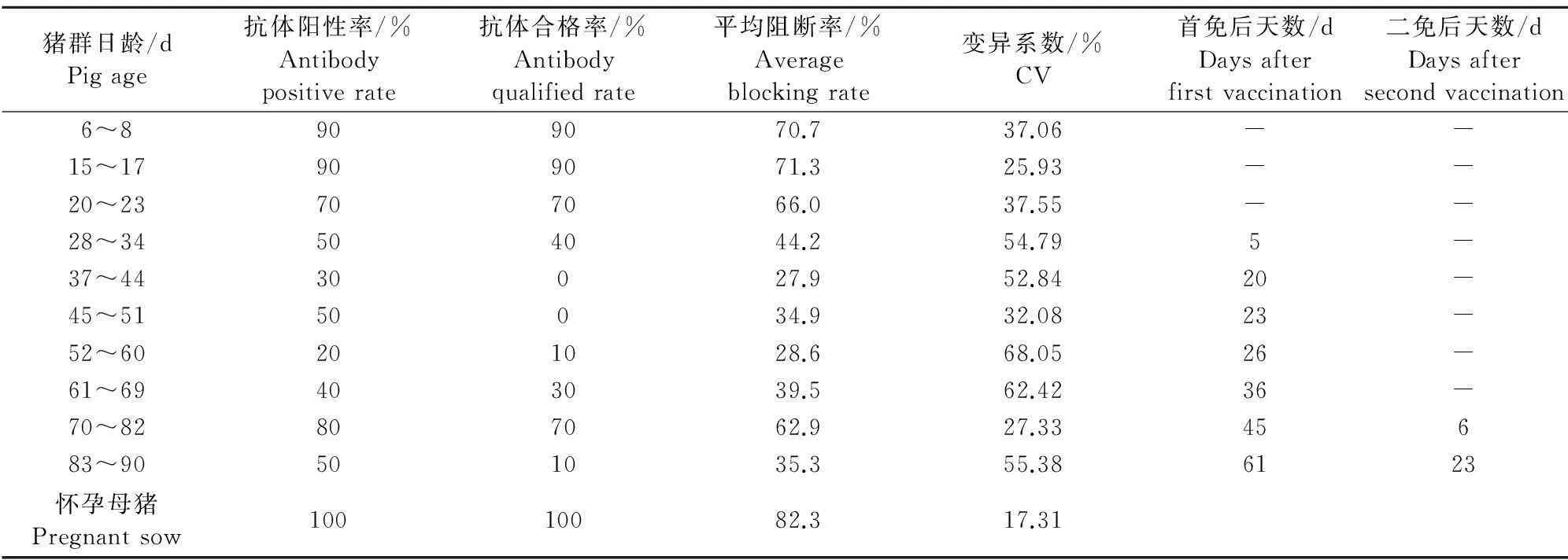
表1 猪瘟疫苗血清抗体水平统计结果
注:“-”未进行免疫接种。
Note: "-"non vaccination.

图1 猪瘟疫苗免疫接种对猪瘟抗体水平变化的影响
3讨论
抗体监测在猪瘟免疫效果评价及免疫程序制定中具有重要指导意义。国内外学着建立了多种猪瘟疫苗抗体检测方法,目前应用最广泛的ELISA是美国Idexx公司生产的猪瘟疫苗抗体阻断ELISA检测试剂盒,该试剂盒判断标准中,阻断率大于等于40%为猪瘟疫苗抗体阳性,但根据阻断率和病毒中和试验间关系研究结果,该试剂盒检测猪瘟疫苗抗体阻断率达到50%时的猪瘟疫苗抗体水平相当于中和抗体滴度1∶32,此水平的中和抗体水平才对猪群具有保护力[3],实际生产中要以阻断率大于50%作为猪瘟疫苗抗体合格标准。一些利用该试剂盒进行猪瘟疫苗抗体检测研究的报道中以阳性率(阻断率大于40%)来作为判断抗体是否合格的标准不能反应猪群猪瘟疫苗抗体真实水平。本研究图1显示,猪瘟疫苗抗体阳性率和合格率有时差异较大,在某些阶段猪群中,猪瘟疫苗抗体阳性率达到50%,但抗体合格率却很低,甚至为0。因此,在利用Idexx公司猪瘟疫苗抗体阻断ELISA监测抗体是要以阻断率达到50%为判断抗体合格的最低标准,阻断率大于40%小于50%只代表抗体阳性,不代表中和抗体能抵抗猪瘟野毒侵袭[4]。
猪瘟疫苗抗体水平检测数据的科学分析是评价猪群猪瘟疫苗免疫效果的前提。猪场猪瘟疫苗免疫抗体合格率高于90%,变异系数母猪猪群小于25%,商品猪群小于30%是比较理想状态[4]。本试验监测的该猪场猪瘟疫苗抗体数据表明,该场母猪群猪瘟免疫接种效果较好,猪瘟疫苗抗体合格率为100%,抗体阻断率超过80%,变异系数小于20%,但商品代猪群猪瘟疫苗首免以后抗体下降迅速,抗体离散度较大,变异系数都高于50%,免疫空白期超过1个月,保育猪群风险较高。慕国辉等[5]在对仔猪猪瘟免疫相关因素系统研究后证实,高水平母源抗体对猪瘟疫苗首免影响显著,首免后猪瘟抗体上升率和上升幅度和母源抗体水平呈负相关。本研究检测的21日龄左右猪群猪瘟疫苗母源抗体水平还比较高,而此时进行猪瘟疫苗免疫接种是导致保育阶段猪群猪瘟抗体水平不理想的主要原因。
规模养猪是以群体免疫接种而不是个体免疫的理念进行疫苗免疫接种,在进行抗体监测时的抽样方式要代表一个群体的免疫状态,只有这样检测的数据才能对生产具有指导意义。在针对特定猪场猪瘟疫苗抗体监测研究的报道中[6-7],采用采集出生0、7、14、21、28 d,以此类推,间隔7 d采集一批样品的采样方式虽然时间准确,能反映猪群抗体变化规律,但对按一定生产周期为单位设计猪栏(舍)数量,严格执行全进全出和分区饲养的规模猪场生产指导却有一定欠缺,因为这些猪场猪群转入下一个生产区时一般也是按同一栏或同一栋(间)猪转入相应的栏舍饲养,猪的免疫也是按栏或栋为单位进行免疫,每一栏或一栋(间)猪舍中的猪出生日期有一定的时间跨度,实际操作中无法做到按准确出生天数进行免疫接种。因此,本研究采样是按猪场实际生产流程,采集的每一阶段样品即为免疫接种时间为同一天的同一猪群,所以出生时间有相应的跨度,按此采样方式检测的数据代表了该批次猪群整体抗体水平和变化规律,对优化免疫程序参考价值更大。
本研究选择的该猪场生产是以“周”为单位设计,即每周出生的哺乳仔猪断奶后转入相应的保育舍,每间保育舍猪再转入相应的生长育肥猪舍,但根据实际生产记录和免疫接种信息查阅发现,在实际生产中每批猪的出生时间跨度相差较大,基本都超过7 d,跨度最大的达到12 d,导致和生产流程设计误差较大的原因是同一时间段内(7 d)分娩母猪数不均衡,同一栏猪出生时间跨度较大,这也成为导致该猪场猪瘟免疫效果不理想,抗体水平不均匀,变异系数较高的重要原因。要想提高规模猪场群体免疫的效果,必须有科学合理的生产流程和管理措施作为保障。
疫苗免疫接种仍是控制猪瘟主要手段,科学的免疫程序对提高猪瘟疫苗免疫效果至关重要。对不同猪场猪瘟免疫监测研究确定的免疫程序都不相同[8-9],因此,猪场要重视猪瘟疫苗抗体监测,根据抗体消长情况对免疫接种方案及时做出调整优化,提高疫苗免疫效果。养猪生产是一个系统工程,疫苗免疫效果和猪舍设计,配种分娩、转栏转群、饲养管理等关系密切,要树立群体免疫理念,重视群体免疫接种技术研究与应用,提高疫苗免疫效果,才能提高猪群抵御病原微生物侵袭的能力。
参考文献:
[1]赵德明,张仲秋,沈建忠.猪病学[M].9版.北京:中国农业出版社,2009:325-335.
[2]丘惠深,郎洪武,王在时,等.猪瘟兔化弱毒疫苗与我国近年猪瘟免疫保护相关性试验[J].中国兽医杂志,1997,31(3):1-3.
[3]李维诚.Idexx ELISA 法在猪瘟之监控与应用[J].台湾中兴大学学报,2000(8):23-30.
[4]杜希珍,高丽娜,赵海山,等.规模化猪场母猪群猪瘟抗体血清学调查[J].猪业科学,2009,26(6):86-88.
[5]慕国辉.规模化猪场仔猪瘟免疫主要相关因素的研究[D].陕西杨凌:西北农林科技大学,2013.
[6]闫学军,邹迎梅.猪瘟母源抗体在仔猪体内持续时间的研究[J].今日养猪业,2012(6):14-17.
[7]马强,任巧玲,邢宝松,等.仔猪猪瘟母源抗体消长规律研究[J].河南农业科学,2011,40(9):130-132.
[8]王继英,牛晓燕,郝小静,等.21日龄猪瘟疫苗首次免疫前后仔猪抗体水平变化[J].华北农学报,2011,35(2):57-61.
[9]王波,陈静,王敏,等.仔猪猪瘟母源抗体消长规律[J].中国兽医学报,2010,30(4):453-455.
Monitoring of Classical Swine Fever Antibody Level in a Large Scale Pig Farm
NAN Wen-jin1,3,HUANG Jian-qiang1,3, HU Hong-hui1,3, WU Jing-bo,3, PENG Guo-liang2,3
(1.LaboratoryofAnimalDisease,ShaoguanUniversity,Shaoguan,Guangdong,512005,China;2.SchoolofAgriculturalScienceandEngineering,ShaoguanUniversity,Shaoguan,Guangdong,512005,China;3.NorthGuangdongCollaborativeInnovationandDevelopmentCenterofPigFarmingandDiseaseControl,Shaoguan,Guangdong,512005,China)
Abstract:In order to make immune effect evaluation and further optimize the immune procedure of classical swine fever virus(CSFV)vaccine in a pig farm,the blood samples of different day age of piglets and fattening pigs were collected from the farm and detected by CSFV antibody blocking ELSIA kit.Based on antibody qualified rate,average blocking rate and coefficient of variation,combined with CSFV immunization program,the testing data showed that the pig farm immunity blank period was too long,the antibody qualified rate was low,which increased the risk of CSFV infection,the CSF vaccine immunization program timely should be optimized.Antibody level monitoring is important to CSF prevention and control.The experiment can provide reference for detection antibody and making reasonable immune procedure against CSF.
Key words:Classical swine fever;antibody level;immune procedure;monitoring
文章编号:1007-5038(2016)03-0120-04
中图分类号:S852.651
文献标识码:B
作者简介:南文金(1981-),男,河南灵宝人,助理研究员,硕士,主要从事动物疫病防控技术研究。
基金项目:广东省科技计划项目(2011B020305009);韶关市科技计划项目(2013CX/N09)
收稿日期:2015-05-10
