副猪嗜血杆菌HigB和HigA基因的原核表达及功能分析
2016-04-07徐玉智李淑芳张培君龚玉梅王宏俊
徐玉智,李淑芳,张培君,龚玉梅,王宏俊*
(1.北京市农林科学院畜牧兽医研究所畜禽疫病防控技术北京市重点实验室,北京 100097;2.沈阳农业大学生物科学与技术学院,辽宁沈阳 110866)
副猪嗜血杆菌HigB和HigA基因的原核表达及功能分析
徐玉智1,2,李淑芳1,张培君1,龚玉梅1,王宏俊1*
(1.北京市农林科学院畜牧兽医研究所畜禽疫病防控技术北京市重点实验室,北京 100097;2.沈阳农业大学生物科学与技术学院,辽宁沈阳 110866)
摘要:副猪嗜血杆菌属于条件性致病菌,可引起猪的格拉泽病,表现为多发性浆膜炎和关节炎。毒素抗毒素系统(TA)广泛存在于细菌中,其参与各种应激状态下的生理调节,利于机体适应复杂环境。克隆编码副猪嗜血杆菌的HigBA毒素抗毒素蛋白的基因,并对其进行原核表达和分析鉴定。结果发现,HigB对生长有抑制作用,而HigA可以中和这种作用,HigBA构成一对毒素抗毒素系统。HigB在高温和高密度时,表达量显著增加,显示其参与逆境环境下的生理调控。
关键词:副猪嗜血杆菌; HigBA; 生长抑制试验; 实时荧光定量PCR
典型的TA系统包括稳定的毒素和不稳定的抗毒素,毒素与抗毒素形成复合物,抑制毒素的生理功能,在一定的条件下,不稳定的抗毒素被降解,毒素通过断裂特定的mRNA而发挥生理调控功能[1-2]。TA系统最早在一些低拷贝的质粒中被发现,细菌分裂时如果丢失质粒,细菌不能生长,从而可以保证质粒稳定遗传,因而质粒中的TA系统又叫做质粒稳定元素。对基因组中的TA系统功能还知之甚少,可能与质粒中的TA系统有相似的功能,它们很可能参与稳定基因组中的基因组分或者作为压力反应元素,调控细菌的生长或死亡[3-4]。
根据毒素的属性和它们之间的相互作用方式,TA系统可以分为5种类型。在所有类型中,毒素都是蛋白,抗毒素可能是蛋白(Ⅰ、Ⅳ、Ⅴ型)或者是RNA(Ⅰ、Ⅲ型)。在Ⅰ型中,抗毒素通过黏附毒素mRNA来抑制毒素;在Ⅱ和Ⅲ型中,抗毒素蛋白和抗毒素RNA直接黏附毒素蛋白;在Ⅳ型中,抗毒素修饰保护毒素作用位点;在Ⅴ型中,抗毒素是mRNA酶特异的裂解毒素的mRNA[5-6]。HigBA毒素-抗毒素系统属于Ⅱ型,其特点是毒素与抗毒素都是蛋白,通过形成毒素-抗毒素复合物,抑制毒素功能。HigBA首先在Rst1质粒中发现,然后在铜绿假单胞菌、耐甲氧苄青霉素金黄色葡萄球菌等基因组中发现[7]。HigB毒素属于RelE家族,在结核分支杆菌中证明HigB具有翻译依赖的mRNA酶活性,在重组大肠埃希菌中表达可以抑制其生长。在适宜的环境,HigA与HigB结合成无毒的复合物,并且HigA可以结合到HigBA操纵子的启动子区域,阻止HigBA转录,从而HigB不表现出活性,并且HigBA操纵子不进行转录。在应激状态下,如氨基酸缺乏、高温、高密度、氧胁迫等情况下,HigA被Lon或Clp蛋白酶降解,HigB表现出活性,并且HigBA操纵子进行转录[8]。在巴斯德杆菌属杜克雷嗜血杆菌和巴斯德杆菌目前没有发现TA系统,流感嗜血杆菌含有6个TA系统[9]。与流感嗜血杆菌TA系统进行序列比对,发现副猪嗜血杆菌也含有HigBA毒素抗毒素系统。本研究对副猪嗜血杆菌的HigBA毒素抗毒素系统进行了初步验证,证明其参与逆境下生理调控。研究结果为副猪嗜血杆菌染色体上其他TA系统的鉴定及功能研究奠定了基础。
1材料与方法
1.1材料
1.1.1质粒和菌株pGM-T载体、pET30a表达载体、TOP10、BL21(DE3)、BL21(DE3)plyss,北京天根生化科技有限公司产品;pETduet双表达载体,武汉淼灵生物科技有限公司产品;副猪嗜血杆菌5型标准株,澳大利亚昆士兰动物研究所Pat博士惠赠,由北京市农林科学院高新技术研究室保存;15个副猪嗜血杆菌标准株,澳大利亚昆士兰研究所Pat惠赠;副猪嗜血杆菌分离株,本实验室分离和保存。
1.1.2主要试剂T载体试剂盒、质粒提取试剂盒、卡那霉素、氨苄霉素、DNA Marker DL 2 000;Color prestained protein marker、IPTG,北京天根生化科技公司产品;T4 DNA连接酶,TaKaRa公司产品;限制性内切酶,NEB公司产品;蛋白纯化试剂盒,Roche公司产品,包含纯化柱子、LysisⅠ、LysisⅡ、WashⅠ、WashⅡ、Elution等;TSA固体培养基、TSB液体培养基、LB液体培养基,BD公司产品。
1.2方法
1.2.1HigB、HigA重组质粒构建
1.2.1.1PCR扩增以副猪嗜血杆菌5型标准株DNA为模板,根据副猪嗜血杆菌HigB、HigA基因序列(Gene ID:7276935和7276936),分别设计引物对primers1,primers2(表1),用来克隆HigB和HigA。 primers1 用于纯化HigB,Permers4 用于生长抑制试验,Permers5 用于实时荧光定量PCR,分别标为HigB1、2、3。
PCR反应体系:上下游引物各1 μL,模板1 μL,2×PCR StarMix 10μL,ddH2O 7μL。反应条件:94 ℃ 5 min,94 ℃ 1 min,59 ℃ 45 s,72 ℃延伸40 s,30个循环;72 ℃ 10 min。

表1 本试验所用引物
1.2.1.2酶切转化用BamHⅠ和HindⅢ酶切pET30a质粒和HigB、HigA的PCR产物,T4 DNA连接酶连接,分别转化入BL21(DE3)plyss和BL21(DE3)表达菌株,筛选阳性克隆,分别命名BL21plyss-pET30a-HigB和BL21-pET30a-HigA。
1.2.2HigB、HigA诱导表达和鉴定分别挑取BL21plyss-pET30a-HigB和BL21-pET30-HigA单菌落,接入LB培养基(Kna浓度25 μg/mL),过夜,次日1∶100接入新鲜的LB培养基(Kna抗性),培养至OD 600 nm=0.6,加IPTG(终浓度1 mmol/L),诱导4 h。收集菌体,取样进行SDS-PAGE。
1.2.3HigB、HigA纯化 按试剂盒说明操作,即诱导表达1 L菌液,4℃超声离心菌液,用LysisⅠ清洗。将沉淀悬浮于LysisⅡ中,4℃离心裂解的菌体。用平衡后的5 mL His标签Ni-琼脂糖与上清混合,4 ℃搅拌过夜。将样品与Ni-琼脂糖填料混合物装柱,用5倍Ni-琼脂糖填料体积的WashⅠ、WashⅡ和Elution冲洗柱子,分别收集流穿液。收集的流穿液进行SDS-PAGE和Western blot分析,所用的一抗为兔抗副猪嗜血杆菌阳性血清(本实验室保存),二抗为辣根过氧化物酶标记的羊抗兔IgG(Goat Anti-Rabbit IgG, HRP Conjugated 康为世纪)。
1.2.4生长抑制试验
1.2.4.1重组质粒构建利用引物Primers4(表1)扩增HigB并插入pETduet质粒,利用引物primers4和primers1(表1)分别扩增HigB和HigA并同时插入pETduet质粒,然后转化入大肠埃希菌BL21(DE3),分别命名为BL21Duet-HigB和BL21Duet-HigBA。
1.2.4.2大肠埃希菌生长抑制试验重组大肠埃希菌BL21 Duet-HigB生长至OD 600 nm=0.4时,加入1 mmol/L IPTG,每小时测1次OD,绘制生长曲线,记作生长曲线1;重组大肠埃希菌BL21 Duet-HigB生长至OD 600 nm=0.4时,不加1 mmol/L IPTG,每小时测一次OD,绘制生长曲线,记作生长曲线2;重组大肠埃希菌BL21 Duet-HigBA生长至OD 600 nm=0.4时,加入1 mmol/L IPTG,每小时测一次OD,绘制生长曲线,记作生长曲线3。
1.2.5real-time PCR用实时荧光定量PCR方法分析HigB在高温和高密度条件下的表达差异,用Primer5.0软件设计特异引物Primers5、6,由华大基因科技有限公司合成。
1.2.5.1real-time PCR样品挑取5型副猪嗜血杆菌单菌落加入TSB液体培养基,37 ℃过夜培养后按照1∶50接入新鲜液体培养基中。设3个试验组:C组 37 ℃,培养6 h,作为对照组;B组40 ℃,培养6 h,作为高温组;A组 37 ℃,培养9 h,作为高密度组。分别收集处理后的3组样品,用Trizol方法提取总RNA,反转录为cDNA。
1.2.5.2real-time PCR扩增PCR反应体系:H2O 6.6 μL,2×PCR Mix 8 μL,上下游引物各0.2 μL,cDNA 1 μL。 PCR反应条件:95 ℃ 2 min;94 ℃ 10 s,57 ℃ 10 s,72℃ 40 s,40个循环。
2结果
2.1副猪嗜血杆菌HigB和HigA基因扩增
用5型标准株作为模板,用引物Primers1,Primers2,分别扩增HigB和HigA基因,目的片段大小分别是279 bp和273 bp(图1)。

1.HigA阴性对照;2.HigA PCR产物;3.HigB阴性对照;4.HigB PCR产物;M.DNA标准 DL 2 000
1.Negative control of HigA; 2.PCR products of HigA; 3.Negative control of HigB;M.DNA Marker DL 2 000
图1HigB和HigA PCR扩增
Fig.1PCR amplication of HigB and HigA
2.2副猪嗜血杆菌HigB和HigA原核表达与纯化
重组BL21plyss-pET30a-HigB菌株和重组BL21-pET30a-HigA菌株诱导表达后,进行纯化(图2和图3)。Western blot分析发现,兔抗副猪嗜血杆菌阳性血清与HigB和HigA蛋白反应(图4)。
2.3生长抑制试验结果
重组大肠埃希菌BL21 Duet-HigB加IPTG诱导后,OD值没有随时间的延长而升高,而是维持在0.5左右;而未加IPTG的重组大肠埃希菌BL21 Duet-HigB,OD值明显升高,生长曲线差异明显。并且重组大肠埃希菌BL21 Duet-HigBA加IPTG诱导组与未加IPTG诱导的重组大肠埃希菌BL21 Duet-HigB,生长曲线差异不明显(图4)。表明HigB蛋白能够抑制大肠埃希菌生长,HigA蛋白可以中和HigB蛋白的抑制作用,初步鉴定出HigB和HigA蛋白构成一对毒素抗毒素系统。
2.4real-time PCR结果
实时荧光定量PCR分析HigB表达情况,高温组和高密度组HigB mRNA表达量与对照相比差异显著(P<0.01)(图5)。说明在不适环境下,大肠埃希菌HigB mRNA转录水平显著提高。

M.蛋白分子质量标准;1.未诱导的BL21plyss-PET30a;2.未诱导的BL21plyss-pET30a-HigB对照;3.诱导后的BL21plyss-pET30a-HigB全菌;4.诱导后的BL21plyss-pET30a-HigB上清;5.诱导后的BL21plyss-pET30a-HigB沉淀;6.未诱导的BL21-PET30a;7.未诱导的BL21-pET30a-HigA对照; 8.诱导后的BL21-pET30a-HigA全菌;9.诱导后的BL21-pET30a-HigA上清; 10.诱导后的BL21-pET30a-HigA沉淀
M.Protein molecular weigh Marker;1.Uninduced BL21plyss-PET30a;2.uninduced BL21plyss-pET30a-HigB control;3.Induced products of BL21plyss-pET30a-HigB;4.Supernatant of induced products BL21plyss-pET30a-HigB;5.Precipitation of induced products BL21plyss-pET30a-HigB;6.Uninduced BL21-PET30a;7.Uninduced BL21-PET30a-HigA control;8.induced products of BL21-pET30a-HigA;9.Precipitation of induced products BL21-pET30a-HigA;10.Precipitation of induced products BL21-pET30a-HigA
图2纯化后的HigB和HigA蛋白
Fig.2Purified proteins of HigB and HigA
3讨论
重组大肠埃希菌BL21(DE3)-pET30a-HigB诱导后,进行纯化,流穿液进行SDS-PAGE电泳看不到明显的目的条带,可能是由于表达量低。将该重组质粒转化入大肠埃希菌BL21(DE3)plyss菌株,构建BL21(DE3)plyss-pET30a-HigB重组大肠埃希菌,SDS-PAGE电泳可以看见明显的纯化条带。可能因为BL21(DE3)plyss菌株可以降低目的基因的背景表达,更适合表达有毒性的蛋白。
近年来,副猪嗜血杆菌的感染引起了猪的高发病率和高病死率,已给养猪业造成巨大经济损失[10]。然而,关于副猪嗜血杆菌在猪体内生长适应性和引起疾病的机理还不是很清楚。有研究表明,流感嗜血杆菌[11]和鲍曼不动杆菌[12]的TA系统有助于其在宿主体内滞留。副猪嗜血杆菌在猪体内滞留进而引起疾病,很可能也与TA系统有关。我们的结果证明,副猪嗜血杆菌HigBA构成一对毒素-抗毒素系统,在逆境环境下参与生理调控。副猪嗜血杆菌寄生在呼吸道,需要面临复杂的环境。TA系统的存在,在mRNA水平进行精细调控,能使其对外界环境进行快速反应。

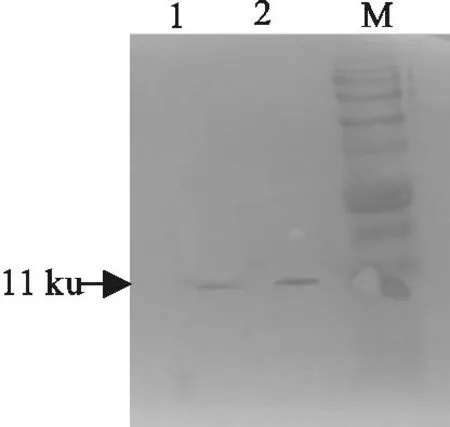
M.蛋白分子质量标准;1.纯化的HigA蛋白;2.纯化的HigB蛋白
M.Protein molecular weight Marker;1.Purified protein of HigA;
2.Purified protein of HigB
图3纯化的HigB和HigA蛋白
Fig.3Purified protein of HigB and HigA
M.蛋白分子质量标准;1.纯化的HigA蛋白;2.纯化的HigB蛋白
M.Protein molecular weigh Marker;1.Purified protein of HigA;2.Purified protein of HigB
图4纯化的HigB和HigA蛋白的Western blot 分析
Fig.4Western blot analysis of purified proteins HigB and HigA
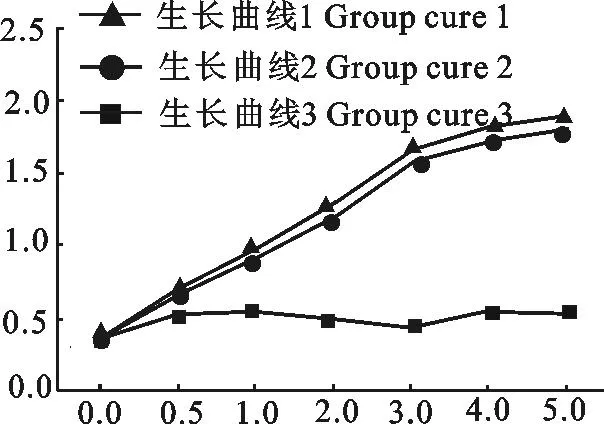
图5 重组大肠埃希菌生长曲线

图6 HigB的mRNA相对表达量
参考文献:
[1]路明华,王雪敏,李淑芳,等.副猪嗜血杆菌单因子血清的制备[J].动物医学进展,2014,35(7):21-24.
[2]熊名,李明,郑丹阳,等.毒素-抗毒素系统在应激环境下的生物学作用的研究进展[J].现代生物医学进展,2013,13(1):167-169.
[3]Ramage H R,Connolly L E,Cox J S.Comprehensive functional analysis ofMycobacteriumtuberculosistoxin-antitoxin systems: implications for pathogenesis, stress responses, and evolution [J].PLoS Genet,2009,5:e1000767.
[4]Yamaguchi Y,Inouye M.mRNA interferases, sequence-specific endoribonucleases from the toxin-antitoxin systems [J].Prog Mol Biol Transl Sci,2009,85:467-500.
[5]Schuster C F,Bertram R.Toxin-antitoxin systems are ubiquitous and versatile modulators of prokaryotic cell fate [J].FEMS Microbiol Lett,2013,340:73-85.
[6]楚海荣,付玉荣,伊正军.细菌毒素抗毒素系统研究进展[J].细胞与分子免疫学杂志,2015,31(2):271-274.
[7]Jurenaite M,Markuckas A,Suziedeliene E. Identification and characterization of type Ⅱ toxin-antitoxin systems in the opportunistic pathogenAcinetobacterbaumannii[J].J Bacteriol,2013,195(14):3165-3172.
[8]Schuessler D L,Cortes T,Fivian-Hughes A S,et al.Induced ectopic expression of HigB toxin inMycobacteriumtuberculosisresults in growth inhibition, reduced abundance of a subset of mRNAs and cleavage of tmRNA[J].Mol Microobiol,2013,90(1):195-207.
[9]Pandey D P,Gerdes K.Toxin-antitoxin loci are highly abundant in free-living but lost from host-associated prokaryotes[J].Nucleic Acid Res,2005,33(3):966-976.
[10]马广鹏.副猪嗜血杆菌毒力因子研究进展[J].动物医学进展,2013,34(2):83-88.
[11]Ren D B,Kordis A A,Sonenshine D E,et al.The ToxAvapA Toxin-antitoxin locus contributes to the survival of nontypeableHaemophilusinfluenzaeduring Infection[J].PLoS One,2014,9(3):e91523.
[12]马亚男,朱玉莹,李维城,等.鲍曼不动杆菌耐药滞留菌的特征及Ⅱ型毒素-抗毒素系统的多样性[J].微生物学报,2015,55(7):949-958.
Prokaryotic Expression and Function Analysis ofHaemophilusparasuisHigB and HigA Genes
XU Yu-zhi1,2,Li Shu-fang1,ZHANG Pei-jun1,GONG Yu-mei1,Wang Hong-jun1
(1.BeijingInstituteofAnimalHusbandryandVeterinaryMedicine,BAAFS,BeijingMunicipalKeyLaboratoryofAnimalDieasePreventionandControlTechnology,Beijing,100097,China;2.CollegeofBiologicalTechnology,ShenyangAgriculturalUniversity,Shenyang,Liaoning,110866,China)
Abstract:Haemophilus parasuis is a conditional pathogenic bacterium,and could cause swine Glaser's disease,which is manifested as polyserositis and arthritis.TA system widely exists in bacteria,which involves in physiological regulation in stress states for adapting to complex environment.There are few reports about the TA system of Haemophilus parasuis,so the genes of HigB and HigA were screened and cloned,and then they were expressed and identified in prokaryotic expression system.The results showed that,HigBA is a pair of toxin-antitoxin system,in which HigB could inhibit the growth,while HigA could neutralize this effect.The expression of HigB was significantly increased at high temperature and high density,which indicated that it participated in the physiological regulation of stress.
Key words:Haemophilus parasuis;HigBA;growth inhibition test; qRT-PCR
文章编号:1007-5038(2016)03-0059-05
中图分类号:S852.612;Q786
文献标识码:A
作者简介:徐玉智(1990-),男,河南新乡人,硕士研究生,主要从事动物分子生物学研究。 *通讯作者
基金项目:北京市农林科学院创新能力建设项目(KJCX20140410);“863”子课题(2011AA10A210);北京市农林科学院“双百对接”项目
收稿日期:2015-08-04
